名校
1 . 某学习小组为了探究影响高锰酸钾酸性溶液与NaHSO3溶液反应速率的因素,该小组设计如表实验方案。
下列说法不正确的是
| 实验 | V(NaHSO3)/mL c=0.2mol·L-1 | V(KMnO4)/mL c=0.1mol·L-1 | V(H2SO4)/mL c=0.6mol·L-1 | V(MnSO4)/mL c=0.1mol·L-1 | V(H2O)mL | 褪色时间 t/min |
| 1 | 3.0 | 2.0 | 1.0 | 0.0 | 2.0 | 8 |
| 2 | 3.0 | 2.0 | 2.0 | 0.0 | a | 6 |
| 3 | 4.0 | 2.0 | 2.0 | 0.0 | 0.0 | 4 |
| 4 | 3.0 | 2.0 | 1.0 | 0.5 | b | 3 |
| A.a=1.0,b=1.5 |
| B.实验3从反应开始到反应结束这段时间内反应速率v(MnO4‑)=0.00625mol/(L。min) |
| C.实验证明MnSO4可能是该反应的催化剂 |
D.该反应的离子方程式为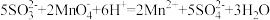 |
您最近半年使用:0次
名校
2 . 用 溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验,实验测得M的浓度与时间关系如图所示,下列说法不正确的是
溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验,实验测得M的浓度与时间关系如图所示,下列说法不正确的是
 溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验,实验测得M的浓度与时间关系如图所示,下列说法不正确的是
溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验,实验测得M的浓度与时间关系如图所示,下列说法不正确的是| 实验编号 | 温度/℃ | pH |
| ① | 25 | 1 |
| ② | 45 | 1 |
| ③ | 25 | 7 |
| ④ | 25 | 1 |

A.实验①在15min内M的降解速率为 |
| B.若其他条件相同,实验①②说明降低温度,M降解速率增大 |
| C.若其他条件相同,实验①③证明pH越大,越不利于M的降解 |
| D.该实验表明,温度、反应物浓度、pH对降解速率均有影响 |
您最近半年使用:0次
3 . 一定条件下在容积不变的容器中充入 和
和 发生如下反应:
发生如下反应: ,其他条件不变时,分别探究温度和催化剂的比表面积对上述反应的影响。实验测得
,其他条件不变时,分别探究温度和催化剂的比表面积对上述反应的影响。实验测得 与时间的关系如图所示。已知:
与时间的关系如图所示。已知:

ⅰ.起始投料比 均为2:3;
均为2:3;
ⅱ.比表面积:单位质量的物质具有的总面积。
下列说法不正确的是
 和
和 发生如下反应:
发生如下反应: ,其他条件不变时,分别探究温度和催化剂的比表面积对上述反应的影响。实验测得
,其他条件不变时,分别探究温度和催化剂的比表面积对上述反应的影响。实验测得 与时间的关系如图所示。已知:
与时间的关系如图所示。已知:
ⅰ.起始投料比
 均为2:3;
均为2:3;ⅱ.比表面积:单位质量的物质具有的总面积。
下列说法不正确的是
| A.Ⅰ、Ⅱ曲线证明催化剂比表面积对上述反应有影响 |
B.Ⅱ中 的平衡转化率为50% 的平衡转化率为50% |
C.在Ⅲ的条件下,该反应的平衡常数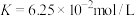 |
D. min,Ⅲ中平均反应速率 min,Ⅲ中平均反应速率 |
您最近半年使用:0次
解题方法
4 . 对于 的分解反应,
的分解反应, 、
、 均有一定的催化作用。为比较
均有一定的催化作用。为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙所示的实验。下列说法错误的是
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙所示的实验。下列说法错误的是

 的分解反应,
的分解反应, 、
、 均有一定的催化作用。为比较
均有一定的催化作用。为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙所示的实验。下列说法错误的是
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙所示的实验。下列说法错误的是
| A.图甲可通过观察气泡产生快慢来比较反应速率的大小 |
| B.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间 |
| C.为检查图乙所示装置的气密性,可关闭a处旋塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
D.图甲所示实验中,若左边试管里反应的速率大于右边,则证明 对 对 分解的催化效果比 分解的催化效果比 好 好 |
您最近半年使用:0次
5 . 大气的成分在工业上有重要的应用。
I.
(1)在恒容密闭容器中,发生反应N2(g)+3H2(g)⇌2NH3(g),下列说法可以证明反应已达到平衡状态的是_______ (填序号)。
①单位时间内生成nmolN2的同时生成2nmolNH3
②1个N≡N键断裂的同时,有6个N—H键形成
③1个N≡N键断裂的同时,有3个H—H键形成
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
(2)为提高H2的转化率,实际生产中宜采取的措施是_______ (填字母)。
A.及时移出氨 B.适当增大压强 C.循环利用和不断补充氮气 D.减小压强 E.降低温度
II.中国科学家首次实现了以二氧化碳为原料,不依赖植物光合作用,直接人工合成淀粉。已知CO2经催化加氢可以生成多种低碳有机物。
已知:①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=-49.5kJ·mol-1
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH=+40.9kJ·mol-1
③CO(g)+2H2(g)⇌CH3OH(g) ΔH3
回答下列问题:
(3)反应③的ΔH3为_______ 。
(4)一定温度下,在一体积固定的密闭容器中进行反应①,测得CO2的物质的量浓度随反应时间的变化如图所示:则反应进行的前5分钟内,v(H2)=____ ;10min时,改变的外界条件可能是_____ 。
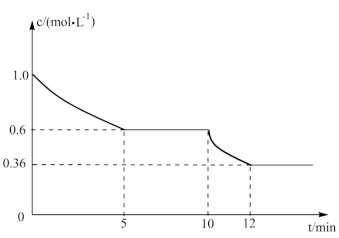
(5)已知一定温度下按照起始比 =2,在一密闭容器中进行反应③,保持总压为4MPa不变,达平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数Kp=
=2,在一密闭容器中进行反应③,保持总压为4MPa不变,达平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数Kp=_______ (各气体分压=平衡体系中各气体的体积分数×总压)。
I.
(1)在恒容密闭容器中,发生反应N2(g)+3H2(g)⇌2NH3(g),下列说法可以证明反应已达到平衡状态的是
①单位时间内生成nmolN2的同时生成2nmolNH3
②1个N≡N键断裂的同时,有6个N—H键形成
③1个N≡N键断裂的同时,有3个H—H键形成
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
(2)为提高H2的转化率,实际生产中宜采取的措施是
A.及时移出氨 B.适当增大压强 C.循环利用和不断补充氮气 D.减小压强 E.降低温度
II.中国科学家首次实现了以二氧化碳为原料,不依赖植物光合作用,直接人工合成淀粉。已知CO2经催化加氢可以生成多种低碳有机物。
已知:①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=-49.5kJ·mol-1
②CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH=+40.9kJ·mol-1
③CO(g)+2H2(g)⇌CH3OH(g) ΔH3
回答下列问题:
(3)反应③的ΔH3为
(4)一定温度下,在一体积固定的密闭容器中进行反应①,测得CO2的物质的量浓度随反应时间的变化如图所示:则反应进行的前5分钟内,v(H2)=

(5)已知一定温度下按照起始比
 =2,在一密闭容器中进行反应③,保持总压为4MPa不变,达平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数Kp=
=2,在一密闭容器中进行反应③,保持总压为4MPa不变,达平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数Kp=
您最近半年使用:0次
名校
6 . 某实验小组利用下图装置探究H2C2O4溶液与酸性KMnO4溶液的反应(夹持装置略去)。

查阅资料:①H2C2O4为二元弱酸。
②溶液浓度越大,越不利于气体的扩散。
(1)H2C2O4溶液与酸性KMnO4溶液反应的离子方程式为___________ 。
(2)仪器A的名称为___________ 。
(3)检查装置气密性的方法为___________ 。
(4)若以单位时间内生成的气体体积作为反应速率的观测指标,则量筒中的试剂为___________。
(5)探究H2C2O4溶液与酸性KMnO4溶液的浓度对反应速率的影响,实验数据如下表所示:
①c1=___________ 。
②某同学从实验1和2的褪色时间分析出实验2的反应速率小于实验1,请分析该结论是否正确,并说明原因:___________ 。
③结合实验数据,下列说法错误的是___________ 。(填标号)
A.其他条件不变时,c(H2C2O4)浓度越高,反应速率越快
B.其他条件不变时,当c(H2C2O4)为0.8mol·L-1,褪色时间一定介于163s至360s之间
C.实验5中v(H2C2O4)=0.15mol·L-1·min-1
D.其他条件不变时,当c(H2C2O4)>0.9mol·L-1,溶液浓度增大,不利于CO2扩散,可能导致褪色时间延长
(6)H2C2O4溶液与酸性KMnO4溶液生成的Mn2+对该反应有催化作用。请以实验1为对照组,设计实验方案证明Mn2+的催化作用___________ 。

查阅资料:①H2C2O4为二元弱酸。
②溶液浓度越大,越不利于气体的扩散。
(1)H2C2O4溶液与酸性KMnO4溶液反应的离子方程式为
(2)仪器A的名称为
(3)检查装置气密性的方法为
(4)若以单位时间内生成的气体体积作为反应速率的观测指标,则量筒中的试剂为___________。
| A.饱和NaHCO3溶液 | B.饱和NaCl溶液 | C.水 | D.饱和Na2CO3溶液 |
| 实验 序号 | KMnO4溶液 | H2C2O4溶液 | H2SO4溶液 | 褪色时间 | ||
| c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | t/s | |
| 1 | 0.005 | 4.0 | 0.2 | 2.0 | 0.120 | 307 |
| 2 | 0.020 | 4.0 | 0.2 | 2.0 | 0.120 | 545 |
| 3 | 0.010 | 4.0 | 0.5 | 2.0 | 0.120 | 201 |
| 4 | 0.010 | 4.0 | 0.7 | 2.0 | 0.120 | 163 |
| 5 | 0.010 | 4.0 | 0.9 | 2.0 | 0.120 | 360 |
| 6 | 0.010 | 4.0 | 1.0 | 2.0 | c1 | 512 |
②某同学从实验1和2的褪色时间分析出实验2的反应速率小于实验1,请分析该结论是否正确,并说明原因:
③结合实验数据,下列说法错误的是
A.其他条件不变时,c(H2C2O4)浓度越高,反应速率越快
B.其他条件不变时,当c(H2C2O4)为0.8mol·L-1,褪色时间一定介于163s至360s之间
C.实验5中v(H2C2O4)=0.15mol·L-1·min-1
D.其他条件不变时,当c(H2C2O4)>0.9mol·L-1,溶液浓度增大,不利于CO2扩散,可能导致褪色时间延长
(6)H2C2O4溶液与酸性KMnO4溶液生成的Mn2+对该反应有催化作用。请以实验1为对照组,设计实验方案证明Mn2+的催化作用
您最近半年使用:0次
2023-07-12更新
|
290次组卷
|
2卷引用:福建省厦门市2022-2023学年高一下学期期末考试化学试题
名校
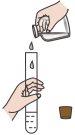
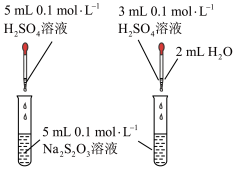
7 . 在化学反应的研究和实际应用中,人们除了选择合适的化学反应以实现所期待的物质转化或能量转化,还要关注化学反应进行的快慢和程度,以提高生产效率,下列关于化学反应速率和程度说法正确的是
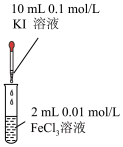 |  |  |  |
① | ② | ③ | ④ |
A.取少量图①充分反应后的溶液于试管中,若滴加KSCN溶液后溶液呈红色可以证明可逆反应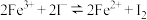 存在反应进行的限度 存在反应进行的限度 |
B.若图②是将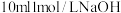 溶液一次性且快速加入到 溶液一次性且快速加入到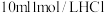 ,结束反应10s,则HCl的化学反应速率为 ,结束反应10s,则HCl的化学反应速率为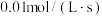 |
C.图③可以探究 浓度对化学反应速率的影响:左试管的速率大于右试管的速率 浓度对化学反应速率的影响:左试管的速率大于右试管的速率 |
D.图④比较 、 、 对反应 对反应 分解制氧气的化学反应速率催化效果 分解制氧气的化学反应速率催化效果 |
您最近半年使用:0次
2022-07-03更新
|
272次组卷
|
4卷引用:江西省上饶市六校2021-2022学年高一下学期期末联考化学试题
名校
8 . 用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计对比实验探究温度、浓度、pH对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是
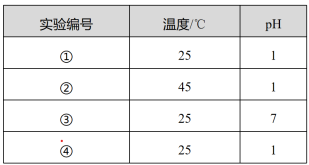
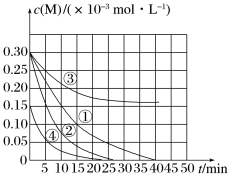


| A.实验①在15 min内M的降解速率约为1.33×10-5mol·L-1·min-1 |
| B.若其他条件相同,实验①②说明升高温度,M降解速率增大 |
| C.若其他条件相同,实验①③证明pH越高,越不利于M的降解 |
| D.实验④说明M的起始浓度越小,降解的速率越快 |
您最近半年使用:0次
2023-05-16更新
|
309次组卷
|
2卷引用:浙江省宁波效实中学2022-2023学年高一下学期期中考试化学(学考)试题
名校
解题方法
9 . 铁元素及其化合物在生活生产中有广泛的用途。回答下列问题:
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN- Fe(SCN)3
Fe(SCN)3
若溶液中含有Fe3+,则加入KSCN溶液后的现象为_________ 向加入KSCN后的混合溶液中再加入少量NaOH固体,观察到的现象是_____________ ,产生该现象的原因是________________ 。
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因__________________ 。
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生______ 、________ 两个反应(写离子方程式),若最后溶液中有固体剩余,则溶液中不可能含有的离子是____ 。
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为_____________ 若要验证该溶液中Fe2+未被完全氧化,则可以需要加入_____ 若出现_________ 现象,则证明Fe2+未被完全氧化。
(5)下列有关铁及其化合物的说法正确的是________
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
(1)Fe3+与SCN-的反应常用来检验Fe3+的存在: Fe3+ + 3SCN-
 Fe(SCN)3
Fe(SCN)3 若溶液中含有Fe3+,则加入KSCN溶液后的现象为
(2)向FeSO4溶液中滴入NaOH溶液,会观察到先产生白色沉淀,后迅速变为灰绿色,久置后变为红褐色,用化学方程式说明产生该现象的原因
(3)FeCl3溶液常被用作蚀刻剂腐蚀印刷电路板: 2Fe3++ Cu==2Fe2+ + Cu2+在过量FeCl3溶液腐蚀印刷电路板后的溶液中,加入过量铁粉,依次发生
(4)FeCl2溶液在空气中容易被氧化,0.1 mol· L-1的FeCl2溶液暴露在空气中,20min 后,Fe2+的浓度变为0.05 mol· L-1,则20 min内,以Fe2+ 表示的平均反应速率为
(5)下列有关铁及其化合物的说法正确的是
A.铁是第四周期第VIIIB族元素
B.亚铁盐只有还原性,没有氧化性
C.铁粉和铜粉的混合物可用磁铁吸引的方法分离
D.工业上通常采用电解法来冶炼单质铁
E.Fe3O4是一种纯净物
F.铁粉和氧化铝的混合物是一种铝热剂
您最近半年使用:0次
名校
解题方法
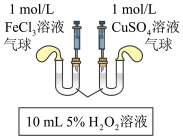
10 . 对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。下列说法不正确的是


| A.图甲可通过观察气泡产生快慢来比较反应速率的大小 |
| B.图甲所示实验中,若左边试管里的反应速率大于右边的,则证明Fe3+对H2O2分解的催化效果比Cu2+的好 |
| C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间 |
| D.为检查乙装置的气密性,可关闭a处旋塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
您最近半年使用:0次
2021-10-10更新
|
281次组卷
|
7卷引用:江西省南昌八一中学2021-2022学年高二上学期10月份月考化学试题



