名校
1 . 某学习小组为了探究影响高锰酸钾酸性溶液与NaHSO3溶液反应速率的因素,该小组设计如表实验方案。
下列说法正确的是
| 实验 | V(NaHSO3)/mL c=0.1 mol/L | V(KMnO4)/mL c=0.6 mol/L | V(H2SO4)/mL c=0.1 mol/L | V(MnSO4)/mL c=0.1 mol/L | V(H2O)/mL | 褪色时间t/min |
| 1 | 3.0 | 2.0 | 1.0 | 0.0 | 2.0 | 8 |
| 2 | 3.0 | 2.0 | 2.0 | 0.0 | a | 6 |
| 3 | 4.0 | 2.0 | 2.0 | 0.0 | 0.0 | 4 |
| 4 | 4.0 | 2.0 | 1.0 | 0.5 | b | 3 |
A.该反应的离子方程式为:5 +2 +2 +6H+=2Mn2++5 +6H+=2Mn2++5 +3H2O +3H2O |
| B.a=1.0,b=0.5 |
C.实验3从反应开始到反应结束这段时间内反应速率v( )=0.025 mol/(L∙min) )=0.025 mol/(L∙min) |
D.实验证明 可能是该反应的催化剂 可能是该反应的催化剂 |
您最近一年使用:0次
2023-04-25更新
|
356次组卷
|
3卷引用:贵州省遵义市仁怀市高中教育联盟2022-2023学年高一下学期5月期中考试化学试题
贵州省遵义市仁怀市高中教育联盟2022-2023学年高一下学期5月期中考试化学试题(已下线)【2023】【高一下】【其他】【余高2】【高中化学】【刘尼尼收集】山东省东营市利津县高级中学2022-2023学年高一下学期5月月考化学试题
2 . 硝酸工业与合成氨工业密切相关,氨氧化法是工业生产中制取硝酸的主要途径,其主要流程如图:

I. 在一容积为2L的密闭容器内加入2molN2和6molH2,在一定条件下合成氨气,已知N2(g)+3H2(g) 2NH3 △H<0。反应中NH3的物质的量浓度的变化情况如图所示
2NH3 △H<0。反应中NH3的物质的量浓度的变化情况如图所示

(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为______
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为________ (填序号)。
a. 0. 8mol/L b.1.0mol/L. c.1.2mol/L d. 2. mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_________ (选填“大于”“等于”或“小于”)二分之一倍的原体积。
Ⅱ.某小组同学欲探究由NH3制取HNO3的过程,设计按如图所示装置进行试验。

(1)A装置中发生反应的化学方程式为_________________________________ 。
(2)B装置制备的物质为_________________ 。(填序号)
A . NH3 B Cl2 C.O2 D. HCl
(3)该实验中能够证明有二氧化氮产生的现象为_______________________ 。
(4)已知E中装有2mol/L的硫酸150mL和足量铜片,若E中出现溶液变蓝色的现象,所有反应的铜均转化为CuSO4,则至少需要产生标况下_______ L氨气(假设各步反应均完全进行)。

I. 在一容积为2L的密闭容器内加入2molN2和6molH2,在一定条件下合成氨气,已知N2(g)+3H2(g)
 2NH3 △H<0。反应中NH3的物质的量浓度的变化情况如图所示
2NH3 △H<0。反应中NH3的物质的量浓度的变化情况如图所示
(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为
a. 0. 8mol/L b.1.0mol/L. c.1.2mol/L d. 2. mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积
Ⅱ.某小组同学欲探究由NH3制取HNO3的过程,设计按如图所示装置进行试验。

(1)A装置中发生反应的化学方程式为
(2)B装置制备的物质为
A . NH3 B Cl2 C.O2 D. HCl
(3)该实验中能够证明有二氧化氮产生的现象为
(4)已知E中装有2mol/L的硫酸150mL和足量铜片,若E中出现溶液变蓝色的现象,所有反应的铜均转化为CuSO4,则至少需要产生标况下
您最近一年使用:0次
解题方法
3 . 为了实现“碳中和”, 的综合利用成为科学家研究的热点。
的综合利用成为科学家研究的热点。
(1)将 催化加氢制取
催化加氢制取 ,通过下列步骤实现,反应过程中能量变化如图1所示。
,通过下列步骤实现,反应过程中能量变化如图1所示。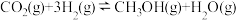

___________  。
。
(2)在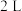 的绝热密闭容器中,按
的绝热密闭容器中,按 充入
充入 和
和 ,在催化剂作用下合成甲醇。下列说法中说明主反应
,在催化剂作用下合成甲醇。下列说法中说明主反应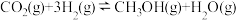 达到平衡状态的是___________(填字母)。
达到平衡状态的是___________(填字母)。
(3)在密闭容器中通入 和
和 的混合气体,制取甲醇过程中,存在竞争反应:
的混合气体,制取甲醇过程中,存在竞争反应:
 .
.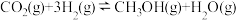 ;
;
 .
.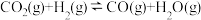
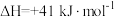 。
。
在不同压强下,当按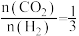 进料,反应达到平衡时,测得甲醇的物质的量分数与温度的关系如图2所示物质ⅰ的物质的量分数:
进料,反应达到平衡时,测得甲醇的物质的量分数与温度的关系如图2所示物质ⅰ的物质的量分数: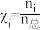 )
)___________ ,判断的依据是___________ 。
②图2中,当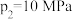 、发生上述反应,反应
、发生上述反应,反应 达到平衡时,
达到平衡时,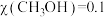 ,则在
,则在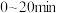 内用
内用 的分压变化表示的速率
的分压变化表示的速率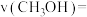
___________ 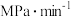 ,此时反应I中
,此时反应I中 的转化率为
的转化率为___________ (保留小数点后1位)。
③在压强为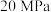 时,发生上述反应并达到平衡状态,
时,发生上述反应并达到平衡状态, 平衡转化率为
平衡转化率为 ,
,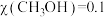 ,该温度下反应
,该温度下反应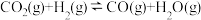 的平衡常数
的平衡常数
___________ (保留1位有效数字,用各组分的分压代替浓度计算平衡常数 ,气体分压=总压×物质的量分数)。
,气体分压=总压×物质的量分数)。
 的综合利用成为科学家研究的热点。
的综合利用成为科学家研究的热点。(1)将
 催化加氢制取
催化加氢制取 ,通过下列步骤实现,反应过程中能量变化如图1所示。
,通过下列步骤实现,反应过程中能量变化如图1所示。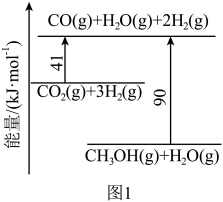
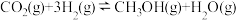

 。
。(2)在
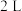 的绝热密闭容器中,按
的绝热密闭容器中,按 充入
充入 和
和 ,在催化剂作用下合成甲醇。下列说法中说明主反应
,在催化剂作用下合成甲醇。下列说法中说明主反应 达到平衡状态的是___________(填字母)。
达到平衡状态的是___________(填字母)。A. 的转化率保持不变 的转化率保持不变 | B.混合气体的密度保持不变 |
C.断裂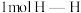 键同时形成 键同时形成 键 键 | D.容器内混合气体温度保持不变 |
(3)在密闭容器中通入
 和
和 的混合气体,制取甲醇过程中,存在竞争反应:
的混合气体,制取甲醇过程中,存在竞争反应: .
.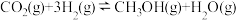 ;
; .
.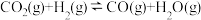
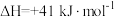 。
。在不同压强下,当按
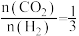 进料,反应达到平衡时,测得甲醇的物质的量分数与温度的关系如图2所示物质ⅰ的物质的量分数:
进料,反应达到平衡时,测得甲醇的物质的量分数与温度的关系如图2所示物质ⅰ的物质的量分数: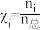 )
)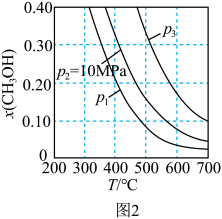
②图2中,当
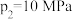 、发生上述反应,反应
、发生上述反应,反应 达到平衡时,
达到平衡时,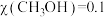 ,则在
,则在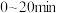 内用
内用 的分压变化表示的速率
的分压变化表示的速率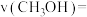
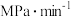 ,此时反应I中
,此时反应I中 的转化率为
的转化率为③在压强为
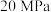 时,发生上述反应并达到平衡状态,
时,发生上述反应并达到平衡状态, 平衡转化率为
平衡转化率为 ,
,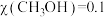 ,该温度下反应
,该温度下反应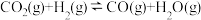 的平衡常数
的平衡常数
 ,气体分压=总压×物质的量分数)。
,气体分压=总压×物质的量分数)。
您最近一年使用:0次
4 . T℃下,在恒容密闭容器中,充入2mol  (g)和3mol CO(g)发生反应
(g)和3mol CO(g)发生反应
 ,反应过程中
,反应过程中 (g)浓度随时间的变化如图所示。下列说法错误的是
(g)浓度随时间的变化如图所示。下列说法错误的是

 (g)和3mol CO(g)发生反应
(g)和3mol CO(g)发生反应
 ,反应过程中
,反应过程中 (g)浓度随时间的变化如图所示。下列说法错误的是
(g)浓度随时间的变化如图所示。下列说法错误的是
| A.该容器的容积为10L |
B.0~10min内, |
C.若10min后再向容器中充入2mol  (g)和2mol (g)和2mol  (g), (g), |
| D.T℃下,该反应的平衡常数为0.5 |
您最近一年使用:0次
解题方法
5 . 哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向 密闭容器中充入
密闭容器中充入 和
和 ,在一定条件下发生反应:
,在一定条件下发生反应: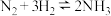 ,经过
,经过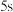 的时间,
的时间, 减少了
减少了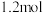 ,下列有关说法错误的是
,下列有关说法错误的是
 密闭容器中充入
密闭容器中充入 和
和 ,在一定条件下发生反应:
,在一定条件下发生反应: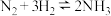 ,经过
,经过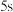 的时间,
的时间, 减少了
减少了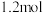 ,下列有关说法错误的是
,下列有关说法错误的是A.使用催化剂, 和 和 就能全部转化为 就能全部转化为 |
B. 内,用 内,用 表示的化学反应速率为 表示的化学反应速率为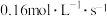 |
C.恒温恒容下,充入惰性气体,生成 的速率不变 的速率不变 |
D.当 的浓度不再改变时,反应达到平衡状态 的浓度不再改变时,反应达到平衡状态 |
您最近一年使用:0次
名校
解题方法
6 . 将1 mol A(g)和2 mol B(g)置于2 L某密闭容器中,在一定温度下发生反应: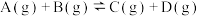 ,并达到平衡。C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是
,并达到平衡。C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是
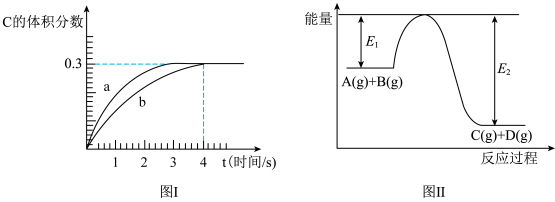
a.在上述反应体系中加入催化剂,化学反应速率增大, 减小,
减小,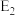 增大
增大
b.该温度下,反应的平衡常数数值约为7.36;若升高温度,该反应的平衡常数不变
c.恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中b曲线进行
d.反应在第4秒钟达到化学平衡状态,此时A、B、C、D的速率不等
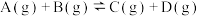 ,并达到平衡。C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是
,并达到平衡。C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是
a.在上述反应体系中加入催化剂,化学反应速率增大,
 减小,
减小,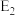 增大
增大b.该温度下,反应的平衡常数数值约为7.36;若升高温度,该反应的平衡常数不变
c.恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中b曲线进行
d.反应在第4秒钟达到化学平衡状态,此时A、B、C、D的速率不等
| A.ac | B.abc | C.abd | D.abcd |
您最近一年使用:0次
名校
解题方法
7 . 用CO2、C3H8为原料可制备丙烯(C3H6),反应为CO2(g)+C3H8(g)⇌C3H6(g)+CO(g)+H2O(g)。一定温度下,向2L恒容密闭容器中通入3mol CO2、2mol C3H8,测得C3H8与H2O的物质的量随时间的变化关系如下表所示,下列说法错误的是
| t/min | 0 | t1 | t2 | t3 | t4 |
| n(C3H8)/mol | 2 | 1.4 | 1 | 0.8 | 0.8 |
| n(H2O)/mol | 0 | 0.6 | 1 | 1.2 | 1.2 |
| A.t3时,该反应达到平衡 |
| B.t2=10时, 0~10min内用C3H8表示的平均反应速率为0.1mol·L-1·min-1 |
| C.当容器中气体压强不再改变时,该反应达到平衡 |
| D.平衡时与起始时气体的压强之比是31:25 |
您最近一年使用:0次
2023-04-15更新
|
287次组卷
|
2卷引用:贵州省黔西南州2022-2023学年高一下学期期末教学质量检测化学试题
名校
8 . I.SO2在工农业生产中有着重要的应用,请回答下列问题:
(1)工业上用软锰矿(主要成分为MnO2)制备Mn(H2PO4)2•2H2O。常用稀硫酸酸浸软锰矿,同时通入SO2,此时发生反应的离子方程式为_____ ,SO2作_____ (填“氧化剂”或“还原剂”)。
Ⅱ.一定温度下,向容积为2L的恒容密闭容器中通入2molSO2和1molO2,在一定条件下发生反应2SO2(g)+O2(g) 2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:
2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:
(2)下列说法能够判断上述反应达到化学平衡状态的是_____ (填标号)。
(3)上述反应体系的正反应速率和逆反应速率相等的时间段是_____ (填“0~4”、“4~8”、“8~12”“12~18”或“18~25”)min。
(4)0~8min内,用SO3表示该反应的平均速率为_____ mol•L-1•min-1,12min时,SO2的转化率为_____ 。
(5)若起始时容器内压强为p0MPa,则平衡时,容器内压强约为_____ (用含p0的代数式表示,保留2位有效数字)MPa。
(1)工业上用软锰矿(主要成分为MnO2)制备Mn(H2PO4)2•2H2O。常用稀硫酸酸浸软锰矿,同时通入SO2,此时发生反应的离子方程式为
Ⅱ.一定温度下,向容积为2L的恒容密闭容器中通入2molSO2和1molO2,在一定条件下发生反应2SO2(g)+O2(g)
 2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:
2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:| 时间/min | 4 | 8 | 12 | 18 | 25 |
| n(O2)/mol | 0.70 | 0.50 | 0.40 | 0.32 | 0.32 |
| A.v(SO2)=2v(O2) | B.容器内气体的平均摩尔质量不再发生变化 |
| C.SO2和O2的浓度之比为2:1 | D.SO3的百分含量不再发生变化 |
(4)0~8min内,用SO3表示该反应的平均速率为
(5)若起始时容器内压强为p0MPa,则平衡时,容器内压强约为
您最近一年使用:0次
2023-05-03更新
|
281次组卷
|
3卷引用:贵州省遵义市红花岗区2022-2023学年高一下学期4月期中联考化学试题
名校
9 . 将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2s后测得C的浓度为0.6mol·L-1,下列说法中正确的是
2C(g)。若经2s后测得C的浓度为0.6mol·L-1,下列说法中正确的是
 2C(g)。若经2s后测得C的浓度为0.6mol·L-1,下列说法中正确的是
2C(g)。若经2s后测得C的浓度为0.6mol·L-1,下列说法中正确的是| A.用物质A表示的反应平均速率为0.3mol·L-1·s-1 |
| B.用物质B表示的反应的平均速率为0.6mol·L-1·s-1 |
| C.2s时物质A的转化率为70% |
| D.2s时物质B的浓度为1.4mol·L-1 |
您最近一年使用:0次
2022-12-09更新
|
126次组卷
|
4卷引用:贵州省六盘水市外国语学校2021-2022学年高二上学期期中考试化学试题
解题方法
10 . 在1L密闭容器中, 与稀盐酸反应(放热反应)生成
与稀盐酸反应(放热反应)生成 的物质的量与时间的关系如图所示。下列说法错误的是
的物质的量与时间的关系如图所示。下列说法错误的是

 与稀盐酸反应(放热反应)生成
与稀盐酸反应(放热反应)生成 的物质的量与时间的关系如图所示。下列说法错误的是
的物质的量与时间的关系如图所示。下列说法错误的是
| A.0~4min内,温度对反应速率的影响比浓度大 |
B.4~6min内,反应速率减小的主要原因是 减小 减小 |
C.2~4min内生成 的平均反应速率最大 的平均反应速率最大 |
D.2~4min内生成 的平均速率为 的平均速率为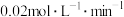 |
您最近一年使用:0次
2022-07-22更新
|
106次组卷
|
2卷引用:贵州省贵阳市三新改革联盟校2022-2023学年高一下学期5月联考化学试题



