1 . 甲醇(CH3OH)是一种重要的化工原料,生产中有重要用途,一定温度下在2L的恒容密闭容器中充入1molCO和2molH2,发生反应: 。测得CO和CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示(注:128.8kJ·mol-1表示1molCO和2molH2恰好完全反应的能量变化),回答下列问题:
。测得CO和CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示(注:128.8kJ·mol-1表示1molCO和2molH2恰好完全反应的能量变化),回答下列问题:

(1)0~1min内,v(H2)=_______ ,反应达到平衡状态时H2的转化率为_______ 。
(2)下列措施能增大反应速率的是_______(填字母)。
(3)在相同条件下,若向该密闭容器中充入与2molCO和4molH2,二者充分反应后,根据反应的特点推测,反应_______ (填“放出”或“吸收”)的热量_______ (填“>”“<”或“=”)257.6kJ。
(4)在相同温度、容积不变的条件下,不能说明该反应已经达到平衡状态的是_______(填字母)。
(5)在相同温度、容积不变的条件下,平衡时与起始时容器内气体压强之比为_______ 。
 。测得CO和CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示(注:128.8kJ·mol-1表示1molCO和2molH2恰好完全反应的能量变化),回答下列问题:
。测得CO和CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示(注:128.8kJ·mol-1表示1molCO和2molH2恰好完全反应的能量变化),回答下列问题:
(1)0~1min内,v(H2)=
(2)下列措施能增大反应速率的是_______(填字母)。
| A.升高温度 | B.减小压强 |
| C.减小CH3OH的浓度 | D.加入合适的催化剂 |
(4)在相同温度、容积不变的条件下,不能说明该反应已经达到平衡状态的是_______(填字母)。
| A.H2、CH3OH浓度均不再变化 |
| B.体系压强不变 |
| C.n(H2):n(CH3OH)=1:1 |
| D.H2的消耗速率与CH3OH的生成速率之比为2:1 |
您最近一年使用:0次
名校
解题方法
2 . 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)已知:
H2(g)+I2(g)=2HI(g) ΔH=QkJ·mol-1
H2(g)+I2(s)=2HI(g) ΔH=+26.48kJ·mol-1
I2(g)=I2(s) ΔH=-37.48kJ·mol-1
键能是将1mol气体分子AB断裂为中性气态原子A和B所需要的能量,单位为kJ·mol-1。
①Q=____ kJ·mol-1。
②H—H键能为____ kJ·mol-1。
(2)716K时,在恒容密闭容器中按物质的量之比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如图:
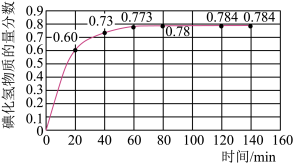
①若反应开始时气体混合物的总压为pkPa,则反应在前20min内的I2(g)平均速率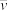 (I2)=
(I2)=___ kPa·min-1(用含p的式子表示)。
②在H2(g)+I2(g) 2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,
2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时, =
=___ (列出计算式)。
③H2(g)+I2(g) 2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是
2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是___ 。
(3)一定条件下,NaClO可将溶液中的I-氧化为I2。通过测定体系的吸光度,检测到不同pH下I2的生成量随时间的变化关系如图。
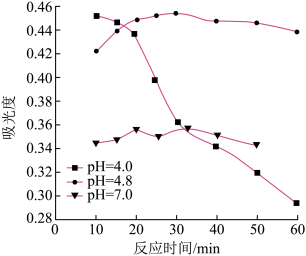
已知:吸光度越高表明该体系中c(I2)越大。
①pH=4.8时,在___ min附近c(I2)最大。
②10min时,不同pH与吸光度的关系是___ 。
③pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因是___ 。
(1)已知:
H2(g)+I2(g)=2HI(g) ΔH=QkJ·mol-1
H2(g)+I2(s)=2HI(g) ΔH=+26.48kJ·mol-1
I2(g)=I2(s) ΔH=-37.48kJ·mol-1
| 化学键 | I—I | H—I |
| 键能/(kJ·mol-1) | 151 | 299 |
①Q=
②H—H键能为
(2)716K时,在恒容密闭容器中按物质的量之比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如图:

①若反应开始时气体混合物的总压为pkPa,则反应在前20min内的I2(g)平均速率
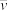 (I2)=
(I2)=②在H2(g)+I2(g)
 2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,
2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时, =
=③H2(g)+I2(g)
 2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是
2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是(3)一定条件下,NaClO可将溶液中的I-氧化为I2。通过测定体系的吸光度,检测到不同pH下I2的生成量随时间的变化关系如图。

已知:吸光度越高表明该体系中c(I2)越大。
①pH=4.8时,在
②10min时,不同pH与吸光度的关系是
③pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因是
您最近一年使用:0次
2020-06-01更新
|
359次组卷
|
3卷引用:贵州省遵义市南白中学2020届高三第六次联考化学试题
3 . 氧化铝在工业生产中有多种用途。请根据信息回答:
(1)以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN)
已知:2Al2O3(s)=4Al(g)+3O2(g)△H1=+3351 kJ·mol-1
2C(s)+O2(g)=2CO(g);△H2=-221 kJ·mol-1
2Al(g)+N2(g)=2AlN(s)△H3=-318 kJ·mol-1
则碳热还原法合成AlN的热化学方程式为_____ 。
(2)电解氧化铝生产铝时,阳极产生的副产物CO2,可通过CO2甲烷化再利用,反应原理为:CO2(g)+4H2(g) CH4(g)+2H2O(g)△H4。
CH4(g)+2H2O(g)△H4。
常压下以Ru/TiO2作催化剂,在恒容且容积相同的不同容器中,分别充入10mol CO2和H2的混合气体(体积比1:4)于不同温度下进行反应,第tmin时分别测定CH4的体积分数 ,并绘成如图甲所示曲线。
,并绘成如图甲所示曲线。

①A、B、C、D、E五点中,尚未达到平衡的点是___ ,该反应的△H4__ 0(填“>”或“<”)。
②350℃时,在2L恒容密闭容器中测得CO2的平衡转化率如图乙所示,则前10 min的平均反应速率v(CO2)=___ ;平衡常数为____

(3)据文献报道,科学家利用氮化镓材料与铜组成如图所示的人工光合系统装置,成功地以CO2和H2O为原料合成了CH4。
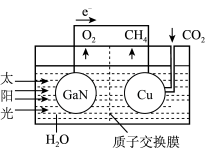
①写山铜电极表面的电极反应式____ 。
②为提高该人工光合系统的工作效率,可向装置中加入少量__ (选填“盐酸”或“硫酸”)。
(1)以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN)
已知:2Al2O3(s)=4Al(g)+3O2(g)△H1=+3351 kJ·mol-1
2C(s)+O2(g)=2CO(g);△H2=-221 kJ·mol-1
2Al(g)+N2(g)=2AlN(s)△H3=-318 kJ·mol-1
则碳热还原法合成AlN的热化学方程式为
(2)电解氧化铝生产铝时,阳极产生的副产物CO2,可通过CO2甲烷化再利用,反应原理为:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)△H4。
CH4(g)+2H2O(g)△H4。常压下以Ru/TiO2作催化剂,在恒容且容积相同的不同容器中,分别充入10mol CO2和H2的混合气体(体积比1:4)于不同温度下进行反应,第tmin时分别测定CH4的体积分数
 ,并绘成如图甲所示曲线。
,并绘成如图甲所示曲线。
①A、B、C、D、E五点中,尚未达到平衡的点是
②350℃时,在2L恒容密闭容器中测得CO2的平衡转化率如图乙所示,则前10 min的平均反应速率v(CO2)=

(3)据文献报道,科学家利用氮化镓材料与铜组成如图所示的人工光合系统装置,成功地以CO2和H2O为原料合成了CH4。

①写山铜电极表面的电极反应式
②为提高该人工光合系统的工作效率,可向装置中加入少量
您最近一年使用:0次
4 . 一氧化碳是一种用途广泛的化工基础原料。
(l)在高温下CO可将SO2还原为单质硫。已知:2CO(g)+O2(g)=2CO2(g) △H1=-566.0kJ·mol-1;S(s)+O2(g)=SO2(g) △H2=-296.0kJ·mol-1;
请写出CO还原SO2的热化学方程式______________________ 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为___________________ ,H2的平均生成速率为__________ mol·L-1·min-1。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图:

电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是____________ (填正极或负极),c电极的反应方程式为__________________ 。若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的________ 极(填c或d),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为__________ L。
(l)在高温下CO可将SO2还原为单质硫。已知:2CO(g)+O2(g)=2CO2(g) △H1=-566.0kJ·mol-1;S(s)+O2(g)=SO2(g) △H2=-296.0kJ·mol-1;
请写出CO还原SO2的热化学方程式
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g)
 CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图:

电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是
您最近一年使用:0次
2016-12-09更新
|
181次组卷
|
2卷引用:2015-2016学年贵州省遵义航天中学高二下3月月考化学卷



