1 . 如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题。
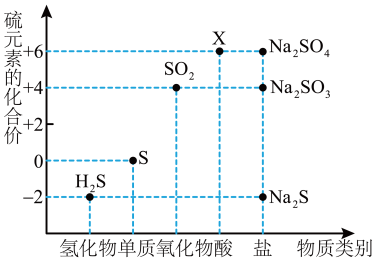
(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的___________ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(3)将 与
与 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为___________ 。
(4)配平下列反应_________________ 。
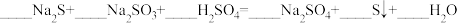
(5)一定条件下,在 密闭容器中发生反应:
密闭容器中发生反应: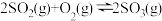 ,开始时加入
,开始时加入 、
、 、
、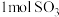 ,在
,在 末测得
末测得 的物质的量是
的物质的量是 ,用
,用 的浓度变化表示反应的平均速率为
的浓度变化表示反应的平均速率为___________ ,在 末
末 的浓度为
的浓度为___________ 。若改变下列一个条件,推测该反应的速率发生的变化(填“增大”“减小”或“不变”)
①升高温度,化学反应速率___________ ;
②再充入 ,化学反应速率
,化学反应速率___________ ;
③将容器体积变为 ,化学反应速率
,化学反应速率___________ 。

(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将
 与
与 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为(4)配平下列反应
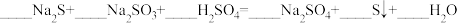
(5)一定条件下,在
 密闭容器中发生反应:
密闭容器中发生反应: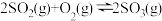 ,开始时加入
,开始时加入 、
、 、
、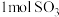 ,在
,在 末测得
末测得 的物质的量是
的物质的量是 ,用
,用 的浓度变化表示反应的平均速率为
的浓度变化表示反应的平均速率为 末
末 的浓度为
的浓度为①升高温度,化学反应速率
②再充入
 ,化学反应速率
,化学反应速率③将容器体积变为
 ,化学反应速率
,化学反应速率
您最近一年使用:0次
2 . 完成下列问题。
(1)在恒容的密闭容器中,气体X与气体Y反应可生成气体Z,反应过程中,X、Y、Z三种气体的浓度(c)随时间(t)的变化关系如图

则该反应的化学方程式为___________ ,若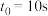 ,用X表示的该反应速率为
,用X表示的该反应速率为___________ ;若向容器中充入He,该反应速率___________ (填“加快”或“减慢”或“不变”)
(2)一种新型催化剂用于NO和CO的反应: 。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中:
。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中:
①a=___________ 。
②能验证温度对化学反应速率影响规律的实验是___________ (填实验序号)。
③实验I和实验Ⅱ中,NO的物质的量浓度 随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线
随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线___________ (填“甲”或“乙”)。

④若要进一步提高该反应的化学反应速率,除了使用催化剂和升高温度外,还可以采取的措施有___________ (任写一条)。
(3)天然气是高效洁净的能源,又是重要的化工原料,在生产生活中用途广泛。
甲烷可以消除氮氧化物污染。如: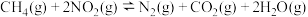 。若上述反应在恒容密闭容器中进行,下列叙述能说明该反应已达平衡状态的是
。若上述反应在恒容密闭容器中进行,下列叙述能说明该反应已达平衡状态的是___________ 。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.容器内气体的压强不再变化
d.混合气体的质量不再变化
e.
f.单位时间内生成 同时生成
同时生成
(1)在恒容的密闭容器中,气体X与气体Y反应可生成气体Z,反应过程中,X、Y、Z三种气体的浓度(c)随时间(t)的变化关系如图

则该反应的化学方程式为
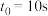 ,用X表示的该反应速率为
,用X表示的该反应速率为(2)一种新型催化剂用于NO和CO的反应:
 。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中:
。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中:| 实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(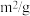 ) ) |
| I | 280 |  |  | 82 |
| Ⅱ | 280 | 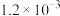 | b | 124 |
| Ⅲ | 350 | a | 5 | 82 |
②能验证温度对化学反应速率影响规律的实验是
③实验I和实验Ⅱ中,NO的物质的量浓度
 随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线
随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线
④若要进一步提高该反应的化学反应速率,除了使用催化剂和升高温度外,还可以采取的措施有
(3)天然气是高效洁净的能源,又是重要的化工原料,在生产生活中用途广泛。
甲烷可以消除氮氧化物污染。如:
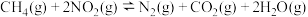 。若上述反应在恒容密闭容器中进行,下列叙述能说明该反应已达平衡状态的是
。若上述反应在恒容密闭容器中进行,下列叙述能说明该反应已达平衡状态的是a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.容器内气体的压强不再变化
d.混合气体的质量不再变化
e.

f.单位时间内生成
 同时生成
同时生成
您最近一年使用:0次
2021·天津·模拟预测
解题方法
3 . 氮和氮的化合物在国防建设、工农业生产和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)已知部分化学键的键能如表
工业上合成氨反应当过程中转移3 mol电子时,理论上热量变化为___________ kJ。
(2)在一个恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g)发生反应:2NO(g)+Cl2(g) 2ClNO(g) 在一定温度下测得NO的物质的量(单位:mol)与时间的关系如表所示:
2ClNO(g) 在一定温度下测得NO的物质的量(单位:mol)与时间的关系如表所示:
①测得该反应平衡常数与温度关系为1gKp=5.08+ ,则该反应是
,则该反应是___________ (填“吸热”或“放热”反应)。
②同温度下,起始时容器内的压强为P0,则该反应的平衡常数KP=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③若同温度下,在相同容器中,充入1 mol NO(g)和0.5 molCl2(g),则NO的平衡转化率___________ 50%(填“大于”、“等于”或“小于”)。
(3)某研究小组将2 mol NH3、3 mol NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生反应4NH3(g)+6NO(g) 5N2(g)+6H2O(l);NO的转化率随温度变化的情况如图。5 min内,温度从420 K升高到580 K,此时段内NO的平均反应速率v(NO)
5N2(g)+6H2O(l);NO的转化率随温度变化的情况如图。5 min内,温度从420 K升高到580 K,此时段内NO的平均反应速率v(NO)___________ ,420 K之前,NO生成N2的转化率偏低的原因可能是___________ 。
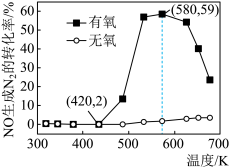
(4)若将NO2与O2通入如图所示甲装置,D电极上有红色物质析出,A电极的电极反应式为___________ 。
(1)已知部分化学键的键能如表
| 化学键 | N≡N | H —H | N—H |
| 键能/(kJ·mol-1) | 946 | 436 | 391 |
工业上合成氨反应当过程中转移3 mol电子时,理论上热量变化为
(2)在一个恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g)发生反应:2NO(g)+Cl2(g)
 2ClNO(g) 在一定温度下测得NO的物质的量(单位:mol)与时间的关系如表所示:
2ClNO(g) 在一定温度下测得NO的物质的量(单位:mol)与时间的关系如表所示:| t/min | 0 | 5 | 8 | 13 |
| NO的物质的量 | 2 | 1.15 | 1.0 | 1.0 |
①测得该反应平衡常数与温度关系为1gKp=5.08+
 ,则该反应是
,则该反应是②同温度下,起始时容器内的压强为P0,则该反应的平衡常数KP=
③若同温度下,在相同容器中,充入1 mol NO(g)和0.5 molCl2(g),则NO的平衡转化率
(3)某研究小组将2 mol NH3、3 mol NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生反应4NH3(g)+6NO(g)
 5N2(g)+6H2O(l);NO的转化率随温度变化的情况如图。5 min内,温度从420 K升高到580 K,此时段内NO的平均反应速率v(NO)
5N2(g)+6H2O(l);NO的转化率随温度变化的情况如图。5 min内,温度从420 K升高到580 K,此时段内NO的平均反应速率v(NO)
(4)若将NO2与O2通入如图所示甲装置,D电极上有红色物质析出,A电极的电极反应式为

您最近一年使用:0次
解题方法
4 . 醛类物质的用途广泛。如,甲醛蒸气可对空气消毒、甲醛溶液可用于生物标本的防腐等;脂肪醛类一般具有麻醉、催眠作用等。回答下列问题:
Ⅰ. 与
与 反应用
反应用 催化的机理如图所示。
催化的机理如图所示。
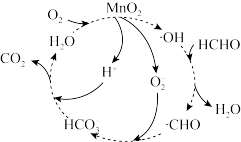
(1)在 ,催化下,
,催化下, 转化成
转化成 ,
, 被氧化成
被氧化成___________ (填离子符号)。
(2)该催化反应的总反应方程式为___________ 。
(3)已知 的两步电离常数分别为
的两步电离常数分别为 、
、 ,当溶液中
,当溶液中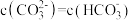 时,溶液
时,溶液
___________ 。
Ⅱ.利用乙二醛 催化氧化法合成乙醛酸的反应原理为:
催化氧化法合成乙醛酸的反应原理为:

可能发生副反应有: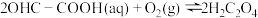 (草酸)
(草酸)
在反应瓶内加入含 (乙二醛)的反应液
(乙二醛)的反应液 ,加热至45~60℃,通入氧气并保持氧气压强为
,加热至45~60℃,通入氧气并保持氧气压强为 ,反应
,反应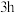 达平衡状态,得到的混合液中含
达平衡状态,得到的混合液中含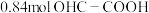 (乙醛酸),
(乙醛酸), (草酸),
(草酸),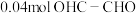 (乙二醛)(溶液体积变化可忽略不计)。
(乙二醛)(溶液体积变化可忽略不计)。
(1)草酸的平均生成速率为___________  。
。
(2)通过化学反应原理分析,增大压强有利于加快反应速率,对于乙二醛的转化率的影响是___________ (填“增大”或“减小”)。
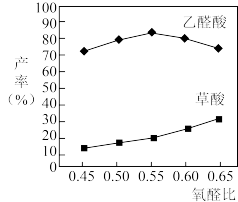
(3)如图所示为起始时氧醛比[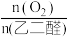 ]对乙醛酸产率的影响,则选择最佳氧醛比为
]对乙醛酸产率的影响,则选择最佳氧醛比为___________ 。
(4)已知: 为二元弱酸,
为二元弱酸,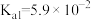 ,
,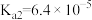 ,向
,向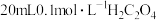 溶液中滴加
溶液中滴加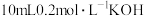 溶液。溶液中
溶液。溶液中
___________  (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
Ⅰ.
 与
与 反应用
反应用 催化的机理如图所示。
催化的机理如图所示。
(1)在
 ,催化下,
,催化下, 转化成
转化成 ,
, 被氧化成
被氧化成(2)该催化反应的总反应方程式为
(3)已知
 的两步电离常数分别为
的两步电离常数分别为 、
、 ,当溶液中
,当溶液中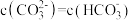 时,溶液
时,溶液
Ⅱ.利用乙二醛
 催化氧化法合成乙醛酸的反应原理为:
催化氧化法合成乙醛酸的反应原理为:
可能发生副反应有:
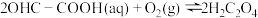 (草酸)
(草酸)在反应瓶内加入含
 (乙二醛)的反应液
(乙二醛)的反应液 ,加热至45~60℃,通入氧气并保持氧气压强为
,加热至45~60℃,通入氧气并保持氧气压强为 ,反应
,反应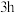 达平衡状态,得到的混合液中含
达平衡状态,得到的混合液中含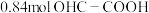 (乙醛酸),
(乙醛酸), (草酸),
(草酸),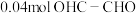 (乙二醛)(溶液体积变化可忽略不计)。
(乙二醛)(溶液体积变化可忽略不计)。(1)草酸的平均生成速率为
 。
。(2)通过化学反应原理分析,增大压强有利于加快反应速率,对于乙二醛的转化率的影响是
(3)如图所示为起始时氧醛比[
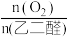 ]对乙醛酸产率的影响,则选择最佳氧醛比为
]对乙醛酸产率的影响,则选择最佳氧醛比为
(4)已知:
 为二元弱酸,
为二元弱酸,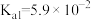 ,
,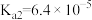 ,向
,向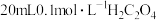 溶液中滴加
溶液中滴加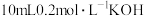 溶液。溶液中
溶液。溶液中
 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
您最近一年使用:0次
2021-04-05更新
|
301次组卷
|
2卷引用:天津市部分区2021届高三第一次质量调查化学试题
名校
解题方法
5 . 硼氢化钠(NaBH4)是常用的还原剂,用途广泛。某探究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
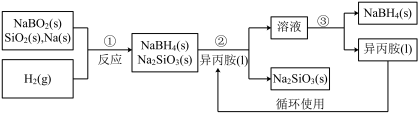
已知:NaBH4常温下易与水反应,可溶于异丙胺(沸点:33℃)
(1)在第①步反应加料之前,需要将反应器加热至 100 ℃以上并通入氩气 ,该操作的目的是______ ;第②步分离采用的方法是______ ;第③步分离NaBH4并回收溶剂,采用的方法是_____ ;
(2)NaBH4与水反应生成H2 : NaBH4 + 2H2O=NaBO2+4H2↑ (已知:HBO2是弱酸)。 实验测得,NaBH4每消耗一半所用的时间与溶液 pH、温度的关系如下表:
①NaBH4与水反应开始释放H2很快 ,经过一段时间后就缓慢下来 ,可能原因一是反应物浓度降低 ;二是________ ;
②为了加快制取的H2速率,常将一些促进剂投入水中,下列物质中可作为促进剂的是__ ;
a. 碳酸钾 b. 稀硝酸 c 硫酸氢钠 d. 氨水
(3)利用如图所示装置,可以测定NaBH4与水反应生成 H2的速率,在pH =10、25℃条件下,将恒压滴液漏斗中NaBH4滴加到含有催化剂的三颈烧瓶中。
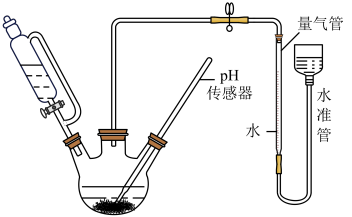
①实验中使用恒压滴液漏斗的原因为_________ ;
②气体生成结束后,水准管中的液面会高于量气管中的液面,此时量气管读数会_____ ( 填“偏大”或“偏小”)需要将水准管慢慢向下移动,则量气管中的液面会__________ (填“上升”或“下降”);
③在此条件下,0. 38 g NaBH4开始反应至剩余 0. 19 g 时,实验测得量气管内气体体积为124mL,则这段时间内,生成H2的平均速率是_______ mL·min-1。

已知:NaBH4常温下易与水反应,可溶于异丙胺(沸点:33℃)
(1)在第①步反应加料之前,需要将反应器加热至 100 ℃以上并通入氩气 ,该操作的目的是
(2)NaBH4与水反应生成H2 : NaBH4 + 2H2O=NaBO2+4H2↑ (已知:HBO2是弱酸)。 实验测得,NaBH4每消耗一半所用的时间与溶液 pH、温度的关系如下表:
| pH | 8 | 10 | 12 | 1 4 |
| 温度/℃ | 25 | 25 | 25 | 25 |
| 时间/ min | 6. 2 ×10-1 | 6. 2 ×10 | 6. 2 ×103 | 6. 2 ×105 |
②为了加快制取的H2速率,常将一些促进剂投入水中,下列物质中可作为促进剂的是
a. 碳酸钾 b. 稀硝酸 c 硫酸氢钠 d. 氨水
(3)利用如图所示装置,可以测定NaBH4与水反应生成 H2的速率,在pH =10、25℃条件下,将恒压滴液漏斗中NaBH4滴加到含有催化剂的三颈烧瓶中。

①实验中使用恒压滴液漏斗的原因为
②气体生成结束后,水准管中的液面会高于量气管中的液面,此时量气管读数会
③在此条件下,0. 38 g NaBH4开始反应至剩余 0. 19 g 时,实验测得量气管内气体体积为124mL,则这段时间内,生成H2的平均速率是
您最近一年使用:0次



