解题方法
1 . 甲烷和乙炔(CH≡CH)在有机合成中有着广泛的用途。
(1)已知:①
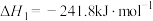
②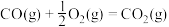

③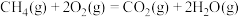
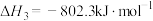
写出甲烷与水蒸气在高温下制备合成气(CO、 )的热化学方程式:
)的热化学方程式:___________ 。
(2)用甲烷在高温下气相裂解制取乙炔和氢气,其反应原理为
 。几种气体平衡时分压(Pa)的对数与温度(K)的关系如图所示。
。几种气体平衡时分压(Pa)的对数与温度(K)的关系如图所示。
___________ (用气体平衡分压代替浓度计算)。
② ℃时,向体积为2L的恒容密闭容器中充入
℃时,向体积为2L的恒容密闭容器中充入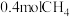 进行上述反应。当反应达到平衡时,测得
进行上述反应。当反应达到平衡时,测得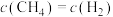 ,则
,则 的转化率为
的转化率为___________ 。若改变温度至 ℃,10s后反应再次达到平衡,测得
℃,10s后反应再次达到平衡,测得 ,则该变化过程中
,则该变化过程中
___________ (填“>”或“<”) 。
。
(3)一定温度下,向体积为2L的恒容密闭容器中充入 (乙炔)和2molHCl发生反应:
(乙炔)和2molHCl发生反应: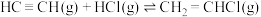
 。测得反应物(
。测得反应物( 或HCl)浓度随时间的变化关系如图所示。
或HCl)浓度随时间的变化关系如图所示。
___________ (填“>”“<”或“=”) 。
。
②15min时仅改变了一个外界条件,改变的条件可能是___________ 。
③0~10min内氯乙烯的平均反应速率
___________  。向密闭容器中充入一定量乙炔和氯化氢,发生上述反应,测得乙炔的平衡转化率与温度、S的关系如图所示。其中
。向密闭容器中充入一定量乙炔和氯化氢,发生上述反应,测得乙炔的平衡转化率与温度、S的关系如图所示。其中 ,则S代表的物理量是
,则S代表的物理量是___________ 。
(1)已知:①

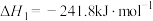
②
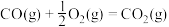

③
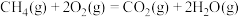
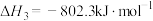
写出甲烷与水蒸气在高温下制备合成气(CO、
 )的热化学方程式:
)的热化学方程式:(2)用甲烷在高温下气相裂解制取乙炔和氢气,其反应原理为

 。几种气体平衡时分压(Pa)的对数与温度(K)的关系如图所示。
。几种气体平衡时分压(Pa)的对数与温度(K)的关系如图所示。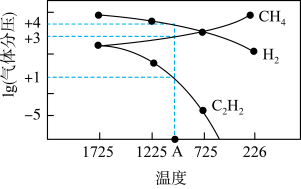

②
 ℃时,向体积为2L的恒容密闭容器中充入
℃时,向体积为2L的恒容密闭容器中充入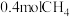 进行上述反应。当反应达到平衡时,测得
进行上述反应。当反应达到平衡时,测得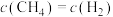 ,则
,则 的转化率为
的转化率为 ℃,10s后反应再次达到平衡,测得
℃,10s后反应再次达到平衡,测得 ,则该变化过程中
,则该变化过程中
 。
。(3)一定温度下,向体积为2L的恒容密闭容器中充入
 (乙炔)和2molHCl发生反应:
(乙炔)和2molHCl发生反应: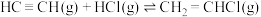
 。测得反应物(
。测得反应物( 或HCl)浓度随时间的变化关系如图所示。
或HCl)浓度随时间的变化关系如图所示。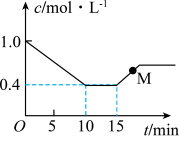

 。
。②15min时仅改变了一个外界条件,改变的条件可能是
③0~10min内氯乙烯的平均反应速率

 。向密闭容器中充入一定量乙炔和氯化氢,发生上述反应,测得乙炔的平衡转化率与温度、S的关系如图所示。其中
。向密闭容器中充入一定量乙炔和氯化氢,发生上述反应,测得乙炔的平衡转化率与温度、S的关系如图所示。其中 ,则S代表的物理量是
,则S代表的物理量是
您最近一年使用:0次
解题方法
2 . CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+ O2(g)=CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
O2(g)=CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是____ (填标号)。
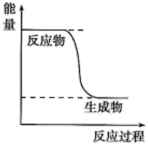
a.化学变化不仅有新物质生成,同时也一定有能量变化
b.H2的生成速率与CH3OH的消耗速率之比为1:2
c.CH3OH转变成H2的过程是一个吸收能量的过程
d.1molH—O键断裂的同时2molC=O键断裂,则反应达到平衡
(2)已知通常状况下3.2g甲醇完全燃烧生成二氧化碳和液态水,放出72.65kJ的热量,写出甲醇燃烧的热化学方程式____ 。
(3)某温度下,将4molCH3OH和2molO2充入2L密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速率v(H2)=___ ,则CH3OH的转化率为____ 。
(4)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为CH3OH+8OH--6e-=CO +6H2O。则下列说法正确的是
+6H2O。则下列说法正确的是___ (填标号)。
①电池放电时通入空气的电极为负极;
②电池放电时电子由正极流向负极;
③电池放电时每消耗6.4gCH3OH转移1.2mol电子.
(1)已知CH3OH(g)+
 O2(g)=CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
O2(g)=CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
a.化学变化不仅有新物质生成,同时也一定有能量变化
b.H2的生成速率与CH3OH的消耗速率之比为1:2
c.CH3OH转变成H2的过程是一个吸收能量的过程
d.1molH—O键断裂的同时2molC=O键断裂,则反应达到平衡
(2)已知通常状况下3.2g甲醇完全燃烧生成二氧化碳和液态水,放出72.65kJ的热量,写出甲醇燃烧的热化学方程式
(3)某温度下,将4molCH3OH和2molO2充入2L密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速率v(H2)=
(4)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为CH3OH+8OH--6e-=CO
 +6H2O。则下列说法正确的是
+6H2O。则下列说法正确的是①电池放电时通入空气的电极为负极;
②电池放电时电子由正极流向负极;
③电池放电时每消耗6.4gCH3OH转移1.2mol电子.
您最近一年使用:0次
解题方法
3 . 镁、铝是重要的金属,有诸多用途。回答下列问题:
(1)利用铝与氧化铁可以焊接钢轨,发生反应的化学方程式为___ ,该反应属于___ (填“放热”或“吸热”)反应。
(2)在100mL稀盐酸中加入足量镁条,反应生成H2的体积(标准状况)与反应时间的关系如1图所示:

①2~6min内用稀盐酸表示的平均反应速率为___ (精确到0.0001)mol•L1•min-1。
②从图可以看出,4min后反应速率逐渐减慢,原因是___ 。
(3)以Al、Mg为电极,可以组装如图2所示原电池装置:

①若电解质溶液为稀硫酸,则Mg上发生的电极反应式为___ ,当有2.4gMg溶解时,Al电极上生成___ (标准状况)L氢气。
②若电解质溶液为NaOH溶液,则外电路中的电子___ (填“流出”或“流入”)Al电极。
(1)利用铝与氧化铁可以焊接钢轨,发生反应的化学方程式为
(2)在100mL稀盐酸中加入足量镁条,反应生成H2的体积(标准状况)与反应时间的关系如1图所示:

①2~6min内用稀盐酸表示的平均反应速率为
②从图可以看出,4min后反应速率逐渐减慢,原因是
(3)以Al、Mg为电极,可以组装如图2所示原电池装置:

①若电解质溶液为稀硫酸,则Mg上发生的电极反应式为
②若电解质溶液为NaOH溶液,则外电路中的电子
您最近一年使用:0次
名校
解题方法
4 . CO2是用途非常广泛的化工基础原料,常用来生产甲醇,反应的化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。下列反应速率关系正确的是
| A.v(CO2)=2v(H2O) | B.2v(CO2)=v(CH3OH) |
| C.3v(CH3OH)=v(H2) | D.2v(CO2)=3v(H2) |
您最近一年使用:0次
2020-10-31更新
|
205次组卷
|
3卷引用:陕西省商洛市2020-2021学年高二上学期期末教学质量检测化学试题
5 . 一氧化碳是一种用途广泛的化工基础原料。
(l)在高温下CO可将SO2还原为单质硫。已知:2CO(g)+O2(g)=2CO2(g) △H1=-566.0kJ·mol-1;S(s)+O2(g)=SO2(g) △H2=-296.0kJ·mol-1;
请写出CO还原SO2的热化学方程式______________________ 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为___________________ ,H2的平均生成速率为__________ mol·L-1·min-1。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图:

电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是____________ (填正极或负极),c电极的反应方程式为__________________ 。若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的________ 极(填c或d),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为__________ L。
(l)在高温下CO可将SO2还原为单质硫。已知:2CO(g)+O2(g)=2CO2(g) △H1=-566.0kJ·mol-1;S(s)+O2(g)=SO2(g) △H2=-296.0kJ·mol-1;
请写出CO还原SO2的热化学方程式
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g)
 CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图:

电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是
您最近一年使用:0次
2016-12-09更新
|
181次组卷
|
2卷引用:2016届陕西省西安铁一中高三上12月模拟化学试卷



