名校
解题方法
1 . 甲醇 是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入
是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: 。测得
。测得 和
和 的物质的量变化如图1所示。反应过程中按图所给物质的量的能量变化如图2所示。
的物质的量变化如图1所示。反应过程中按图所给物质的量的能量变化如图2所示。
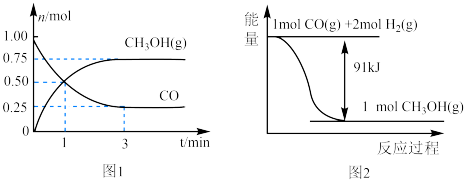
(1)从反应开始至达到平衡,以CO表示的反应的平均反应速率
_____ ;能说明该反应已经达到平衡状态的是_____ 。
a.
b.容器内压强保持不变
c.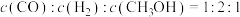
d.容器内的密度保持不变
e.容器内混合气体平均分子质量不变
(2)反应达到平衡状态时 的转化率为
的转化率为_____ ,该条件下此反应的平衡常数为_____ 。
(3)根据图2,计算当反应生成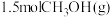 时,能量变化值是
时,能量变化值是_____ kJ。
 是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入
是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: 。测得
。测得 和
和 的物质的量变化如图1所示。反应过程中按图所给物质的量的能量变化如图2所示。
的物质的量变化如图1所示。反应过程中按图所给物质的量的能量变化如图2所示。
(1)从反应开始至达到平衡,以CO表示的反应的平均反应速率

a.

b.容器内压强保持不变
c.
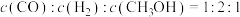
d.容器内的密度保持不变
e.容器内混合气体平均分子质量不变
(2)反应达到平衡状态时
 的转化率为
的转化率为(3)根据图2,计算当反应生成
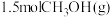 时,能量变化值是
时,能量变化值是
您最近一年使用:0次
名校
解题方法
2 . 甲醇的用途十分广泛,主要用于有机合成、作燃料、生产农药、作良好的有机溶剂等。催化 和
和 反应可以合成甲醇,反应化学方程式为
反应可以合成甲醇,反应化学方程式为 。
。
已知:① ;
;
② 。
。
回答下列问题:
(1)写出催化 和
和 合成甲醇的热化学反应方程式:
合成甲醇的热化学反应方程式:___________ 。
(2)对于催化 和
和 合成甲醇的反应,增大压强,平衡
合成甲醇的反应,增大压强,平衡___________ (填“向左”“向右”或“不”)移动;温度升高平衡常数___________ (填“变大”“变小”或“不变”)。
(3)在相同条件下研究催化剂Ⅰ、催化剂Ⅱ对反应 的影响,在密闭容器内充入一定量
的影响,在密闭容器内充入一定量 和
和 ,部分物质的浓度c随反应时间t的变化曲线如图1所示。
,部分物质的浓度c随反应时间t的变化曲线如图1所示。

①a曲线表示___________ 。
②催化剂Ⅰ比催化剂Ⅱ催化效率___________ (填“高”“低”或“相同”),原因是___________ 。
(4)523K时,在1L恒容密闭容器中充入 和
和 ,在催化剂作用下反应合成甲醇,容器内的压强变化如下。
,在催化剂作用下反应合成甲醇,容器内的压强变化如下。
反应从开始到20min时,以 浓度表示平均反应速率
浓度表示平均反应速率
___________ ;此温度下,压强平衡常数
___________  (保留三位有效数字)。
(保留三位有效数字)。
(5)一定条件下,在3个相同的密闭容器中分别充入 和
和 ,
, 分别为1:1、1:2、1:3,CO2(g)的转化率随压强的变化关系如图2所示,曲线a的
分别为1:1、1:2、1:3,CO2(g)的转化率随压强的变化关系如图2所示,曲线a的
___________ ,原因是___________ 。

 和
和 反应可以合成甲醇,反应化学方程式为
反应可以合成甲醇,反应化学方程式为 。
。已知:①
 ;
;②
 。
。回答下列问题:
(1)写出催化
 和
和 合成甲醇的热化学反应方程式:
合成甲醇的热化学反应方程式:(2)对于催化
 和
和 合成甲醇的反应,增大压强,平衡
合成甲醇的反应,增大压强,平衡(3)在相同条件下研究催化剂Ⅰ、催化剂Ⅱ对反应
 的影响,在密闭容器内充入一定量
的影响,在密闭容器内充入一定量 和
和 ,部分物质的浓度c随反应时间t的变化曲线如图1所示。
,部分物质的浓度c随反应时间t的变化曲线如图1所示。
①a曲线表示
②催化剂Ⅰ比催化剂Ⅱ催化效率
(4)523K时,在1L恒容密闭容器中充入
 和
和 ,在催化剂作用下反应合成甲醇,容器内的压强变化如下。
,在催化剂作用下反应合成甲醇,容器内的压强变化如下。| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
 浓度表示平均反应速率
浓度表示平均反应速率

 (保留三位有效数字)。
(保留三位有效数字)。(5)一定条件下,在3个相同的密闭容器中分别充入
 和
和 ,
, 分别为1:1、1:2、1:3,CO2(g)的转化率随压强的变化关系如图2所示,曲线a的
分别为1:1、1:2、1:3,CO2(g)的转化率随压强的变化关系如图2所示,曲线a的

您最近一年使用:0次
名校
解题方法
3 . 氨的用途十分泛,如氨是制造硝酸和氮肥的重要原料。工业合成氨是人类科学技术的一项重大突破。回答下列问题:
(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。

在合成氨的基元反应中,决速步骤的活化能为___________ kJ/mol。
(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是___________ (填选项序号)。
①v(N2)=0.5mol/(L·min) ②v(H2)=0.02mol/(L·s)
③v(NH3)=0.4mol/(L·min) ④v(NH3)=0.02mol/(L·s)
(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是___________(填选项字母)。
(4)一定温度下,向2L恒容密闭容器中充入0.4molN2、1.2molH2发生反应,NH3的浓度随时间变化情况如表所示:
0~10min内,用H2表示的平均反应速率为___________ ;实验测得体系平衡时的压强为10MPa,则该反应的平衡常数Kp=___________ MPa-2(用分数表示,Kp为分压表示的平衡常数,分压=总压×体积分数);若维持温度不变,向另一2L恒容密闭容器中充入H2、N2和NH3各4mol时,该反应的v正___________ (填“>”“<”或“=”)v逆。
(1)合成氨反应的历程和能量的变化如图所示,符号“·”可视为催化剂。

在合成氨的基元反应中,决速步骤的活化能为
(2)在不同条件下进行合成氨反应,下列反应速率由大到小的顺序是
①v(N2)=0.5mol/(L·min) ②v(H2)=0.02mol/(L·s)
③v(NH3)=0.4mol/(L·min) ④v(NH3)=0.02mol/(L·s)
(3)对于合成氨反应而言,只控制一个变量,下列图像合理的是___________(填选项字母)。
A.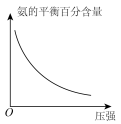 | B.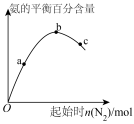 |
C.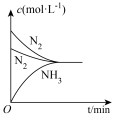 | D.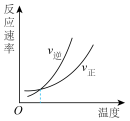 |
| 时间/min | 5 | 10 | 15 | 20 | 25 |
| 浓度/mol/L | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 |
您最近一年使用:0次
4 . 放热反应在生产、生活中用途广泛。回答下列问题:
(1)前期的火箭曾用液态肼 与双氧水反应来提供能量。已知
与双氧水反应来提供能量。已知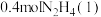 与足量的双氧水反应,生成氮气和水蒸气,放出
与足量的双氧水反应,生成氮气和水蒸气,放出 的热量。
的热量。
此反应的化学方程式为______ 。
(2)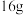 液态肼与足量的双氧水发生上述反应,放出
液态肼与足量的双氧水发生上述反应,放出______  热量。
热量。
(3)甲烷可以消除氮氧化物污染: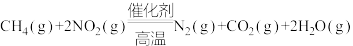 。温度为
。温度为 的条件下,向恒容密闭的容器中通入
的条件下,向恒容密闭的容器中通入 和
和 ,使
,使
 、
、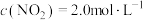 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得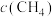 随时间的变化情况如下表:
随时间的变化情况如下表:
实验1中,在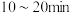 内,
内,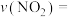
______ , 时
时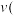 正)
正)______ (填“大于”“小于”或“等于”)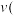 逆)。
逆)。
(4)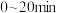 内,实验2比实验1反应速率快,则实验1与实验2的“不同条件”是
内,实验2比实验1反应速率快,则实验1与实验2的“不同条件”是______ 。
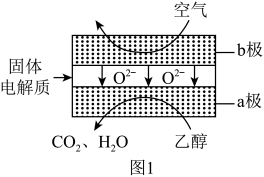
(5)乙醇 应用于燃料电池,该电池采用可传导
应用于燃料电池,该电池采用可传导 的固体氧化物为电解质,其工作原理如图1所示。a极为电池的
的固体氧化物为电解质,其工作原理如图1所示。a极为电池的______ (填“正极”或“负极”);b极电极反应式为______ 。
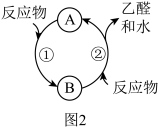
(6)乙醇在 作催化剂时与氧气反应的关系如图2所示,整个反应中物质B属于
作催化剂时与氧气反应的关系如图2所示,整个反应中物质B属于______ (填“催化剂”或“中间产物”)。
(1)前期的火箭曾用液态肼
 与双氧水反应来提供能量。已知
与双氧水反应来提供能量。已知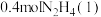 与足量的双氧水反应,生成氮气和水蒸气,放出
与足量的双氧水反应,生成氮气和水蒸气,放出 的热量。
的热量。此反应的化学方程式为
(2)
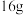 液态肼与足量的双氧水发生上述反应,放出
液态肼与足量的双氧水发生上述反应,放出 热量。
热量。(3)甲烷可以消除氮氧化物污染:
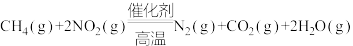 。温度为
。温度为 的条件下,向恒容密闭的容器中通入
的条件下,向恒容密闭的容器中通入 和
和 ,使
,使
 、
、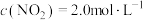 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得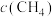 随时间的变化情况如下表:
随时间的变化情况如下表:| 实验序号 |  | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
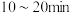 内,
内,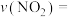
 时
时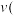 正)
正)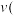 逆)。
逆)。(4)
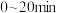 内,实验2比实验1反应速率快,则实验1与实验2的“不同条件”是
内,实验2比实验1反应速率快,则实验1与实验2的“不同条件”是(5)乙醇
 应用于燃料电池,该电池采用可传导
应用于燃料电池,该电池采用可传导 的固体氧化物为电解质,其工作原理如图1所示。a极为电池的
的固体氧化物为电解质,其工作原理如图1所示。a极为电池的

(6)乙醇在
 作催化剂时与氧气反应的关系如图2所示,整个反应中物质B属于
作催化剂时与氧气反应的关系如图2所示,整个反应中物质B属于
您最近一年使用:0次
2023-05-20更新
|
106次组卷
|
2卷引用:河北省盐山中学2022-2023学年高一下学期期中考试化学试题
5 . KMnO4在生产和生活中有着广泛用途,某化学小组在实验室制备KMnO4并探究其性质。
(一) KMnO4的制备,分步骤Ⅰ、Ⅱ两步进行。
步聚Ⅰ.先利用如图所示装置制备K2MnO4。称取7.0gKOH(s)和5.0gKClO3(s)放入容器A中,加热,待混合物熔融后,加入5.0gMnO2(s),待反应物干涸后,加大火焰强热4~8min,得墨绿色的锰酸钾。
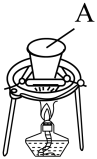
(1)A可选用_______ (填标号)。
①石英坩埚 ②瓷坩埚 ③铁坩埚
(2)实验中发生反应生成K2MnO4的化学方程式为_______ 。
Ⅱ.由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①待A处物料冷却后,用20mL4%KOH溶液重复浸取,合并浸取液便得墨绿色的锰酸钾溶液。
②向滤液中通入足量CO2,使K2MnO4歧化为KMnO4和MnO2,过滤出生成的MnO2。
③再将滤液进行一系列处理,得KMnO4晶体。
(3)过程②向滤液中通入足量CO2,可观察到的现象为_______ ;检验K2MnO4歧化完全的实验方法是_______ 。
(二) KMnO4的性质。已知:KMnO4具有强氧化性,可与草酸(H2C2O4)反应: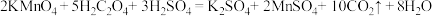 。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
[实验内容及记录的数据]
(4)配制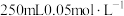 的高锰酸钾溶液肯定不需要的仪器是
的高锰酸钾溶液肯定不需要的仪器是_______ (填标号)。
a.蒸发皿 b.容量瓶 c.玻璃棒 d.烧杯 e.坩埚 f.胶头滳管
(5)为达到实验目的,H2C2O4溶液的物质的量浓度不低于_______ 。
(6)利用实验1中数据计算,0~4min内,用KMnO4的浓度变化表示的反应速率:
_______ 。
(一) KMnO4的制备,分步骤Ⅰ、Ⅱ两步进行。
步聚Ⅰ.先利用如图所示装置制备K2MnO4。称取7.0gKOH(s)和5.0gKClO3(s)放入容器A中,加热,待混合物熔融后,加入5.0gMnO2(s),待反应物干涸后,加大火焰强热4~8min,得墨绿色的锰酸钾。

(1)A可选用
①石英坩埚 ②瓷坩埚 ③铁坩埚
(2)实验中发生反应生成K2MnO4的化学方程式为
Ⅱ.由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①待A处物料冷却后,用20mL4%KOH溶液重复浸取,合并浸取液便得墨绿色的锰酸钾溶液。
②向滤液中通入足量CO2,使K2MnO4歧化为KMnO4和MnO2,过滤出生成的MnO2。
③再将滤液进行一系列处理,得KMnO4晶体。
(3)过程②向滤液中通入足量CO2,可观察到的现象为
(二) KMnO4的性质。已知:KMnO4具有强氧化性,可与草酸(H2C2O4)反应:
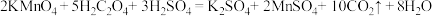 。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:[实验内容及记录的数据]
| 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
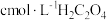 溶液 溶液 |  | 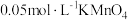 溶液 溶液 | 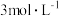 稀硫酸 稀硫酸 | ||
| 1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
| 2 | 2.0 | 2.0 | 4.0 | 2.0 | 5.2 |
| 3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
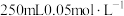 的高锰酸钾溶液肯定不需要的仪器是
的高锰酸钾溶液肯定不需要的仪器是a.蒸发皿 b.容量瓶 c.玻璃棒 d.烧杯 e.坩埚 f.胶头滳管
(5)为达到实验目的,H2C2O4溶液的物质的量浓度不低于
(6)利用实验1中数据计算,0~4min内,用KMnO4的浓度变化表示的反应速率:

您最近一年使用:0次
2023-05-11更新
|
324次组卷
|
3卷引用:河北省衡水市部分重点高中2023届高三二模化学试题
名校
6 . 近年来甲醇用途日益广泛,越来越引起商家的关注。工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,n(CO)和n(H2)按1:2 充入。在400 ℃时发生反应CO(g)+2H2(g) CH3OH(g),体系中n(CO)随时间的变化如表:
CH3OH(g),体系中n(CO)随时间的变化如表:
(1)图甲中表示CH3OH的变化的曲线是_______ (填序号)。
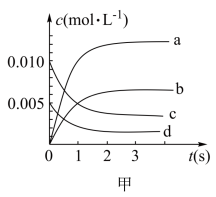
(2)此反应在前2s,H2 的反应速率是_______
(3)下列措施不能提高反应速率的有_______(填序号)。
(4)下列叙述能说明反应达到平衡状态的是_______ (填序号)。
a.CO和H2的浓度保持不变
b.v(H2)=2v(CO)
c.CO的物质的量分数保持不变
d.容器内气体密度保持不变
e.每生成1 mol CH3OH的同时有2 mol H-H键断裂
(5)CO(g)+2H2(g) CH3OH(g),此反应的平衡常数的表达式为:
CH3OH(g),此反应的平衡常数的表达式为:_____
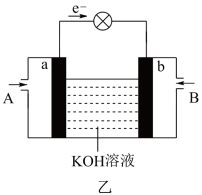
(6)CH3OH与O2的反应可将化学能转化为电能,其工作原理如图乙所示,图中CH3OH从_______ (填“A”或“B”)处通入。
 CH3OH(g),体系中n(CO)随时间的变化如表:
CH3OH(g),体系中n(CO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |

(2)此反应在前2s,H2 的反应速率是
(3)下列措施不能提高反应速率的有_______(填序号)。
| A.升高温度 |
| B.加入催化剂 |
| C.增大压强 |
| D.及时分离出CH3OH |
a.CO和H2的浓度保持不变
b.v(H2)=2v(CO)
c.CO的物质的量分数保持不变
d.容器内气体密度保持不变
e.每生成1 mol CH3OH的同时有2 mol H-H键断裂
(5)CO(g)+2H2(g)
 CH3OH(g),此反应的平衡常数的表达式为:
CH3OH(g),此反应的平衡常数的表达式为:(6)CH3OH与O2的反应可将化学能转化为电能,其工作原理如图乙所示,图中CH3OH从

您最近一年使用:0次
名校
解题方法
7 . 放热反应在生产、生活中用途广泛。
(1)已知 时,
时, 甲烷不完全燃烧生成
甲烷不完全燃烧生成 和液态水时放出
和液态水时放出 热量,则
热量,则 甲烷不完全燃烧的热化学方程式为
甲烷不完全燃烧的热化学方程式为___________ 。
(2)甲烷可以消除氮氧化物污染,发生的反应为 ,在体积固定的密闭容器中,每次实验均加入
,在体积固定的密闭容器中,每次实验均加入 和
和 ,使
,使 、
、 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得 随时间的变化情况如下表:
随时间的变化情况如下表:
①实验1中,在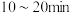 内,
内,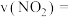
___________ ,40min时v(正)___________ v(逆)(填:“大于”、“小于”、“等于”)。
②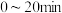 内,实验2比实验1反应速率快的原因可能是
内,实验2比实验1反应速率快的原因可能是___________ 。
(3)乙醇应用于燃料电池,该电池采用可传导 的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为
的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为___________ 。
(4)硝酸铵在高温或猛烈撞击时易爆炸,放出大量的热。 高温分解不可能生成
高温分解不可能生成 。理由是
。理由是___________ 。
(1)已知
 时,
时, 甲烷不完全燃烧生成
甲烷不完全燃烧生成 和液态水时放出
和液态水时放出 热量,则
热量,则 甲烷不完全燃烧的热化学方程式为
甲烷不完全燃烧的热化学方程式为(2)甲烷可以消除氮氧化物污染,发生的反应为
 ,在体积固定的密闭容器中,每次实验均加入
,在体积固定的密闭容器中,每次实验均加入 和
和 ,使
,使 、
、 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得 随时间的变化情况如下表:
随时间的变化情况如下表:| 实验序号 | 时间/ 温度  浓度/℃ | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
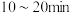 内,
内,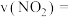
②
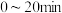 内,实验2比实验1反应速率快的原因可能是
内,实验2比实验1反应速率快的原因可能是(3)乙醇应用于燃料电池,该电池采用可传导
 的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为
的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为
(4)硝酸铵在高温或猛烈撞击时易爆炸,放出大量的热。
 高温分解不可能生成
高温分解不可能生成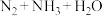 。理由是
。理由是
您最近一年使用:0次
名校
解题方法
8 . 碘及其化合物在合成杀菌剂、药物方面具有广泛用途。H2(g)+I2(g) 2HI(g)在1 L的恒温容器中进行,反应过程中部分数据见下表:
2HI(g)在1 L的恒温容器中进行,反应过程中部分数据见下表:
若在起始时总压为p0 kPa,反应速率若用单位时间内分压的变化表示,而气态物质分压=总压×气态物质的物质的量分数,则10 min内H2(g)的反应速率为( )
 2HI(g)在1 L的恒温容器中进行,反应过程中部分数据见下表:
2HI(g)在1 L的恒温容器中进行,反应过程中部分数据见下表:| 反应时间/min | H2(g)/mol | I2(g)/mol | HI(g)/mol |
| 0 | 4 | 4 | 0 |
| 5 | 2.5 | ||
| 10 | 2 |
| A.0.25p0 kPa·min-1 | B.0.025p0 kPa·min-1 |
| C.0.005p0 kPa·min-1 | D.0.016p0 kPa·min-1 |
您最近一年使用:0次
2020-10-24更新
|
302次组卷
|
4卷引用:河北省邢台市巨鹿中学2020-2021学年高二上学期第一次月考化学试题
河北省邢台市巨鹿中学2020-2021学年高二上学期第一次月考化学试题河北省巨鹿中学2020-2021学年高二下学期第一次月考化学试题(已下线)练习4 化学反应速率-2020-2021学年【补习教材·寒假作业】高二化学(人教版)作业(四) 化学反应速率
名校
9 . 联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性。都有着广泛的用途。已知反应N2H4(g)+2Cl2(g) N2(g)+4HCl(g),T℃时,向VL恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T℃时,向VL恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
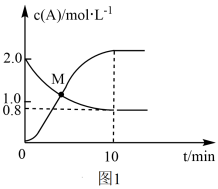
①0~10min内,用N2(g)表示的平均反应速率v(N2)=__ 。
②M点时,N2H4的转化率为__ (精确到0.1)%。
③已知次磷酸钠(NaH2PO2)为正盐,则次磷酸(H3PO2)是__ 元酸。
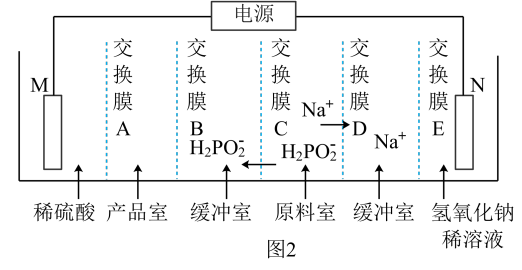
④用次磷酸钠(NaH2PO2)通过电渗析法制备次磷酸.装置如图2所示。交换膜A属于__ (填“阳离子”或“阴离子”)交换膜,电极N的电极反应式为__ ,当电路中流过3.8528×105库仑电量时。制得次磷酸的物质的量为__ (一个电子的电量为1.6×10-19库仑,NA数值约为6.02×1023)。
 N2(g)+4HCl(g),T℃时,向VL恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T℃时,向VL恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
①0~10min内,用N2(g)表示的平均反应速率v(N2)=
②M点时,N2H4的转化率为
③已知次磷酸钠(NaH2PO2)为正盐,则次磷酸(H3PO2)是
④用次磷酸钠(NaH2PO2)通过电渗析法制备次磷酸.装置如图2所示。交换膜A属于

您最近一年使用:0次
名校
解题方法
10 . CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+ O2(g)
O2(g) CO2(g)+2H2(g)的能量变化如图所示:
CO2(g)+2H2(g)的能量变化如图所示:
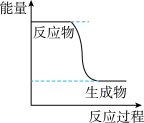
下列说法正确的是___________ (填字母标号)。
a.CH3OH转变成H2的过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1:2
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入容积为2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol/L,4min内平均反应速率v(H2)=_______ ,则CH3OH的转化率为______________ 。
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。已知其负极反应式为CH3OH+8OH--6e-= +6H2O。
+6H2O。
则下列说法正确的是___________ (填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子
(1)已知CH3OH(g)+
 O2(g)
O2(g) CO2(g)+2H2(g)的能量变化如图所示:
CO2(g)+2H2(g)的能量变化如图所示:
下列说法正确的是
a.CH3OH转变成H2的过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1:2
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入容积为2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol/L,4min内平均反应速率v(H2)=
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。已知其负极反应式为CH3OH+8OH--6e-=
 +6H2O。
+6H2O。则下列说法正确的是
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子
您最近一年使用:0次
2020-08-08更新
|
245次组卷
|
4卷引用:河北保定市博野县实验中学2020-2021学年高一下学期期中考试化学试题



