名校
1 . 回答下列问题
(1)向某体积固定的密闭容器中加入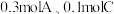 和
和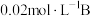 三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。请回答:
三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。请回答:
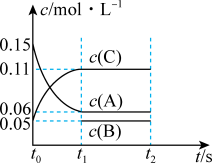
①该密闭容器的体积为_______ 升;若 ,则
,则 内用
内用 表示反应速率
表示反应速率
_______ ;
②写出该反应的化学方程式:_______ 。
③能使该反应的速率增大的是_______ 。
A.及时分离出C气体 B.适当升高温度
C.充入He气增大压强 D.选择高效催化剂
④下列物质表示该反应的化学反应速率最快的是_______ 。
A.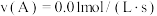
B.
C.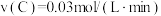
(2)已知断裂几种化学键要吸收的能量如下:
已知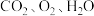 的结构式分别为
的结构式分别为 ,
, ,
, 。
。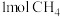 在
在 中完全燃烧生成气态
中完全燃烧生成气态 和气态水时放出
和气态水时放出_______  热量。
热量。
(3)燃料电池是一种高效、环境友好的供电装置,如图为氢气燃料电池的工作原理示意图, 均为惰性电极。
均为惰性电极。

①使用时,氢气从_______ 口通入(填“ ”或“B”)
”或“B”)
② 极的电极反应为:
极的电极反应为:_______ 。
(1)向某体积固定的密闭容器中加入
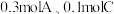 和
和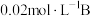 三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。请回答:
三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。请回答:
①该密闭容器的体积为
 ,则
,则 内用
内用 表示反应速率
表示反应速率
②写出该反应的化学方程式:
③能使该反应的速率增大的是
A.及时分离出C气体 B.适当升高温度
C.充入He气增大压强 D.选择高效催化剂
④下列物质表示该反应的化学反应速率最快的是
A.
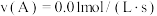
B.

C.
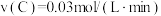
(2)已知断裂几种化学键要吸收的能量如下:
| 化学键 |
|
|
|
|
断裂 键吸收的能量 键吸收的能量 | 415 | 497 | 745 | 463 |
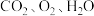 的结构式分别为
的结构式分别为 ,
, ,
, 。
。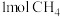 在
在 中完全燃烧生成气态
中完全燃烧生成气态 和气态水时放出
和气态水时放出 热量。
热量。(3)燃料电池是一种高效、环境友好的供电装置,如图为氢气燃料电池的工作原理示意图,
 均为惰性电极。
均为惰性电极。
①使用时,氢气从
 ”或“B”)
”或“B”)②
 极的电极反应为:
极的电极反应为:
您最近半年使用:0次
解题方法
2 . 为了实现“碳中和”, 的综合利用成为科学家研究的热点。
的综合利用成为科学家研究的热点。
(1)将 催化加氢制取
催化加氢制取 ,通过下列步骤实现,反应过程中能量变化如图1所示。
,通过下列步骤实现,反应过程中能量变化如图1所示。

___________  。
。
(2)在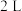 的绝热密闭容器中,按
的绝热密闭容器中,按 充入
充入 和
和 ,在催化剂作用下合成甲醇。下列说法中说明主反应
,在催化剂作用下合成甲醇。下列说法中说明主反应 达到平衡状态的是___________(填字母)。
达到平衡状态的是___________(填字母)。
(3)在密闭容器中通入 和
和 的混合气体,制取甲醇过程中,存在竞争反应:
的混合气体,制取甲醇过程中,存在竞争反应:
 .
. ;
;
 .
.
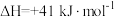 。
。
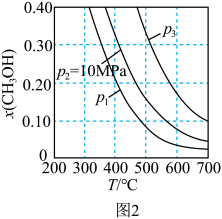
在不同压强下,当按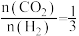 进料,反应达到平衡时,测得甲醇的物质的量分数与温度的关系如图2所示物质ⅰ的物质的量分数:
进料,反应达到平衡时,测得甲醇的物质的量分数与温度的关系如图2所示物质ⅰ的物质的量分数: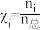 )
)___________ ,判断的依据是___________ 。
②图2中,当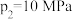 、发生上述反应,反应
、发生上述反应,反应 达到平衡时,
达到平衡时,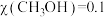 ,则在
,则在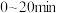 内用
内用 的分压变化表示的速率
的分压变化表示的速率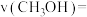
___________ 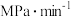 ,此时反应I中
,此时反应I中 的转化率为
的转化率为___________ (保留小数点后1位)。
③在压强为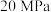 时,发生上述反应并达到平衡状态,
时,发生上述反应并达到平衡状态, 平衡转化率为
平衡转化率为 ,
,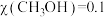 ,该温度下反应
,该温度下反应 的平衡常数
的平衡常数
___________ (保留1位有效数字,用各组分的分压代替浓度计算平衡常数 ,气体分压=总压×物质的量分数)。
,气体分压=总压×物质的量分数)。
 的综合利用成为科学家研究的热点。
的综合利用成为科学家研究的热点。(1)将
 催化加氢制取
催化加氢制取 ,通过下列步骤实现,反应过程中能量变化如图1所示。
,通过下列步骤实现,反应过程中能量变化如图1所示。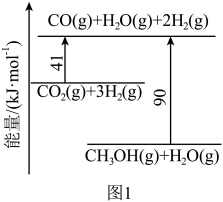


 。
。(2)在
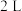 的绝热密闭容器中,按
的绝热密闭容器中,按 充入
充入 和
和 ,在催化剂作用下合成甲醇。下列说法中说明主反应
,在催化剂作用下合成甲醇。下列说法中说明主反应 达到平衡状态的是___________(填字母)。
达到平衡状态的是___________(填字母)。A. 的转化率保持不变 的转化率保持不变 | B.混合气体的密度保持不变 |
C.断裂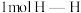 键同时形成 键同时形成 键 键 | D.容器内混合气体温度保持不变 |
(3)在密闭容器中通入
 和
和 的混合气体,制取甲醇过程中,存在竞争反应:
的混合气体,制取甲醇过程中,存在竞争反应: .
. ;
; .
.
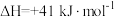 。
。在不同压强下,当按
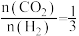 进料,反应达到平衡时,测得甲醇的物质的量分数与温度的关系如图2所示物质ⅰ的物质的量分数:
进料,反应达到平衡时,测得甲醇的物质的量分数与温度的关系如图2所示物质ⅰ的物质的量分数: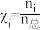 )
)
②图2中,当
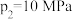 、发生上述反应,反应
、发生上述反应,反应 达到平衡时,
达到平衡时,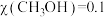 ,则在
,则在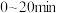 内用
内用 的分压变化表示的速率
的分压变化表示的速率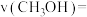
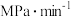 ,此时反应I中
,此时反应I中 的转化率为
的转化率为③在压强为
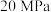 时,发生上述反应并达到平衡状态,
时,发生上述反应并达到平衡状态, 平衡转化率为
平衡转化率为 ,
,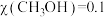 ,该温度下反应
,该温度下反应 的平衡常数
的平衡常数
 ,气体分压=总压×物质的量分数)。
,气体分压=总压×物质的量分数)。
您最近半年使用:0次
解题方法
3 . 雾霾主要成分为灰尘、 、
、 和有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一、
和有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一、
(1)以氨气为脱硝剂时,可将 还原为
还原为 。
。
①

②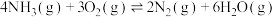

③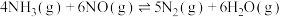


___________  (用含a、b的代数式表示)。
(用含a、b的代数式表示)。
(2)以臭氧为烟气脱硝剂时,脱硝过程涉及的反应之一为: 。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示:
。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示:
①
___________  (填“<”、“>”或“无法确定”),该反应的
(填“<”、“>”或“无法确定”),该反应的
___________ 0(填“<”或“>”)。
②0~25 min内乙容器中反应的平均速率:V(O2)___________ 。
③ 温度下,混合气体的起始总压为p,则达到平衡时,
温度下,混合气体的起始总压为p,则达到平衡时, 的转化率为
的转化率为___________ ,平衡常数Kp___________ 。
(3)乙烯也可用于烟气脱硝。为研究温度、催化剂中 负载量对NO去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的NO去除率,应选择的反应温度约为
负载量对NO去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的NO去除率,应选择的反应温度约为___________ ,催化剂中 负载量为
负载量为___________ 。
 、
、 和有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一、
和有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一、(1)以氨气为脱硝剂时,可将
 还原为
还原为 。
。①


②
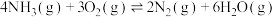

③
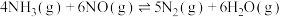


 (用含a、b的代数式表示)。
(用含a、b的代数式表示)。(2)以臭氧为烟气脱硝剂时,脱硝过程涉及的反应之一为:
 。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示:
。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示: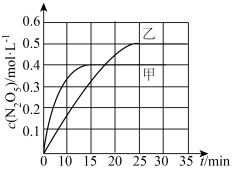
| 容器 | 甲 | 乙 |
| 温度/K |  |  |
| 容积/L | 2 | |
| 起始充入量 | 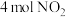 和 和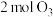 | |

 (填“<”、“>”或“无法确定”),该反应的
(填“<”、“>”或“无法确定”),该反应的
②0~25 min内乙容器中反应的平均速率:V(O2)
③
 温度下,混合气体的起始总压为p,则达到平衡时,
温度下,混合气体的起始总压为p,则达到平衡时, 的转化率为
的转化率为(3)乙烯也可用于烟气脱硝。为研究温度、催化剂中
 负载量对NO去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的NO去除率,应选择的反应温度约为
负载量对NO去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的NO去除率,应选择的反应温度约为 负载量为
负载量为
您最近半年使用:0次
解题方法
4 . 已知4NH3+5O2=4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确关系是
| A.4v(NH3)=5v(O2) | B.5v(O2)=6v(H2O) |
| C.2v(NH3)=3v(H2O) | D.4v(O2)=5v(NO) |
您最近半年使用:0次
2024-03-22更新
|
498次组卷
|
2卷引用:贵州神贵阳市2023-2024学年清镇市博雅实验学校高二上学期第四次月考化学试卷
解题方法
5 . 将4 mol H2和2 mol CO通入1 L的反应器中,一定条件下发生反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) △H,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是
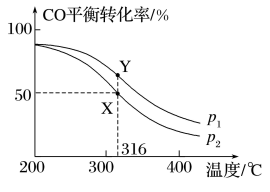

| A.△H>0 |
| B.p1<p2 |
| C.X点和Y点的化学平衡常数K(X)<K(Y) |
| D.在p2和316℃条件下反应10min,用CH3OCH3表示该反应速率为0.05mol/(L·min) |
您最近半年使用:0次
解题方法
6 . 回答下列问题:
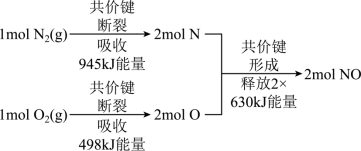
(1)汽车尾气主要含有一氧化碳、二氧化硫、一氧化氮等物质,是造成城市空气污染的主要因素之一。已知汽缸中氮气和氧气反应生成一氧化氮的能量变化值如图所示,则由该反应生成2molNO时,应_______ (填“释放”或“吸收”) _______ kJ能量。
(2)用氮化硅( )陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下: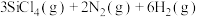

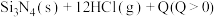 。
。
①写出 的电子式:
的电子式:_______ 。
②在一定温度下进行上述反应,若反应容器的容积为2L,3min后达到平衡,测得固体的质量增加了2.80g,则H2的平均反应速率_______ 。
③写出该反应的平衡常数表达式:K=_______
④一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_______ 。
A.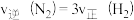
B.容器内压强保持不变
C.混合气体密度保持不变
D.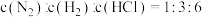
(3)CO2/ HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。 研究 HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的半透膜隔开。
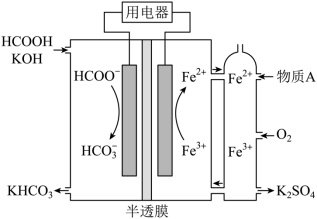
放电过程中需补充的物质A为_______ (填化学式)。
(1)汽车尾气主要含有一氧化碳、二氧化硫、一氧化氮等物质,是造成城市空气污染的主要因素之一。已知汽缸中氮气和氧气反应生成一氧化氮的能量变化值如图所示,则由该反应生成2molNO时,应

(2)用氮化硅(
 )陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下: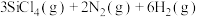

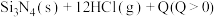 。
。①写出
 的电子式:
的电子式:②在一定温度下进行上述反应,若反应容器的容积为2L,3min后达到平衡,测得固体的质量增加了2.80g,则H2的平均反应速率
③写出该反应的平衡常数表达式:K=
④一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是
A.
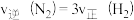
B.容器内压强保持不变
C.混合气体密度保持不变
D.
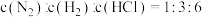
(3)CO2/ HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。 研究 HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的半透膜隔开。

放电过程中需补充的物质A为
您最近半年使用:0次
7 . 将CO2转化为更有价值的化工原料,正成为科学家们研究的一个重要领域。回答下列问题:
Ⅰ.在活性Fe的催化下将CO2加氢转化为CO,经历的两个基元反应如下:
反应①:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1 平衡常数为K1;
FeO(s)+CO(g) ΔH1 平衡常数为K1;
反应②:FeO(s)+H2(g) Fe(s)+H2O(g) ΔH2 平衡常数为K2;
Fe(s)+H2O(g) ΔH2 平衡常数为K2;
在不同温度时K1、K2的值如下表:
(1)由表中数据可知反应①是________ (填“吸热”或“放热”)反应。700℃时总反应CO2(g)+H2(g) CO(g)+H2O(g)的化学平衡常数K3=
CO(g)+H2O(g)的化学平衡常数K3=________ 。
Ⅱ. CO2和CO加氢都可以制CH3OH,热化学方程式分别为:
③ CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3 = -49kJ·mol-1,
CH3OH(g)+H2O(g) ΔH3 = -49kJ·mol-1,
④ CO(g)+2H2(g) CH3OH(g) ΔH4 = -90 kJ·mol-1
CH3OH(g) ΔH4 = -90 kJ·mol-1
(2)CO2(g)+H2(g) CO(g)+H2O(g)的反应为 ΔH =
CO(g)+H2O(g)的反应为 ΔH =________ ;
(3)CO2加氢制CH3OH的过程中,为了提高CO2的转化率,可以采取的措施是____________ (任写1条)。
(4)已知反应④CO(g)+2H2(g) CH3OH(g) 的速率表达式为v(CO) =k·cm(CO)·cn(H2) (k、m、n待测,k为速率常数,一般只受温度影响)。T℃时测得有关实验数据如下:
CH3OH(g) 的速率表达式为v(CO) =k·cm(CO)·cn(H2) (k、m、n待测,k为速率常数,一般只受温度影响)。T℃时测得有关实验数据如下:
分析上表中的数据,当速率以mol·L-1·s-1为单位时,k =________ 、m =________ 、n =________ ;在该温度下、在的密闭容器中,充入0.1mol ·L-1 CO 和0.2 mol·L-1 H2,则起始化学反应速率v(H2)= ________ 。
Ⅰ.在活性Fe的催化下将CO2加氢转化为CO,经历的两个基元反应如下:
反应①:Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH1 平衡常数为K1;
FeO(s)+CO(g) ΔH1 平衡常数为K1;反应②:FeO(s)+H2(g)
 Fe(s)+H2O(g) ΔH2 平衡常数为K2;
Fe(s)+H2O(g) ΔH2 平衡常数为K2;在不同温度时K1、K2的值如下表:
| 700℃ | 900℃ | |
| K1 | 1.5 | 2.0 |
| K2 | 0.4 | 0.6 |
(1)由表中数据可知反应①是
 CO(g)+H2O(g)的化学平衡常数K3=
CO(g)+H2O(g)的化学平衡常数K3=Ⅱ. CO2和CO加氢都可以制CH3OH,热化学方程式分别为:
③ CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH3 = -49kJ·mol-1,
CH3OH(g)+H2O(g) ΔH3 = -49kJ·mol-1,④ CO(g)+2H2(g)
 CH3OH(g) ΔH4 = -90 kJ·mol-1
CH3OH(g) ΔH4 = -90 kJ·mol-1 (2)CO2(g)+H2(g)
 CO(g)+H2O(g)的反应为 ΔH =
CO(g)+H2O(g)的反应为 ΔH =(3)CO2加氢制CH3OH的过程中,为了提高CO2的转化率,可以采取的措施是
(4)已知反应④CO(g)+2H2(g)
 CH3OH(g) 的速率表达式为v(CO) =k·cm(CO)·cn(H2) (k、m、n待测,k为速率常数,一般只受温度影响)。T℃时测得有关实验数据如下:
CH3OH(g) 的速率表达式为v(CO) =k·cm(CO)·cn(H2) (k、m、n待测,k为速率常数,一般只受温度影响)。T℃时测得有关实验数据如下:| 序号 | c(CO)/(mol·L-1) | c(H2)/(mol·L-1) | v(CO)/(mol·L-1·s-1) |
| ① | 0.01 | 0.01 | 2.0×10-6 |
| ② | 0.02 | 0.01 | 4.0×10-6 |
| ③ | 0.01 | 0.02 | 8.0×10-6 |
您最近半年使用:0次
8 . 一定温度下,向2.0L的恒容密闭容器中充入1.6molCO、1.6molNO,发生反应2NO(g)+2CO(g) N2(g)+2CO2(g),经过一段时间后达平衡。反应进行到不同时间测得n(CO)如表所示:
N2(g)+2CO2(g),经过一段时间后达平衡。反应进行到不同时间测得n(CO)如表所示:
下列说法正确的是
 N2(g)+2CO2(g),经过一段时间后达平衡。反应进行到不同时间测得n(CO)如表所示:
N2(g)+2CO2(g),经过一段时间后达平衡。反应进行到不同时间测得n(CO)如表所示:| t/s | 0 | 5 | 10 | 15 | 20 |
| n(CO)/mol | 1.6 | 1.2 | 0.9 | 0.8 | 0.8 |
| A.该温度下,该反应的平衡常数K=1.25 |
| B.反应在前5s的平均速率为v(N2)=0.04mol·L-1·s-1 |
| C.保持其他条件不变,升高温度,达到新平衡时c(CO)=0.45mol·L⁻1,则反应的ΔH>0 |
| D.相同温度下,起始时向容器中充入1.6mol CO、1.6mol NO、0.8mol N2、1.6 molCO2,达到平衡前v正<v逆 |
您最近半年使用:0次
9 . 雾霾主要成分为灰尘、SO2、NOx和有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
(1)以氨气为脱硝剂时,可将NOx还原为N2。
①N2(g)+O2(g)⇌2NO(g) △H1=akJ/mol
②4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g) △H2=bkJ/mol
③4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g) △H3
△H3=_______ kJ/mol(用含a、b的代数式表示)。
(2)以臭氧为烟气脱硝剂时,脱硝过程涉及的反应之一为:2NO2(g)+O3(g)⇌N2O5(g)+O2(g)。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示:
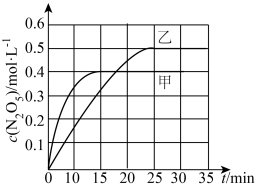
①T1_______ T2(填“<"、“>”或“无法确定”),该反应的△H_______ 0(填“<”或“>”)。
②0~25min内乙容器中反应的平均速率:v(NO2)=_______ 。
③T1温度下,混合气体的起始总压为p,则达到平衡时,NO2的转化率为_______ ,平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数)。
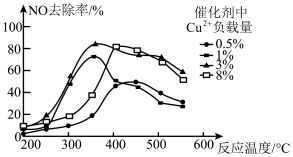
(3)乙烯也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对NO去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的NO去除率,应选择的反应温度约为_______ ,催化剂中Cu2+负载量为_______ 。
(1)以氨气为脱硝剂时,可将NOx还原为N2。
①N2(g)+O2(g)⇌2NO(g) △H1=akJ/mol
②4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g) △H2=bkJ/mol
③4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g) △H3
△H3=
(2)以臭氧为烟气脱硝剂时,脱硝过程涉及的反应之一为:2NO2(g)+O3(g)⇌N2O5(g)+O2(g)。不同温度下,控制其它条件一定,在两个恒容容器中发生该反应,相关信息如下表及图所示:

| 容器 | 甲 | 乙 |
| 温度/K | T1 | T2 |
| 容积/L | 2 | |
| 起始充入量 | 4molNO2和2molO3 | |
②0~25min内乙容器中反应的平均速率:v(NO2)=
③T1温度下,混合气体的起始总压为p,则达到平衡时,NO2的转化率为
(3)乙烯也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对NO去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的NO去除率,应选择的反应温度约为

您最近半年使用:0次
2024-03-03更新
|
135次组卷
|
2卷引用:贵州省贵阳市白云区第二高级中学2023-2024学年高三上学期质量监测化学试卷
10 . 回答下列问题
(1)汽车发动机工作时会引发 和
和 反应,生成
反应,生成 等污染大气,其中生成
等污染大气,其中生成 的能量变化如图所示,则图中三种分子最稳定的是
的能量变化如图所示,则图中三种分子最稳定的是___________ ;若反应生成 气体应
气体应___________ (填“释放”或“吸收”)___________  能量。
能量。

(2)工业燃烧煤、石油等化石燃料释放出大量氮氧化物( )、
)、 、
、 等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:催化剂存在下, 还原
还原 生成水蒸气和其他无毒物质的化学方程式为
生成水蒸气和其他无毒物质的化学方程式为___________ 。
Ⅱ.脱碳:向2L密闭容器中加入 、
、 在恒温恒容的条件下发生反应
在恒温恒容的条件下发生反应 ,2min后,生成了1mol的CH3OH, 则CO2的反应速率为
,2min后,生成了1mol的CH3OH, 则CO2的反应速率为___________ 。
下列叙述中,能说明此反应达到平衡状态的是___________ (填字母)。
A. 单位时间内生成1 mol CH3OH的同时生成1molH2O
B. 3v(CO2)正=v(H2)逆
C. 和
和 的浓度保持不变
的浓度保持不变
D. 混合气体的密度保持不变
(1)汽车发动机工作时会引发
 和
和 反应,生成
反应,生成 等污染大气,其中生成
等污染大气,其中生成 的能量变化如图所示,则图中三种分子最稳定的是
的能量变化如图所示,则图中三种分子最稳定的是 气体应
气体应 能量。
能量。
(2)工业燃烧煤、石油等化石燃料释放出大量氮氧化物(
 )、
)、 、
、 等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。Ⅰ.脱硝:催化剂存在下,
 还原
还原 生成水蒸气和其他无毒物质的化学方程式为
生成水蒸气和其他无毒物质的化学方程式为Ⅱ.脱碳:向2L密闭容器中加入
 、
、 在恒温恒容的条件下发生反应
在恒温恒容的条件下发生反应 ,2min后,生成了1mol的CH3OH, 则CO2的反应速率为
,2min后,生成了1mol的CH3OH, 则CO2的反应速率为下列叙述中,能说明此反应达到平衡状态的是
A. 单位时间内生成1 mol CH3OH的同时生成1molH2O
B. 3v(CO2)正=v(H2)逆
C.
 和
和 的浓度保持不变
的浓度保持不变D. 混合气体的密度保持不变
您最近半年使用:0次






