名校
解题方法
1 . 乙烯(CH2=CH2)是非常重要的化工基础原料,由乙烯可以制备很多有机物。
I.在恒温1L的刚性密闭容器中,加入1mol乙烯和1mol水,发生CH2=CH2(g)+H2O(g) CH3-CH2-OH(g)。乙醇的物质的量与反应时间的关系如下图:
CH3-CH2-OH(g)。乙醇的物质的量与反应时间的关系如下图:
(1)计算在0-6min内的反应速率v(H2O)=___________ mol·L-1·min-1。
(2)8min时反应达到化学平衡状态,其理由是:___________ 。
Ⅱ.在恒温1L的刚性密闭容器中,加入1mol乙烯和1mol氢气,发生CH2=CH2(g)+H2(g) CH3CH3(g),容器内气体的压强与反应时间的关系如下图:
CH3CH3(g),容器内气体的压强与反应时间的关系如下图:
(3)下列措施能增大反应速率的是___________(填字母)。
(4)达到化学平衡状态时,下列数值与开始时相同的是___________(填序号)
(5)反应进行到10min时,乙烯(CH2=CH2)的转化率a%=___________ 。
I.在恒温1L的刚性密闭容器中,加入1mol乙烯和1mol水,发生CH2=CH2(g)+H2O(g)
 CH3-CH2-OH(g)。乙醇的物质的量与反应时间的关系如下图:
CH3-CH2-OH(g)。乙醇的物质的量与反应时间的关系如下图:| 时间(min) | 0 | 2 | 4 | 6 | 8 | 10 |
| 乙醇的物质的量(mol) | 0 | 0.3 | 0.5 | 0.6 | 0.65 | 0.65 |
(2)8min时反应达到化学平衡状态,其理由是:
Ⅱ.在恒温1L的刚性密闭容器中,加入1mol乙烯和1mol氢气,发生CH2=CH2(g)+H2(g)
 CH3CH3(g),容器内气体的压强与反应时间的关系如下图:
CH3CH3(g),容器内气体的压强与反应时间的关系如下图:| 时间(min) | 0 | 2 | 4 | 6 | 8 | 10 |
| 气体压强(MPa) | 100 | 80 | 70 | 65 | 60 | 60 |
| A.升高温度 |
| B.降低压强 |
| C.减小CH3CH3的浓度 |
| D.加入合适的催化剂 |
| A.容器内气体的压强 |
| B.容器内n(H2) |
| C.容器内c(CH2=CH2) |
| D.容器内气体的总质量 |
您最近半年使用:0次
名校
2 . 已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O。某化学小组欲探究H2C2O4溶液和酸性KMnO4溶液反应过程中浓度、温度对化学反应速率的影响,进行了如下实验(忽略混合时溶液体积变化):
下列说法不正确的是
| 编号 | 0.01mol·L-1酸性KMnO4溶液体积/mL | 0.1mol·L-1H2C2O4溶液体积/mL | 水的体积/mL | 反应温度/℃ | 反应时间/min |
| Ⅰ | 2 | 2 | 0 | 20 | 2.1 |
| Ⅱ | V1 | 2 | 1 | 20 | 5.5 |
| Ⅲ | V2 | 2 | 0 | 50 | 0.5 |
| A.V1=1,V2=2 |
| B.实验计时是从溶液混合开始,溶液呈紫红色时结束 |
| C.设计实验Ⅰ、Ⅲ的目的是探究温度对反应速率的影响 |
| D.实验Ⅲ中用酸性KMnO4溶液的浓度变化表示的反应速率v(KMnO4)=0.02mol·L-1·min-1 |
您最近半年使用:0次
解题方法
3 . 二氧化碳固定是实现“碳达峰、碳中和”的重要途径。工业上利用 制备高附加值化工品
制备高附加值化工品 的化学反应是
的化学反应是 。在一定温度下,向10L恒容密闭容器中充入6mol
。在一定温度下,向10L恒容密闭容器中充入6mol 和6mol
和6mol 发生上述反应,测得
发生上述反应,测得 的物质的量与时间的关系如图所示。
的物质的量与时间的关系如图所示。
 制备高附加值化工品
制备高附加值化工品 的化学反应是
的化学反应是 。在一定温度下,向10L恒容密闭容器中充入6mol
。在一定温度下,向10L恒容密闭容器中充入6mol 和6mol
和6mol 发生上述反应,测得
发生上述反应,测得 的物质的量与时间的关系如图所示。
的物质的量与时间的关系如图所示。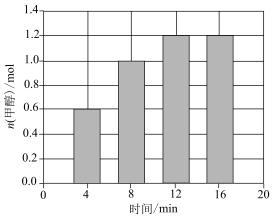
| A.混合气体密度不变时,该反应达到平衡状态 |
| B.该反应开始后,化学反应速率先慢后快,最后达到平衡状态 |
C.在8min时, 的正反应速率大于 的正反应速率大于 的逆反应速率 的逆反应速率 |
D.0~4min内 的平均反应速率为 的平均反应速率为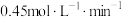 |
您最近半年使用:0次
名校
解题方法
4 . 一定温度,向体积固定的密闭容器中通入一定量的 和
和 ,进行合成氨反应
,进行合成氨反应 ,反应过程中部分物质的物质的量n随时间t变化如图所示。
,反应过程中部分物质的物质的量n随时间t变化如图所示。

下列说法正确的是
A.Y表示的物质是 | B. 时刻, 时刻, |
C. 时刻,Y的转化率为50% 时刻,Y的转化率为50% | D.a、b两点的正反应速率: |
您最近半年使用:0次
5 . 在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知有以下关系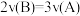 ,
,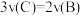 ,则此反应可表示为
,则此反应可表示为
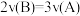 ,
,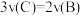 ,则此反应可表示为
,则此反应可表示为A. | B.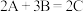 |
C.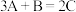 | D.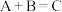 |
您最近半年使用:0次
名校
解题方法
6 . 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
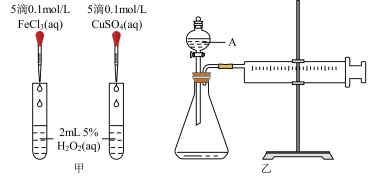
(1)定性分析:如图甲可通过观察___________ ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___________ 。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为___________ ,检查该装置气密性的方法是___________ ,实验中需要测量的数据是___________ 。
(3)加入0.10molMnO2粉末于50mLH2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。

①写出H2O2在二氧化锰作用下发生反应的化学方程式___________ 。
②实验时放出气体的总体积是___________ mL。
③放出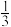 气体所需时间为
气体所需时间为___________ min。
④反应放出 气体所需时间约为
气体所需时间约为___________ min。
⑤A、B、C、D各点反应速率快慢的顺序为___________ 。
⑥解释反应速率变化的原因___________ 。
⑦计算H2O2的初始物质的量浓度___________ 。(请保留两位有效数字)

(1)定性分析:如图甲可通过观察
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为
(3)加入0.10molMnO2粉末于50mLH2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。

①写出H2O2在二氧化锰作用下发生反应的化学方程式
②实验时放出气体的总体积是
③放出
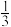 气体所需时间为
气体所需时间为④反应放出
 气体所需时间约为
气体所需时间约为⑤A、B、C、D各点反应速率快慢的顺序为
⑥解释反应速率变化的原因
⑦计算H2O2的初始物质的量浓度
您最近半年使用:0次
名校
7 . 某化学反应2A⇌B+D在四种不同条件下进行,B、D起始浓度为0.反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20min时间内平均速率为___________ mol·(L·min)-1。
(2)在实验2中A的初始浓度C2=___________ mol·L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是___________ 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3___________ v1(填“>”“=”或“<”=,且C3___________ 1.0mol·L-1(填“>”“=”或“<”=)。
(4)比较实验4和实验1,可推测该反应是___________ 反应(选填“吸热”或“放热”),理由是___________ 。
| 实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1,反应在10至20min时间内平均速率为
(2)在实验2中A的初始浓度C2=
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3
(4)比较实验4和实验1,可推测该反应是
您最近半年使用:0次
名校
解题方法
8 . 反应A+3B=2C+2D在四种不同情况下的反应速率分别为①v(A)=0.15mol·L-1·s-1;②v(B)=0.6mol·L-1·s-1;③v(C)=0.4mol·L-1·s-1;④v(D)=0.45mol·L-1·s-1。该反应进行的快慢顺序为___________ 。
您最近半年使用:0次
名校
解题方法
9 . CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示:
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示:___________ mol/(L·min)。
(2)10min时,CH3OH的物质的量为___________ mol,10min内,以H2表示的化学反应速率是___________ mol/(L·min)。
(3)到达平衡时,CO2的转化率为___________ 。
(4)3min时,v(正)___________ v(逆)(填“大于”、“等于”、“小于”),此时化学反应朝___________ 进行(填“正方向”或“逆方向”)。
 CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示:
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示:
(2)10min时,CH3OH的物质的量为
(3)到达平衡时,CO2的转化率为
(4)3min时,v(正)
您最近半年使用:0次
2024-02-25更新
|
663次组卷
|
2卷引用:海南中学白沙学校2022-2023学年高一下学期期末考试化学试题
名校
10 . 在2 L密闭容器中进行反应:mX(g)+nY(g) pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
已知2 min内v(Q)=0.075 mol·L-1·min-1, =0.5
=0.5
(1)试确定以下物质的相关量:起始时n(Y)=___________ ,n(Q)=___________ ;
(2)方程式中m=___________ ,n=___________ ,p=___________ ,q=___________ ;
(3)用Z表示2 min内的反应速率___________ 。
 pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:| 物质 时间 | X | Y | Z | Q |
| 起始/mol | 0.7 | 1 | ||
| 2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3 min末/mol | 0.8 |
 =0.5
=0.5(1)试确定以下物质的相关量:起始时n(Y)=
(2)方程式中m=
(3)用Z表示2 min内的反应速率
您最近半年使用:0次



