名校
解题方法
1 . 党的二十大报告中强调“实现碳达峰碳中和是一场广泛而深刻的经济社会系统性变革”。
 的转化和利用是实现碳中和的有效途径。回答下列问题:
的转化和利用是实现碳中和的有效途径。回答下列问题:
Ⅰ.利用 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
①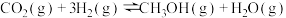
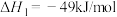
②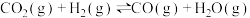
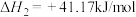
③

(1)反应③中活化能
__________ (填“>”或“<”)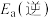 。
。
(2)在催化剂作用下,按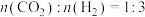 的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时
的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示: 。
。
①从图中曲线的变化趋势分析a点之后温度升高,甲醇选择性降低的原因__________ ,在实际工业生产中压强不能过高也不能过低的原因是____________ 。
②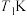 时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则
时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则 的分压=
的分压=__________ MPa,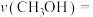
__________ MPa/min,反应②的
__________ ( 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。
Ⅱ.近年来,有研究人员用 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示:
的回收利用,其工作原理如图所示: ,则该电极反应式为
,则该电极反应式为____________________ 。

 的转化和利用是实现碳中和的有效途径。回答下列问题:
的转化和利用是实现碳中和的有效途径。回答下列问题:Ⅰ.利用
 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:①
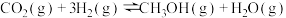
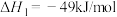
②
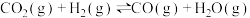
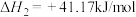
③


(1)反应③中活化能

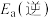 。
。(2)在催化剂作用下,按
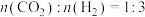 的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时
的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示:
 。
。①从图中曲线的变化趋势分析a点之后温度升高,甲醇选择性降低的原因
②
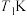 时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则
时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则 的分压=
的分压=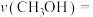

 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。Ⅱ.近年来,有研究人员用
 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示:
的回收利用,其工作原理如图所示: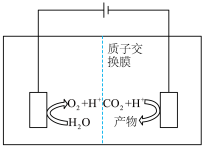
 ,则该电极反应式为
,则该电极反应式为
您最近半年使用:0次
名校
解题方法
2 . 在恒温恒容条件下,发生反应2A(g)+xB(g) 2C(g),反应体系中某物质的浓度c随时间的变化如图中曲线甲、乙所示,已知x为整数。下列说法不正确的是
2C(g),反应体系中某物质的浓度c随时间的变化如图中曲线甲、乙所示,已知x为整数。下列说法不正确的是
 2C(g),反应体系中某物质的浓度c随时间的变化如图中曲线甲、乙所示,已知x为整数。下列说法不正确的是
2C(g),反应体系中某物质的浓度c随时间的变化如图中曲线甲、乙所示,已知x为整数。下列说法不正确的是
| A.x=3 |
| B.曲线甲表示的是物质B在反应进程中的浓度变化 |
| C.10~30min内v(C)=0.05mol·L-1·min-1 |
| D.当混合气体的密度不再随时间的变化而变化,不能说明该反应达到平衡 |
您最近半年使用:0次
3 . 化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①哪一时间段反应速率最大___________ min(填“0~1”、“1~2”、“2~3”、“3~4”或“4~5”),原因是___________ 。
②2~3min内,以盐酸的浓度变化表示的平均反应速率为___________ mol/(L·min) (设溶液体积不变)。
(2)某温度下在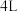 恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:___________ mol/L,该反应的化学方程式是___________ 。
②5min时,Z的生成速率___________ (填“大于”、“小于”或“等于”)6min时Z的生成速率。
③若升高温度,则逆反应速率___________ (填“增大”、“减小”或“不变”)。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在
 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL(标准状况) | 109 | 220 | 332 | 412 | 480 |
②2~3min内,以盐酸的浓度变化表示的平均反应速率为
(2)某温度下在
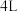 恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示: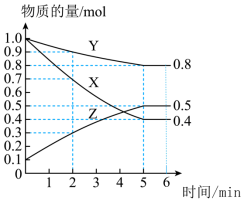
②5min时,Z的生成速率
③若升高温度,则逆反应速率
您最近半年使用:0次
解题方法
4 . 侯氏制碱法是我国化学工程专家侯德榜将氨碱法和合成氨法两种工艺联合起来生产纯碱的方法。主要过程如图所示(部分物质已略去):
(1)纯碱的化学式为___________ (填“ ”或“
”或“ ”);
”);
(2)操作①的名称是___________ (填“蒸发”或“过滤”);
(3)上述实验过程中可以循环使用的物质是___________ (填化学式);
(4)工业上可以用氨生产尿素,其方程式为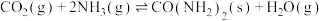 ,一定温度下,将1 mol
,一定温度下,将1 mol  和2 mol
和2 mol  充入体积为1L的密闭容器中,5 min后测得
充入体积为1L的密闭容器中,5 min后测得 的物质的量为0.6 mol,则:
的物质的量为0.6 mol,则:
①对上述反应,若适当升高温度,化学反应速率会___________ (填“增大”或“减小”);
②用 的浓度变化表示该反应的平均速率为
的浓度变化表示该反应的平均速率为___________ mol/(L·min)。
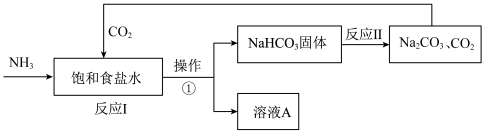
(1)纯碱的化学式为
 ”或“
”或“ ”);
”);(2)操作①的名称是
(3)上述实验过程中可以循环使用的物质是
(4)工业上可以用氨生产尿素,其方程式为
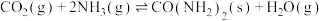 ,一定温度下,将1 mol
,一定温度下,将1 mol  和2 mol
和2 mol  充入体积为1L的密闭容器中,5 min后测得
充入体积为1L的密闭容器中,5 min后测得 的物质的量为0.6 mol,则:
的物质的量为0.6 mol,则:①对上述反应,若适当升高温度,化学反应速率会
②用
 的浓度变化表示该反应的平均速率为
的浓度变化表示该反应的平均速率为
您最近半年使用:0次
名校
5 . 电子工业上常用氯化铁溶液作印刷电路板的腐蚀液,使用过的腐蚀废液中的金属阳离子主要有Fe3+、Fe2+和Cu2+。化学兴趣小组设计如下流程对废液进行处理并回收氯化铁溶液。___________ (填“氧化”或“还原”)成Fe3+;取少量溶液A于试管中,滴入1~2滴KSCN溶液,溶液显___________ (填“红色”或“蓝色”)。
(2)实验室常用H2O2溶液制取氧气。在一定温度下,10 mL 0.40 mol·L-1的H2O2溶液发生催化分解,5 min时测得生成O2的体积为22.4 mL(已折算为标准状况)。
①用H2O2表示该反应的速率为___________ mol·(L·min)-1;
②其他条件不变时,升高反应的温度,该反应的速率将___________ (填“加快”或“减慢”)。

(2)实验室常用H2O2溶液制取氧气。在一定温度下,10 mL 0.40 mol·L-1的H2O2溶液发生催化分解,5 min时测得生成O2的体积为22.4 mL(已折算为标准状况)。
①用H2O2表示该反应的速率为
②其他条件不变时,升高反应的温度,该反应的速率将
您最近半年使用:0次
名校
6 . CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
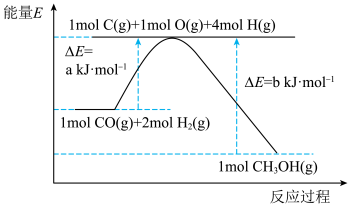
(1)已知利用合成气(主要成分CO和H2)在催化剂的作用下合成甲醇,发生反应为:CO(g)+2H2 (g) CH3OH(g)。反应过程中的能量变化如图所示,该反应为
CH3OH(g)。反应过程中的能量变化如图所示,该反应为___________ (填“放热”或“吸热”)反应。
(2)现在实验室中用CO和H2反应模拟甲醇合成反应,在2L恒容密闭容器内,400℃时发生反应:CO(g)+2H2 (g) CH3OH (g),体系中n(CO)随时间的变化如表:
CH3OH (g),体系中n(CO)随时间的变化如表:
①0~2min内,以H2表示的该反应速率v(H2)=___________ 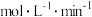 ;
;
②下列措施不能提高反应速率的有___________ (请用相应字母填空);
a.升高温度 b.恒T、恒V下充入H2
c.及时分离出CH3OH d.恒T、恒P下充入N2
e.加入高效催化剂
③下列叙述能说明反应达到平衡状态的是___________ (请用相应字母填空);
a.CO和H2的浓度保持不变 b. 2v正(H2)=v逆(CO)
c.容器内气体密度保持不变 d.容器内质量保持不变
e.每生成1mol CH3OH的同时有2mol H-H键形成
(3)化学能与其他能量间的转换在生活中处处可见,比如某种氢氧燃料电池已经成功应用在城市公交汽车上,该电池用30%H2SO4溶液作电解质溶液,其简易装置如图所示。
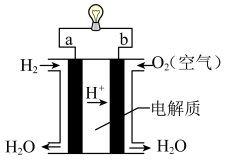
在这个燃料电池中,正极的电极反应式为_______________________ 。若在标况下,消耗了33.6L的氢气,此时电路中转移的电子数目为______________ (用阿伏加德罗常数表示)。
(1)已知利用合成气(主要成分CO和H2)在催化剂的作用下合成甲醇,发生反应为:CO(g)+2H2 (g)
 CH3OH(g)。反应过程中的能量变化如图所示,该反应为
CH3OH(g)。反应过程中的能量变化如图所示,该反应为
(2)现在实验室中用CO和H2反应模拟甲醇合成反应,在2L恒容密闭容器内,400℃时发生反应:CO(g)+2H2 (g)
 CH3OH (g),体系中n(CO)随时间的变化如表:
CH3OH (g),体系中n(CO)随时间的变化如表:时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CO) (mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
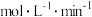 ;
;②下列措施不能提高反应速率的有
a.升高温度 b.恒T、恒V下充入H2
c.及时分离出CH3OH d.恒T、恒P下充入N2
e.加入高效催化剂
③下列叙述能说明反应达到平衡状态的是
a.CO和H2的浓度保持不变 b. 2v正(H2)=v逆(CO)
c.容器内气体密度保持不变 d.容器内质量保持不变
e.每生成1mol CH3OH的同时有2mol H-H键形成
(3)化学能与其他能量间的转换在生活中处处可见,比如某种氢氧燃料电池已经成功应用在城市公交汽车上,该电池用30%H2SO4溶液作电解质溶液,其简易装置如图所示。

在这个燃料电池中,正极的电极反应式为
您最近半年使用:0次
名校
7 . 一定温度下,在容积为2L的恒容密闭容器中进行某一反应,容器内M、N两种气体的物质的量随时间的变化曲线如图所示。下列说法正确的是
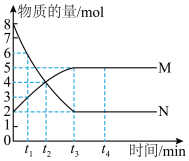
A.该反应的化学方程式为N(g) 2M(g) 2M(g) |
| B.t2min时,正、逆反应速率相等,反应达到平衡状态 |
| C.t4min时,容器容积不变,充入惰性气体Ar,正反应速率增大 |
D.t1~t2min内,用N的浓度变化表示的平均反应速率为 mol·L-1·min-1 mol·L-1·min-1 |
您最近半年使用:0次
名校
8 . 为研究不同状态 块状、粉末状
块状、粉末状 碳酸钙固体与盐酸反应的反应速率,某同学通过实验测定数据得出如图所示的曲线。下列有关说法中正确的
碳酸钙固体与盐酸反应的反应速率,某同学通过实验测定数据得出如图所示的曲线。下列有关说法中正确的
 块状、粉末状
块状、粉末状 碳酸钙固体与盐酸反应的反应速率,某同学通过实验测定数据得出如图所示的曲线。下列有关说法中正确的
碳酸钙固体与盐酸反应的反应速率,某同学通过实验测定数据得出如图所示的曲线。下列有关说法中正确的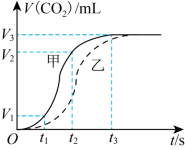
| A.曲线乙表示的是粉末状碳酸钙固体与盐酸反应 |
| B.随着反应进行,盐酸浓度降低,反应速率不断降低 |
C.若用单位时间内 的体积变化来表示该反应的速率,则 的体积变化来表示该反应的速率,则 时间内甲的平均反应速率为 时间内甲的平均反应速率为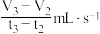 |
D.两次实验,粉末状固体最终生成的 的量更多 的量更多 |
您最近半年使用:0次
2024-05-03更新
|
535次组卷
|
3卷引用:湖南省常德市石门县第一中学2023-2024学年高一下学期化学期中考试题
湖南省常德市石门县第一中学2023-2024学年高一下学期化学期中考试题 (已下线)专题06 化学反应的速率与限度(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)6.2.1 化学反应的速率 随堂练习
解题方法
9 . 燃煤会产生CO2、CO、SO2等大气污染物。燃煤脱硫的相关反应的热化学方程式如下:
Ⅰ.
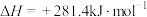
Ⅱ.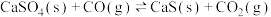
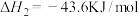
(1)一定温度下,向某恒容密闭容器中加入CaSO4(s)和1molCO,若只发生反应Ⅰ,下列能说明该反应已达到平衡状态的是________ (填字母)。
a.容器内的压强不发生变化 b.
c.容器内气体的密度不发生变化 d.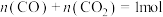
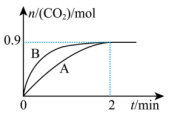
(2)一定温度下,体积为1L的容器中加入CaSO4(s)和1molCO,若只发生反应Ⅱ,测得CO2的物质的量随时间变化如图中曲线A所示:
________ 。
②曲线B表示过程与曲线A相比,改变的反应条件可能为________ (答出一条即可)。
③若要提高反应体系中CO2的体积分数,可采取的措施为________ 。
(3)以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.
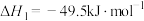
Ⅱ.

Ⅲ.

回答下列问题:

________ kJmol-1。
Ⅰ.

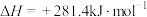
Ⅱ.
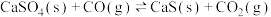
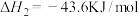
(1)一定温度下,向某恒容密闭容器中加入CaSO4(s)和1molCO,若只发生反应Ⅰ,下列能说明该反应已达到平衡状态的是
a.容器内的压强不发生变化 b.

c.容器内气体的密度不发生变化 d.
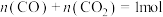
(2)一定温度下,体积为1L的容器中加入CaSO4(s)和1molCO,若只发生反应Ⅱ,测得CO2的物质的量随时间变化如图中曲线A所示:

②曲线B表示过程与曲线A相比,改变的反应条件可能为
③若要提高反应体系中CO2的体积分数,可采取的措施为
(3)以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.

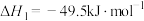
Ⅱ.


Ⅲ.


回答下列问题:

您最近半年使用:0次
10 . 氨是合成硝酸、铵盐和氮肥的基本原料,在科学技术和生产中有重要的应用。请回答下列问题:
(1)以N2和H2为原料,合成氨气的反应为N2(g)+3H2(g) 2NH3(g) ΔH<0,下列措施可以提高v(正)的是
2NH3(g) ΔH<0,下列措施可以提高v(正)的是___________ (填序号)。
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.降低温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个体积可变的恒压密闭容器中,p = 5MPa,原气体体积为2L。5分钟后反应达到平衡时,n(N2)=1.0mol,n(H2)=3.0mol,n(NH3)=1.0mol,则反应速率v (N2)=___________ mol/min (用单位时间物质的量变量表示化学反应速率),平衡常数Kp =___________ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是
2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是___________ (填序号)。
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时的值最大
(4)氨和联氨(N2H4)是氨的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式:___________ 。标况下,每消耗1.12L氨气,转移___________ mol电子。
(1)以N2和H2为原料,合成氨气的反应为N2(g)+3H2(g)
 2NH3(g) ΔH<0,下列措施可以提高v(正)的是
2NH3(g) ΔH<0,下列措施可以提高v(正)的是a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.降低温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个体积可变的恒压密闭容器中,p = 5MPa,原气体体积为2L。5分钟后反应达到平衡时,n(N2)=1.0mol,n(H2)=3.0mol,n(NH3)=1.0mol,则反应速率v (N2)=
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)
 2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是
2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是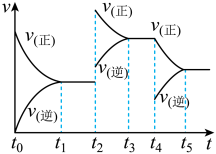
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时的值最大
(4)氨和联氨(N2H4)是氨的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式:
您最近半年使用:0次



