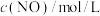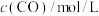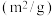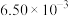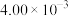解题方法
1 . 一定条件下,反应 在
在 密闭容器中进行,
密闭容器中进行, 内氨的质量增加
内氨的质量增加 ,则在这段时间内的反应速率是
,则在这段时间内的反应速率是
 在
在 密闭容器中进行,
密闭容器中进行, 内氨的质量增加
内氨的质量增加 ,则在这段时间内的反应速率是
,则在这段时间内的反应速率是A.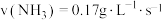 | B. |
C. | D. |
您最近半年使用:0次
名校
解题方法
2 . 按要求回答下列问题:
(1)下列过程中,既属于氧化还原反应,又属于吸热反应的是___________ 。
①甲烷的燃烧 ②水煤气的制备 ③石灰石受热分解 ④碘升华 ⑤金属的锈蚀
(2)一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应(产物均为气体),反应中各物质物质的量的变化如图所示。___________ 。
②6s后容器内的压强与开始时压强之比为___________ 。
(3)一定条件下, 、CO在体积固定的绝热密闭容器中发生如下反应:
、CO在体积固定的绝热密闭容器中发生如下反应: ,下列选项不能判断该反应达到平衡状态的依据的
,下列选项不能判断该反应达到平衡状态的依据的___________ 。
①密闭容器中CO的体积分数不变 ②密闭容器中总压强不变 ③密闭容器中混合气体的密度不变 ④密闭容器中混合气体的平均相对分子质量不变 ⑤体系内的温度不再变化 ⑥单位时间内,断裂4mol H-H键,同时生成2mol H-O键
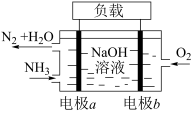
(4)潜艇中使用的液氨液氧燃料电池工作原理如图所示:___________ (填“正极”或“负极”),其电极反应为___________ 。
(1)下列过程中,既属于氧化还原反应,又属于吸热反应的是
①甲烷的燃烧 ②水煤气的制备 ③石灰石受热分解 ④碘升华 ⑤金属的锈蚀
(2)一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应(产物均为气体),反应中各物质物质的量的变化如图所示。

②6s后容器内的压强与开始时压强之比为
(3)一定条件下,
 、CO在体积固定的绝热密闭容器中发生如下反应:
、CO在体积固定的绝热密闭容器中发生如下反应: ,下列选项不能判断该反应达到平衡状态的依据的
,下列选项不能判断该反应达到平衡状态的依据的①密闭容器中CO的体积分数不变 ②密闭容器中总压强不变 ③密闭容器中混合气体的密度不变 ④密闭容器中混合气体的平均相对分子质量不变 ⑤体系内的温度不再变化 ⑥单位时间内,断裂4mol H-H键,同时生成2mol H-O键
(4)潜艇中使用的液氨液氧燃料电池工作原理如图所示:
您最近半年使用:0次
解题方法
3 . 汽车尾气系统中装置催化转化器可减少CO和NO的污染。查阅资料可知使用同种催化剂,质量相等时催化剂的比表面积对催化效率有影响。某实验小组的实验数据、图像分析与结论如下。下列说法不正确的是
编号 | t/℃ |
|
| 催化剂的比表面积 | 实验图像 |
I | 280 |
|
| 80 |
|
II | a |
|
| 120 | |
III | c |
|
| 80 |
A.汽车尾气处理的化学方程式为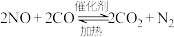 |
B.由图像可知: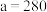 , ,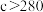 |
| C.其他条件相同时,增大催化剂的比表面积,该化学反应的速率将减小 |
D.第I组实验中,如果反应5min达到平衡,用NO表示该化学反应速率为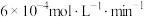 |
您最近半年使用:0次
解题方法
4 . 下列实验不能达到目的的是
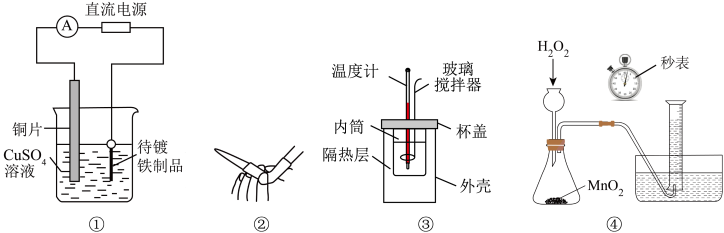
| A.①中待镀铁制品应与电源负极相连而形成铜镀层 |
| B.②中用于排出碱式滴定管中的气泡 |
| C.③中用于测定中和反应的反应热 |
D.④中测量 的分解速率 的分解速率 |
您最近半年使用:0次
名校
解题方法
5 . 对 和
和 进行回收利用是节能减排的重要课题。某温度下,向恒容密闭容器中充入
进行回收利用是节能减排的重要课题。某温度下,向恒容密闭容器中充入 发生反应:
发生反应: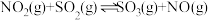 。
。
(1)①只改变下列某一反应条件时,能使上述反应速率加快的是_______ 。
A.使用高效催化剂 B. 向容器中充入氩气
C. 降低温度 D. 减小 的物质的量
的物质的量
②下列能说明反应达到平衡状态的是_______ 。
A.混合气体的密度保持不变
B. 的物质的量保持不变
的物质的量保持不变
C.容器内混合气体原子总数不变
D.每生成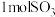 的同时消耗
的同时消耗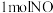
(2)在体积为 密闭容器中充入
密闭容器中充入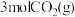 和
和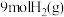 ,发生反应
,发生反应 ,测得
,测得 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。 时,
时,
_______  (填>“<”或“=)。
(填>“<”或“=)。
②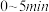 内,
内,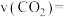
_______  。
。
③反应达到平衡状态时,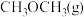 的体积分数为
的体积分数为_______  (保留1位小数)。
(保留1位小数)。
④a、b、c三点中代表达到平衡的是_______ ,a点的正反应速率_______ (填>、<或=)b点的逆反应速率
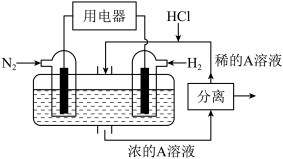
⑤“二甲醚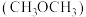 酸性燃料电池”的工作原理示意图如图所示。A电极为
酸性燃料电池”的工作原理示意图如图所示。A电极为_______ (填“正”或“负”)极:该电极的电极反应式为:_______ ,当消耗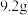 的二甲醚时,转移电子的数目为:
的二甲醚时,转移电子的数目为:_______ 。
 和
和 进行回收利用是节能减排的重要课题。某温度下,向恒容密闭容器中充入
进行回收利用是节能减排的重要课题。某温度下,向恒容密闭容器中充入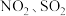 发生反应:
发生反应: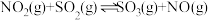 。
。(1)①只改变下列某一反应条件时,能使上述反应速率加快的是
A.使用高效催化剂 B. 向容器中充入氩气
C. 降低温度 D. 减小
 的物质的量
的物质的量②下列能说明反应达到平衡状态的是
A.混合气体的密度保持不变
B.
 的物质的量保持不变
的物质的量保持不变C.容器内混合气体原子总数不变
D.每生成
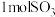 的同时消耗
的同时消耗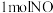
(2)在体积为
 密闭容器中充入
密闭容器中充入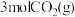 和
和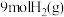 ,发生反应
,发生反应 ,测得
,测得 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。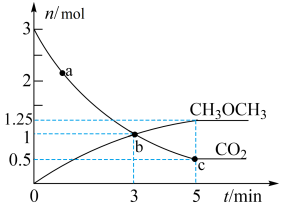
 时,
时,
 (填>“<”或“=)。
(填>“<”或“=)。②
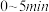 内,
内,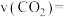
 。
。 ③反应达到平衡状态时,
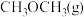 的体积分数为
的体积分数为 (保留1位小数)。
(保留1位小数)。④a、b、c三点中代表达到平衡的是
⑤“二甲醚
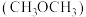 酸性燃料电池”的工作原理示意图如图所示。A电极为
酸性燃料电池”的工作原理示意图如图所示。A电极为 的二甲醚时,转移电子的数目为:
的二甲醚时,转移电子的数目为:
您最近半年使用:0次
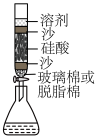
6 . 含硫化合物是实验室和工业上的常用化学品。
请回答:
(1)通过以下两种方法均可以制得硫酸铜
方法1:铜屑与浓硫酸在加热条件下反应
方法2:铜屑在不断通入空气的稀硫酸溶液中加热反应
①方法1制取过程中发生反应的化学方程式________ 。
②方法2相对方法1具有的优点是________ 。
③为了使方法2中铜的溶解速率加快,可采取的措施是________ 。
A.升高温度 B.增加铜屑用量 C.将通入气体改为 D.加入
D.加入
(2)根据电化学原理,某同学将方法2中的反应设计成原电池装置(见图)________ 极,发生________ 反应。
②写出正极的电极方程式:________ 。
(3)工业上主要采用接触法由含硫矿石制备硫酸。
其中接触室中产生 的反应为:
的反应为: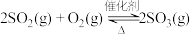 ,将一定浓度的
,将一定浓度的 和
和 通入恒容密闭容器中,气体中各成分的浓度变化如右图所示。
通入恒容密闭容器中,气体中各成分的浓度变化如右图所示。 的曲线是
的曲线是________ 。(填a、b或c)
②根据M点的坐标,计算 内,用
内,用 表示的反应速率为
表示的反应速率为________  。
。
③控制温度850K反应一段时间,则下列选项能说明上述反应已经达到平衡的是________ 。
A. 的体积分数保持不变
的体积分数保持不变
B.气体的密度保持不变
C.
D.气体的平均相对分子质量保持不变
请回答:
(1)通过以下两种方法均可以制得硫酸铜
方法1:铜屑与浓硫酸在加热条件下反应
方法2:铜屑在不断通入空气的稀硫酸溶液中加热反应
①方法1制取过程中发生反应的化学方程式
②方法2相对方法1具有的优点是
③为了使方法2中铜的溶解速率加快,可采取的措施是
A.升高温度 B.增加铜屑用量 C.将通入气体改为
 D.加入
D.加入
(2)根据电化学原理,某同学将方法2中的反应设计成原电池装置(见图)

②写出正极的电极方程式:
(3)工业上主要采用接触法由含硫矿石制备硫酸。
其中接触室中产生
 的反应为:
的反应为: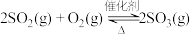 ,将一定浓度的
,将一定浓度的 和
和 通入恒容密闭容器中,气体中各成分的浓度变化如右图所示。
通入恒容密闭容器中,气体中各成分的浓度变化如右图所示。
 的曲线是
的曲线是②根据M点的坐标,计算
 内,用
内,用 表示的反应速率为
表示的反应速率为 。
。③控制温度850K反应一段时间,则下列选项能说明上述反应已经达到平衡的是
A.
 的体积分数保持不变
的体积分数保持不变B.气体的密度保持不变
C.

D.气体的平均相对分子质量保持不变
您最近半年使用:0次
名校
解题方法
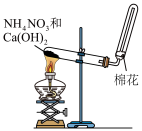
7 . 氢能是一种非常清洁的能源,氨分解制备氢气是一种技术先进和经济可行的工艺。恒温恒容密闭容器中,在某催化剂表面上发生氨的分解反应2NH3(g) N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下NH3的浓度随时间的变化如下表所示:
N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下NH3的浓度随时间的变化如下表所示:
(1)实验①中20~40min,v(NH3)=___________ 。
(2)为提高该反应的速率,下列措施可行的是___________(填标号)。
(3)关于上述实验,下列说法正确的是___________(填序号)。
(4)已知断裂1mol H-H、1mol N-H、1mol N≡N分别要吸收436kJ、391kJ、946kJ的能量。请在坐标图中,画出反应过程中体系的能量变化图__________ (进行必要的标注)。___________ 。
②电池正极的电极反应式为___________ 。
 N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下NH3的浓度随时间的变化如下表所示:
N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下NH3的浓度随时间的变化如下表所示:
(1)实验①中20~40min,v(NH3)=
(2)为提高该反应的速率,下列措施可行的是___________(填标号)。
| A.适当提高反应的温度 | B.恒温恒压充入He(g) |
| C.缩小容器的体积 | D.恒温恒容充入He(g)使压强增大 |
(3)关于上述实验,下列说法正确的是___________(填序号)。
| A.实验①,H2的反应速率:0~20min大于20~40min |
| B.实验②,x数值可能为0 |
| C.相同条件下,增加氨气的浓度,反应速率增大 |
| D.相同条件下,增加催化剂的表面积,反应速率增大 |
(4)已知断裂1mol H-H、1mol N-H、1mol N≡N分别要吸收436kJ、391kJ、946kJ的能量。请在坐标图中,画出反应过程中体系的能量变化图

②电池正极的电极反应式为
您最近半年使用:0次
8 . 利用下列装置和试剂进行实验,不能达到实验目的的是
|
|
|
|
| ① | ② | ③ | ④ |
| A.图①装置可用于测定镁和稀硫酸反应速率 |
| B.图②装置可用于比较碳酸钠和碳酸氢钠的稳定性 |
| C.图③装置可用于分离、提纯有机化合物 |
| D.图④装置可用于实验室制氨气 |
您最近半年使用:0次
2024-04-17更新
|
309次组卷
|
2卷引用:浙江省金华市十校2023-2024学年高三下学期4月模拟考试化学试题
名校
9 . 某温度下,在 恒容密闭容器中投入一定量的A、B,发生反应:
恒容密闭容器中投入一定量的A、B,发生反应: ,
, 时生成C的物质的量为
时生成C的物质的量为 (反应进程如图所示)。
(反应进程如图所示)。
下列说法中不正确 的是
 恒容密闭容器中投入一定量的A、B,发生反应:
恒容密闭容器中投入一定量的A、B,发生反应: ,
, 时生成C的物质的量为
时生成C的物质的量为 (反应进程如图所示)。
(反应进程如图所示)。下列说法中
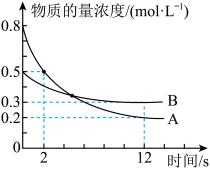
A.方程式中  |
B. 后, 后,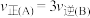 |
C.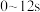 内混合气体的密度随反应进行而减小 内混合气体的密度随反应进行而减小 |
D. 内,D的平均反应速率为 内,D的平均反应速率为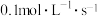 |
您最近半年使用:0次
2024-04-15更新
|
1311次组卷
|
2卷引用:浙江省精诚联盟2023-2024学年高一下学期3月月考化学试题
名校
10 . 室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N=X+Y;②M+N=X+Z,反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中组分M、Z的浓度(mol。L-1)随时间(分)变化情况如图,下列说法正确的是
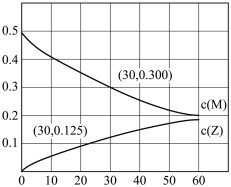
| A.0~30min时间段内,Y的平均反应速率为6.67×10-3mol·L-1·min-1 |
B.反应过程中体系Y和Z的浓度之比保持不变,30min时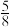 的M转化为Z 的M转化为Z |
| C.反应②的活化能比反应①的活化能大 |
| D.若该平行反应为可逆反应,正反应都为放热,升高温度,可提高Y的产率 |
您最近半年使用:0次