名校
1 . 某反应 的速率方程为
的速率方程为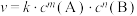 。其中,k为速率常数。已知其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示,下列说法不正确的是
。其中,k为速率常数。已知其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示,下列说法不正确的是
 的速率方程为
的速率方程为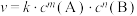 。其中,k为速率常数。已知其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示,下列说法不正确的是
。其中,k为速率常数。已知其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.8/k。改变反应物浓度时,反应的瞬时速率如表所示,下列说法不正确的是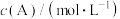 | 0.25 | 0.50 | 1.00 | 0.50 | 1.00 |  |
 | 0.050 | 0.050 | 0.100 | 0.100 | 0.200 |  |
 | 1.6 | 3.2 | 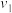 | 3.2 |  | 4.8 |
A.上述表格中的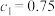 、 、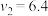 |
B.该反应的速率常数 |
| C.升温、加入催化剂均可使k增大,反应瞬时速率加快 |
| D.在过量的B存在时,当剩余6.25%的A时,所需的时间是375min |
您最近一年使用:0次
2024-01-24更新
|
466次组卷
|
3卷引用:2024届浙江省瑞安中学高三上学期首考适应性考试 化学试题
2024届浙江省瑞安中学高三上学期首考适应性考试 化学试题重庆市第七中学校2023-2024学年高三下学期2月月考化学试题(已下线)专题06 化学反应速率与化学平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
2 . 将等物质的量的A、B混合于2L的密闭容器中,发生反应: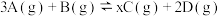 ,经2min后测得D的浓度为0.5mol/L,
,经2min后测得D的浓度为0.5mol/L, ,以C表示的平均反应速率
,以C表示的平均反应速率 ,下列说法错误的是
,下列说法错误的是
| A.反应速率为v(B)=0.125mol·L-1·min-1 | B.该化学方程式中,x=2 |
C. 时, 时, 的物质的量为 的物质的量为 | D. 时, 时, 的转化率为 的转化率为 |
您最近一年使用:0次
2024-01-20更新
|
1037次组卷
|
5卷引用:浙江省温州第二高级中学2023-2024学年高一下学期月考化学试题
名校
解题方法
3 . Ⅰ.为比较 和
和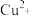 对
对 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性分析:如图甲可通过观察___________ 的快慢,定性比较得出结论;
(2)定量分析。如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。
实验中需要测量的数据是___________ 。
(3)查阅资料得知:将作为催化剂的 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从
均参加了反应,试从催化剂的角度 分析,这两个氧化还原反应的离子方程式分别是: 和
和___________ 。
Ⅱ.某化学实验小组利用酸性 溶液与
溶液与 溶液反应研究影响反应速率的因素。实验过程中通过测定
溶液反应研究影响反应速率的因素。实验过程中通过测定 溶液褪色所需的时间来比较化学反应速率的大小。实验数据如下:
溶液褪色所需的时间来比较化学反应速率的大小。实验数据如下:
(4)实验中反应的离子方程式为___________ 。
(5)
___________ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是___________ 。
(6)2号实验中,用 表示的反应速率为
表示的反应速率为___________ (反应后溶液的总体积变化忽略不计)。
 和
和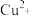 对
对 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察
(2)定量分析。如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。
实验中需要测量的数据是
(3)查阅资料得知:将作为催化剂的
 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从
均参加了反应,试从 和
和Ⅱ.某化学实验小组利用酸性
 溶液与
溶液与 溶液反应研究影响反应速率的因素。实验过程中通过测定
溶液反应研究影响反应速率的因素。实验过程中通过测定 溶液褪色所需的时间来比较化学反应速率的大小。实验数据如下:
溶液褪色所需的时间来比较化学反应速率的大小。实验数据如下:| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | x |
  溶液/mL 溶液/mL | 5 | 10 | 10 | 5 |
  溶液/mL 溶液/mL | 5 | 5 | 10 | 10 |
| 时间/s | 20 | 10 | 5 | ― |
(5)

(6)2号实验中,用
 表示的反应速率为
表示的反应速率为
您最近一年使用:0次
名校
解题方法
4 . 请回答下列问题:
(1)醋酸是常见的弱酸,在水溶液中存在电离平衡。
①下列方法中,可以使醋酸溶液中 电离程度增大的是
电离程度增大的是___________ (填字母序号)。
a.滴加少量浓盐酸 b.加水稀释 c.加入少量醋酸钠晶体 d.升高温度
②两个密闭装置中各装入0.05g镁条,分别加入2mL 盐酸和醋酸。压强随时间变化如图所示。
盐酸和醋酸。压强随时间变化如图所示。

刚开始时镁条与盐酸的反应速率大于镁条与醋酸的反应速率,原因是___________ 。反应结束后两个容器中压强相等,说明___________ 。
(2)某些弱酸在25℃时的电离常数如下:
①上述酸中酸性最强的是___________ 。
②25℃时,某HCN的物质的量浓度为 ,达到电离平衡时溶液中
,达到电离平衡时溶液中
___________  。
。
③下列反应不能发生的是___________ (填字母)。
A.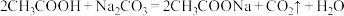
B.
C.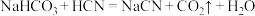
D.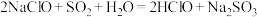
(3)25℃,向1.0L某盐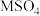 溶液中加入浓氢氧化钠溶液,先出现沉淀,随着氢氧化钠的加入沉淀逐渐溶解得到澄清溶液,假设体积不变;―lgc与pH的关系如图所示,c为
溶液中加入浓氢氧化钠溶液,先出现沉淀,随着氢氧化钠的加入沉淀逐渐溶解得到澄清溶液,假设体积不变;―lgc与pH的关系如图所示,c为 或
或 物质的量浓度的值。回答以下问题:
物质的量浓度的值。回答以下问题:

①a曲线表示___________ (填“ ”或“
”或“ ”)的―lgc与pH的关系。
”)的―lgc与pH的关系。
②pH=10时,溶液中M元素的存在形式为___________ 。(填化学式)
③ 的溶度积常数
的溶度积常数
___________ 。
(1)醋酸是常见的弱酸,在水溶液中存在电离平衡。
①下列方法中,可以使醋酸溶液中
 电离程度增大的是
电离程度增大的是a.滴加少量浓盐酸 b.加水稀释 c.加入少量醋酸钠晶体 d.升高温度
②两个密闭装置中各装入0.05g镁条,分别加入2mL
 盐酸和醋酸。压强随时间变化如图所示。
盐酸和醋酸。压强随时间变化如图所示。
刚开始时镁条与盐酸的反应速率大于镁条与醋酸的反应速率,原因是
(2)某些弱酸在25℃时的电离常数如下:
| 化学式 |  | HCN | HClO |  |  |
| 电离常数 |  |  |  | 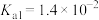  |   |
②25℃时,某HCN的物质的量浓度为
 ,达到电离平衡时溶液中
,达到电离平衡时溶液中
 。
。③下列反应不能发生的是
A.
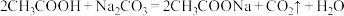
B.

C.
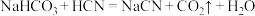
D.
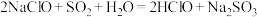
(3)25℃,向1.0L某盐
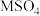 溶液中加入浓氢氧化钠溶液,先出现沉淀,随着氢氧化钠的加入沉淀逐渐溶解得到澄清溶液,假设体积不变;―lgc与pH的关系如图所示,c为
溶液中加入浓氢氧化钠溶液,先出现沉淀,随着氢氧化钠的加入沉淀逐渐溶解得到澄清溶液,假设体积不变;―lgc与pH的关系如图所示,c为 或
或 物质的量浓度的值。回答以下问题:
物质的量浓度的值。回答以下问题:
①a曲线表示
 ”或“
”或“ ”)的―lgc与pH的关系。
”)的―lgc与pH的关系。②pH=10时,溶液中M元素的存在形式为
③
 的溶度积常数
的溶度积常数
您最近一年使用:0次
5 . 氮肥工业中,利用 消除
消除 ,可防止催化剂中毒,其反应为
,可防止催化剂中毒,其反应为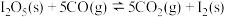 。恒温条件下,在2L的恒容密闭容器中装入足量
。恒温条件下,在2L的恒容密闭容器中装入足量 固体和
固体和 ,反应进行
,反应进行 后,容器内
后,容器内 的体积分数为0.3,下列说法正确的是
的体积分数为0.3,下列说法正确的是
 消除
消除 ,可防止催化剂中毒,其反应为
,可防止催化剂中毒,其反应为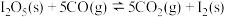 。恒温条件下,在2L的恒容密闭容器中装入足量
。恒温条件下,在2L的恒容密闭容器中装入足量 固体和
固体和 ,反应进行
,反应进行 后,容器内
后,容器内 的体积分数为0.3,下列说法正确的是
的体积分数为0.3,下列说法正确的是A.增加 固体的用量可以增大 固体的用量可以增大 的转化率 的转化率 |
B.0到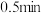 内, 内, 反应速率 反应速率 |
| C.平衡后再充入氦气,化学反应速率不发生变化 |
D.平衡后再充入 ,达到新平衡后, ,达到新平衡后, 浓度与原平衡相同 浓度与原平衡相同 |
您最近一年使用:0次
解题方法
6 . 在不同温度下,向2L密闭容器中加入0.5mol NO和0.5mol活性炭,发生反应:2NO(g)+C(s)  N2(g)+CO2(g) ΔH<0,5min后反应达到平衡,平衡数据如下:
N2(g)+CO2(g) ΔH<0,5min后反应达到平衡,平衡数据如下:
下列有关说法正确的是
 N2(g)+CO2(g) ΔH<0,5min后反应达到平衡,平衡数据如下:
N2(g)+CO2(g) ΔH<0,5min后反应达到平衡,平衡数据如下:| 温度/℃ | n(C)/mol | n(CO2)/mol |
| T1 | 0.15 | |
| T2 | 0.375 |
A.T1℃时,该反应的平衡常数K=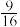 |
| B.T1℃时,5min时CO2的反应速率为0.015mol·L-1·min-1 |
| C.由上述信息可推知:T1>T2 |
| D.T2℃时,反应达到平衡后再通入NO,c(N2):c(NO)增大 |
您最近一年使用:0次
2023-12-14更新
|
194次组卷
|
2卷引用:浙江省杭州市“六县九校”联盟2023-2024学年高二上学期11月期中考试化学试题
7 . 一定温度下,X、Y、Z三种气体在某恒容密闭容器中发生反应,其中气体的物质的量变化曲线如图所示。下列说法正确的是


| A.Q点时,Y的正反应速率大于逆反应速率 |
B.0~15min内,用X表示的平均反应速率是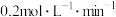 |
C.该反应的化学方程式可表示为: |
| D.达到平衡后,再充入氩气(氩气不参与反应),压强增大使反应速率加快 |
您最近一年使用:0次
名校
解题方法
8 . 研究 之间的转化具有重要意义。
之间的转化具有重要意义。
(1)已知:
 ,将一定量
,将一定量 气体充入恒容的密闭容器中,控制反应温度为
气体充入恒容的密闭容器中,控制反应温度为 。
。
①下列可以作为反应达到平衡的判据是___________ 。
A.气体的压强不变 B.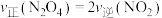 C.K不变
C.K不变
D.容器内气体的密度不变 E.容器内颜色不变
②在恒温恒容容器中加入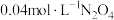 ,经过
,经过 反应达到平衡,
反应达到平衡, 气体的平衡转化率为75%,则用
气体的平衡转化率为75%,则用 表示的平均反应速率为
表示的平均反应速率为___________  (用t表示)。
(用t表示)。
③在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。
的体积分数随压强变化曲线如图所示。

由状态B到状态A,可以选择方法是___________ (填“升高”或“降低”)温度。A、C两点气体的颜色是___________ (填“A比C深”、“C比A深”或“A与C一样深”)。
(2)NO氧化反应: 分两步进行,其反应过程能量变化示意图如左图。
分两步进行,其反应过程能量变化示意图如左图。
I.


II.




①决定NO氧化反应速率的步骤是___________ (填“I”或“II”)。
②在恒容的密闭容器中充入一定量的NO和 气体,保持其它条件不变,控制反应温度分别为
气体,保持其它条件不变,控制反应温度分别为 和
和
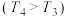 ,测得
,测得 随t(时间)的变化曲线如右图。转化相同量的NO,在温度
随t(时间)的变化曲线如右图。转化相同量的NO,在温度___________ (填“ ”或“
”或“ ”)下消耗的时间较长,试结合反应过程能量图分析其原因
”)下消耗的时间较长,试结合反应过程能量图分析其原因___________ 。
 之间的转化具有重要意义。
之间的转化具有重要意义。(1)已知:

 ,将一定量
,将一定量 气体充入恒容的密闭容器中,控制反应温度为
气体充入恒容的密闭容器中,控制反应温度为 。
。①下列可以作为反应达到平衡的判据是
A.气体的压强不变 B.
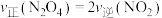 C.K不变
C.K不变D.容器内气体的密度不变 E.容器内颜色不变
②在恒温恒容容器中加入
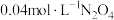 ,经过
,经过 反应达到平衡,
反应达到平衡, 气体的平衡转化率为75%,则用
气体的平衡转化率为75%,则用 表示的平均反应速率为
表示的平均反应速率为 (用t表示)。
(用t表示)。③在温度为
 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。
的体积分数随压强变化曲线如图所示。
由状态B到状态A,可以选择方法是
(2)NO氧化反应:
 分两步进行,其反应过程能量变化示意图如左图。
分两步进行,其反应过程能量变化示意图如左图。I.



II.





①决定NO氧化反应速率的步骤是
②在恒容的密闭容器中充入一定量的NO和
 气体,保持其它条件不变,控制反应温度分别为
气体,保持其它条件不变,控制反应温度分别为 和
和
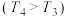 ,测得
,测得 随t(时间)的变化曲线如右图。转化相同量的NO,在温度
随t(时间)的变化曲线如右图。转化相同量的NO,在温度 ”或“
”或“ ”)下消耗的时间较长,试结合反应过程能量图分析其原因
”)下消耗的时间较长,试结合反应过程能量图分析其原因
您最近一年使用:0次
2023-12-13更新
|
103次组卷
|
2卷引用:浙江省杭州第二中学2023-2024学年高二上学期期中考试化学试题
9 . 在恒温下,向容积为2L的恒容容器中加入一定量的碳单质和2molH2O(g),初始压强为105Pa。发生反应: ∆H>0。经过2min后达到平衡,容器的压强增加了20%。
∆H>0。经过2min后达到平衡,容器的压强增加了20%。
(1)该反应自发进行的条件是__________ 。(填“高温”或“低温”或“任意条件”)
(2)2min内H2O的平均反应速率为__________ mol/(L·min)。
(3)2min平衡时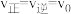 ,采取下列措施后,使
,采取下列措施后,使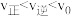 的是__________。
的是__________。
(4)平衡常数Kp=__________ Pa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)下列说法正确的是__________。
 ∆H>0。经过2min后达到平衡,容器的压强增加了20%。
∆H>0。经过2min后达到平衡,容器的压强增加了20%。(1)该反应自发进行的条件是
(2)2min内H2O的平均反应速率为
(3)2min平衡时
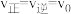 ,采取下列措施后,使
,采取下列措施后,使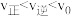 的是__________。
的是__________。| A.恒温恒容下,除去部分H2O | B.降低温度 |
| C.恒温恒容下,充入Ar | D.恒温恒压下,充入Ar |
(5)下列说法正确的是__________。
| A.增加碳单质,可以加快该反应速率 |
| B.2min时,H2O的转化率为20% |
| C.当混合气体的平均摩尔质量不再变化时,可以判断该反应达到了平衡 |
| D.平衡后向体系内补加0.4molH2O(g)和0.4molCO(g),反应向逆反应方向进行 |
您最近一年使用:0次
2023-12-11更新
|
176次组卷
|
2卷引用:浙江省绍兴市第一中学2023-2024学年高二上学期11月期中考试(平行班)化学试题
10 . 80℃时,2L密闭容器中充入 ,发生反应
,发生反应
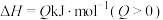 ,获得如下数据:
,获得如下数据:
下列判断正确的是
 ,发生反应
,发生反应
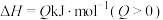 ,获得如下数据:
,获得如下数据:| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A.升高温度,该反应的平衡常数K减小 |
B.40~60s内,平均反应速率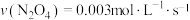 |
C.反应达到平衡时,吸收的热量为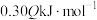 |
D.100s时再通入 ,达到新平衡时 ,达到新平衡时 的转化率减小 的转化率减小 |
您最近一年使用:0次
2023-12-02更新
|
116次组卷
|
2卷引用:浙江省台州市山海协作体2023-2024学年高二上学期期中联考化学试题



