名校
解题方法
1 . 回答下列问题。
(1)治理大气中的 以及废水中的硫化物是环境保护的重要课题。加入固硫剂,是一种有效的治理措施。生石灰是常用的固硫剂,固硫过程中涉及的部分反应如下:
以及废水中的硫化物是环境保护的重要课题。加入固硫剂,是一种有效的治理措施。生石灰是常用的固硫剂,固硫过程中涉及的部分反应如下:
①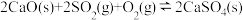
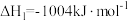
②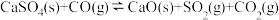
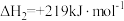
则 的燃烧热为
的燃烧热为___________  。
。
(2)一定条件下铁可以和 发生反应:
发生反应: 。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的
。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 气体,反应过程中
气体,反应过程中 气体和
气体和 气体的浓度与时间的关系如图所示。
气体的浓度与时间的关系如图所示。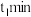 时,正、逆反应速率的大小关系为
时,正、逆反应速率的大小关系为
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。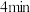 内,
内, 的平均反应速率
的平均反应速率
___________ 。
②下列描述能说明上述反应已达到平衡状态的是___________ (填序号)。
A.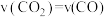
B.单位时间内生成 ,的同时生成
,的同时生成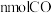
C.容器中气体压强不随时间变化而变化
D.容器中气体的平均相对分子质量不随时间变化而变化
E. 和
和 浓度相等
浓度相等
(3)某温度下在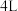 密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:___________ 。
②平衡时,混合气体中X、Y、Z的体积比为___________ 。
(1)治理大气中的
 以及废水中的硫化物是环境保护的重要课题。加入固硫剂,是一种有效的治理措施。生石灰是常用的固硫剂,固硫过程中涉及的部分反应如下:
以及废水中的硫化物是环境保护的重要课题。加入固硫剂,是一种有效的治理措施。生石灰是常用的固硫剂,固硫过程中涉及的部分反应如下:①
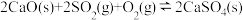
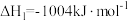
②
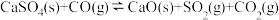
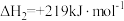
则
 的燃烧热为
的燃烧热为 。
。(2)一定条件下铁可以和
 发生反应:
发生反应: 。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的
。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 气体,反应过程中
气体,反应过程中 气体和
气体和 气体的浓度与时间的关系如图所示。
气体的浓度与时间的关系如图所示。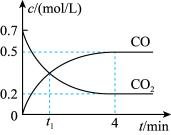
 时,正、逆反应速率的大小关系为
时,正、逆反应速率的大小关系为
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 内,
内, 的平均反应速率
的平均反应速率
②下列描述能说明上述反应已达到平衡状态的是
A.
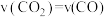
B.单位时间内生成
 ,的同时生成
,的同时生成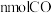
C.容器中气体压强不随时间变化而变化
D.容器中气体的平均相对分子质量不随时间变化而变化
E.
 和
和 浓度相等
浓度相等(3)某温度下在
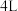 密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
②平衡时,混合气体中X、Y、Z的体积比为
您最近半年使用:0次
名校
解题方法
2 . Ⅰ.铁是生产生活、科学研究中的重要物质,研究与Fe相关的反应时要关注反应的快慢和程度,某些有铁参与的反应可设计成原电池。
(1)以下是相同条件下,等体积等浓度的H2O2溶液分解的对比实验时,放出 O2的体积随时间的变化关系示意图(线a为使用FeCl3作催化剂,线b为不使用催化剂),其中正确的图像是______(填字母)。
Ⅱ.已知下列热化学为程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H1=﹣25 kJ·mol-1
②Fe2O3(s)+CO(g) = 2FeO(s)+CO2(g) △H2=﹣3 kJ·mol-1
(2)写出Fe被CO2氧化成FeO(s) 和 CO的热化学方程式_______ 。
一定温度下,向某密闭容器中加入足量铁并充入一定量的CO2气体,发生第(2)题的反应。反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。_____ v逆(CO2)(填“>”“<”或“=”)。
(4)0~4min内, CO的平均反应速率v(CO)=____ 。
(5)仅改变下列条件,化学反应速率减小的是___ (填字母)。
A.减少铁的质量 B.降低温度 C.保持压强不变,充入He使容器的体积增大
Ⅲ.某化学兴趣小组利用反应Cu + 2FeCl3 = CuCl2 + 2FeCl2,设计了如图所示的原电池装置。___ 极(填“正”或“负”),。
(7)写出b电极上的电极反应式______ 。
(1)以下是相同条件下,等体积等浓度的H2O2溶液分解的对比实验时,放出 O2的体积随时间的变化关系示意图(线a为使用FeCl3作催化剂,线b为不使用催化剂),其中正确的图像是______(填字母)。
A. | B.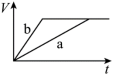 |
C.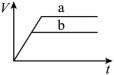 | D.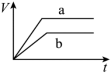 |
Ⅱ.已知下列热化学为程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H1=﹣25 kJ·mol-1
②Fe2O3(s)+CO(g) = 2FeO(s)+CO2(g) △H2=﹣3 kJ·mol-1
(2)写出Fe被CO2氧化成FeO(s) 和 CO的热化学方程式
一定温度下,向某密闭容器中加入足量铁并充入一定量的CO2气体,发生第(2)题的反应。反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
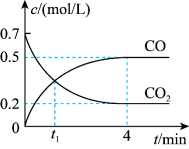
(4)0~4min内, CO的平均反应速率v(CO)=
(5)仅改变下列条件,化学反应速率减小的是
A.减少铁的质量 B.降低温度 C.保持压强不变,充入He使容器的体积增大
Ⅲ.某化学兴趣小组利用反应Cu + 2FeCl3 = CuCl2 + 2FeCl2,设计了如图所示的原电池装置。
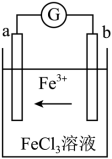
(7)写出b电极上的电极反应式
您最近半年使用:0次
名校
解题方法
3 . 某温度时,在容积为3 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由图中数据分析,下列结论正确的是

| A.该反应的化学方程式为2Z+Y = 3X |
| B.3min 时,正、逆反应都不再继续进行,反应达到化学平衡 |
| C.反应到3min时,容器中的反应完成程度达到了最大 |
| D.温度、体积不变,3min 时充入1 mol He使压强增大,正逆反应速率都增大 |
您最近半年使用:0次
4 . 碳单质及其化合物广泛存在于人们的生产和生活中。研究碳单质及其化合物的结构、性质、转化是科技工作者的研究热点。
(1)实验室常用邻二氮菲检验亚铁离子,生成橙红色的邻二氮菲亚铁络离子X: 的最外层电子排布式是
的最外层电子排布式是________________ 。
②X中除含共价键外,还含配位键, X含
X含________ mol配位键。
(2)温度为T时,在恒容密闭容器中充入一定量的 和
和 混合气体,发生反应:
混合气体,发生反应:

 。
。
已知该反应存在: ,
,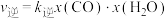 ,其中
,其中 、
、 为速率常数,x为相关物质的物质的量分数。反应达到平衡时,若
为速率常数,x为相关物质的物质的量分数。反应达到平衡时,若 、
、 转化率均为60%,且该反应的
转化率均为60%,且该反应的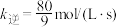 ,则
,则
________ 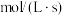 ,压强平衡常数
,压强平衡常数
________ 。
(3)氧化锰八面体分子筛(简称OMS-2)是一种纳米级别的新型环保催化剂,对挥发性有机物(VOCs)的氧化去除有着很好的催化作用。如用OMS-2为催化剂(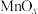 为对比催化实验)氧化处理甲醛的反应生成
为对比催化实验)氧化处理甲醛的反应生成 、
、 ,在等时间内HCHO转化率随温度的变化关系如图所示。
,在等时间内HCHO转化率随温度的变化关系如图所示。 、
、 反应的化学方程式是
反应的化学方程式是________________________ 。
②下列有关说法中,正确的有________ 。
A.相比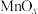 ,OMS-2能提高甲醛氧化的平衡转化率
,OMS-2能提高甲醛氧化的平衡转化率
B.OMS-2能降低甲醛氧化反应的活化能
C.OMS-2作为纳米材料,表面积大,催化效果好
D.两种催化剂的平衡转化率均随温度的升高而增大
(4)以合成气( 、
、 )为原料合成乙二醇的反应:
)为原料合成乙二醇的反应:
反应ⅰ.
反应ⅱ.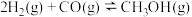
温度为473K,在恒容(2.0L)密闭容器中充入一定量的合成气(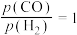 ,测得体系总压为40MPa),在
,测得体系总压为40MPa),在 (其中含
(其中含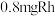 )催化剂作用下,进行上述反应。测得
)催化剂作用下,进行上述反应。测得 的时空收率为
的时空收率为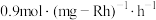 ,反应速率
,反应速率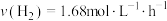 。
。
【注】(催化剂)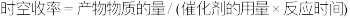 。
。
①反应速率
________  。
。
②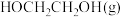 的时空收率为
的时空收率为________ 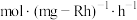 。
。
(1)实验室常用邻二氮菲检验亚铁离子,生成橙红色的邻二氮菲亚铁络离子X:

 的最外层电子排布式是
的最外层电子排布式是②X中除含共价键外,还含配位键,
 X含
X含(2)温度为T时,在恒容密闭容器中充入一定量的
 和
和 混合气体,发生反应:
混合气体,发生反应:
 。
。已知该反应存在:
 ,
,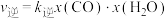 ,其中
,其中 、
、 为速率常数,x为相关物质的物质的量分数。反应达到平衡时,若
为速率常数,x为相关物质的物质的量分数。反应达到平衡时,若 、
、 转化率均为60%,且该反应的
转化率均为60%,且该反应的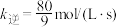 ,则
,则
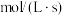 ,压强平衡常数
,压强平衡常数
(3)氧化锰八面体分子筛(简称OMS-2)是一种纳米级别的新型环保催化剂,对挥发性有机物(VOCs)的氧化去除有着很好的催化作用。如用OMS-2为催化剂(
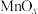 为对比催化实验)氧化处理甲醛的反应生成
为对比催化实验)氧化处理甲醛的反应生成 、
、 ,在等时间内HCHO转化率随温度的变化关系如图所示。
,在等时间内HCHO转化率随温度的变化关系如图所示。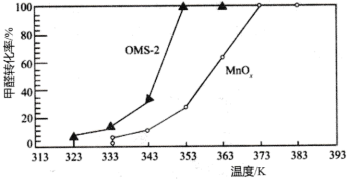
 、
、 反应的化学方程式是
反应的化学方程式是②下列有关说法中,正确的有
A.相比
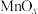 ,OMS-2能提高甲醛氧化的平衡转化率
,OMS-2能提高甲醛氧化的平衡转化率B.OMS-2能降低甲醛氧化反应的活化能
C.OMS-2作为纳米材料,表面积大,催化效果好
D.两种催化剂的平衡转化率均随温度的升高而增大
(4)以合成气(
 、
、 )为原料合成乙二醇的反应:
)为原料合成乙二醇的反应:反应ⅰ.

反应ⅱ.
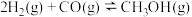
温度为473K,在恒容(2.0L)密闭容器中充入一定量的合成气(
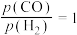 ,测得体系总压为40MPa),在
,测得体系总压为40MPa),在 (其中含
(其中含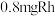 )催化剂作用下,进行上述反应。测得
)催化剂作用下,进行上述反应。测得 的时空收率为
的时空收率为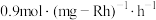 ,反应速率
,反应速率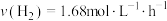 。
。【注】(催化剂)
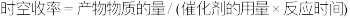 。
。①反应速率

 。
。②
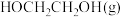 的时空收率为
的时空收率为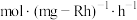 。
。
您最近半年使用:0次
解题方法
5 . 一定温度下,在 的密闭容器中,
的密闭容器中, 两种气体的物质的量随时间变化的曲线如图所示:
两种气体的物质的量随时间变化的曲线如图所示:_______ 。
(2)反应达到最大限度的时间是______  ,该时间内的平均反应速率
,该时间内的平均反应速率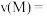
______ 。
(3)判断该反应达到平衡状态的依据是_______。
(4)能加快反应速率的措施是_______。
(5)反应进行到4min时,N的转化率为_______ 。
 的密闭容器中,
的密闭容器中, 两种气体的物质的量随时间变化的曲线如图所示:
两种气体的物质的量随时间变化的曲线如图所示: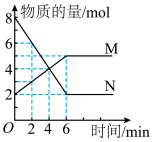
(2)反应达到最大限度的时间是
 ,该时间内的平均反应速率
,该时间内的平均反应速率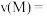
(3)判断该反应达到平衡状态的依据是_______。
| A.该条件下,正、逆反应速率都为零 |
| B.该条件下,混合气体的密度不再发生变化 |
| C.该条件下,混合气体的压强不再发生变化 |
D.该条件下,单位时间内消耗 的同时,消耗 的同时,消耗 |
(4)能加快反应速率的措施是_______。
| A.升高温度 |
B.容器容积不变,充入惰性气体 |
C.容器压强不变,充入惰性气体 |
| D.使用催化剂 |
(5)反应进行到4min时,N的转化率为
您最近半年使用:0次
6 . Ⅰ 氨气被广泛用于化工、轻工、化肥、合成纤维、制药等领域,已知工业合成氨的反应为
氨气被广泛用于化工、轻工、化肥、合成纤维、制药等领域,已知工业合成氨的反应为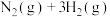

 气态分子中
气态分子中 化学键解离成气态原子所吸收的能量称为键能
化学键解离成气态原子所吸收的能量称为键能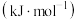 ,一些共价键的键能如下表所示。
,一些共价键的键能如下表所示。
(1)请根据上表数据计算,一定条件下,氮气与氢气生成 氨气时
氨气时___________  填“放出”或“吸收”
填“放出”或“吸收” 的热量为
的热量为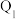 ,则
,则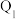 为
为___________  。
。
(2)在与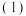 相同条件下,将
相同条件下,将 氮气和
氮气和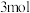 氢气放入一密闭容器中发生上述反应,放出或吸收的热量为
氢气放入一密闭容器中发生上述反应,放出或吸收的热量为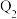 ,则
,则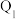 与
与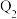 比较,正确的是
比较,正确的是___________ (填字母)。
A.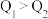 B.
B.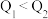 C.
C.
Ⅱ 一定条件下铁可以和
一定条件下铁可以和 发生反应:
发生反应: 。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的
。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 气体,反应过程中
气体,反应过程中 气体和
气体和 气体的浓度与时间的关系如图所示。
气体的浓度与时间的关系如图所示。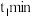 时,正、逆反应速率的大小关系为
时,正、逆反应速率的大小关系为
___________ 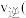 填“
填“ ”“
”“ ”或“
”或“ ”
” 。
。
(4)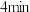 内,
内, 的平均反应速率
的平均反应速率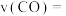
___________ 。
(5)下列条件的改变能减慢其反应速率的是___________ 。
①降低温度
 减小铁粉的质量
减小铁粉的质量
 保持压强不变,充入
保持压强不变,充入 使容器的容积增大
使容器的容积增大
 保持容积不变,充入
保持容积不变,充入 便体系压强增大
便体系压强增大
(6)下列描述能说明上述反应已达到平衡状态的是___________ 。
①
 单位时间内生成
单位时间内生成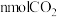 ,的同时生成
,的同时生成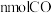
 容器中气体压强不随时间变化而变化
容器中气体压强不随时间变化而变化
④容器中气体的平均相对分子质量不随时间变化而变化
(7)燃料电池是燃料 如
如 、
、 、
、 等
等 跟氧气
跟氧气 或空气
或空气 反应将化学能转变成电能的装置,若电解质溶液是强碱溶液,下列关于一氧化碳燃料电池的说法正确的是___________
反应将化学能转变成电能的装置,若电解质溶液是强碱溶液,下列关于一氧化碳燃料电池的说法正确的是___________ 填字母
填字母 。
。
 氨气被广泛用于化工、轻工、化肥、合成纤维、制药等领域,已知工业合成氨的反应为
氨气被广泛用于化工、轻工、化肥、合成纤维、制药等领域,已知工业合成氨的反应为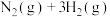

 气态分子中
气态分子中 化学键解离成气态原子所吸收的能量称为键能
化学键解离成气态原子所吸收的能量称为键能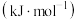 ,一些共价键的键能如下表所示。
,一些共价键的键能如下表所示。| 共价键 |  |  |  |
键能 | 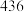 | 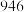 | 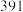 |
(1)请根据上表数据计算,一定条件下,氮气与氢气生成
 氨气时
氨气时 填“放出”或“吸收”
填“放出”或“吸收” 的热量为
的热量为 ,则
,则 为
为 。
。(2)在与
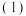 相同条件下,将
相同条件下,将 氮气和
氮气和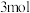 氢气放入一密闭容器中发生上述反应,放出或吸收的热量为
氢气放入一密闭容器中发生上述反应,放出或吸收的热量为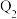 ,则
,则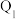 与
与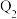 比较,正确的是
比较,正确的是A.
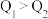 B.
B.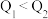 C.
C.
Ⅱ
 一定条件下铁可以和
一定条件下铁可以和 发生反应:
发生反应: 。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的
。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 气体,反应过程中
气体,反应过程中 气体和
气体和 气体的浓度与时间的关系如图所示。
气体的浓度与时间的关系如图所示。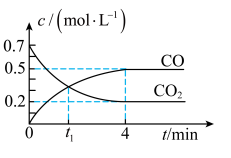
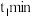 时,正、逆反应速率的大小关系为
时,正、逆反应速率的大小关系为
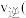 填“
填“ ”“
”“ ”或“
”或“ ”
” 。
。(4)
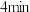 内,
内, 的平均反应速率
的平均反应速率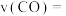
(5)下列条件的改变能减慢其反应速率的是
①降低温度
 减小铁粉的质量
减小铁粉的质量 保持压强不变,充入
保持压强不变,充入 使容器的容积增大
使容器的容积增大 保持容积不变,充入
保持容积不变,充入 便体系压强增大
便体系压强增大(6)下列描述能说明上述反应已达到平衡状态的是
①

 单位时间内生成
单位时间内生成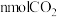 ,的同时生成
,的同时生成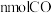
 容器中气体压强不随时间变化而变化
容器中气体压强不随时间变化而变化④容器中气体的平均相对分子质量不随时间变化而变化
(7)燃料电池是燃料
 如
如 、
、 、
、 等
等 跟氧气
跟氧气 或空气
或空气 反应将化学能转变成电能的装置,若电解质溶液是强碱溶液,下列关于一氧化碳燃料电池的说法正确的是___________
反应将化学能转变成电能的装置,若电解质溶液是强碱溶液,下列关于一氧化碳燃料电池的说法正确的是___________ 填字母
填字母 。
。A.正极反应式: |
B.负极反应式: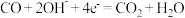 |
| C.随着放电的进行,溶液中氢氧根离子浓度保持不变 |
| D.放电时溶液中的阴离子向负极移动 |
您最近半年使用:0次
名校
解题方法
7 . 工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和 ),其反应的化学方程式为
),其反应的化学方程式为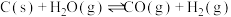 ,请回答下列问题:
,请回答下列问题:
(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是_______。
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是_______。
(3)在体积均为2L的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和2.8mol水蒸气,在不同温度下反应的过程如图所示: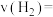
_______ 。
②甲容器中,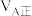
_______ 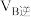 (填“<”“>”或“=”下同)。
(填“<”“>”或“=”下同)。
③反应过程中,两个容器温度:甲_______ 乙。
(4)乙容器中C点时,CO的物质的量百分数为_______ 。
 ),其反应的化学方程式为
),其反应的化学方程式为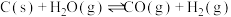 ,请回答下列问题:
,请回答下列问题:(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是_______。

| A.铝粉与氧化铁的反应 | B.氯化铵与 的反应 的反应 |
| C.锌片与稀硫酸的反应 | D.钠与冷水的反应 |
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是_______。
| A.充入He使容器压强增大,提高反应速率 |
B.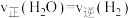 ,说明反应达到平衡状态 ,说明反应达到平衡状态 |
| C.容器中焦炭的质量不再变化,说明反应达到平衡状态 |
D.容器中水蒸气与氢气的体积比为 时,说明反应达到平衡状态 时,说明反应达到平衡状态 |
(3)在体积均为2L的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和2.8mol水蒸气,在不同温度下反应的过程如图所示:
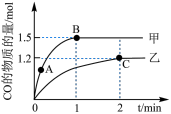
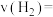
②甲容器中,
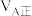
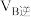 (填“<”“>”或“=”下同)。
(填“<”“>”或“=”下同)。③反应过程中,两个容器温度:甲
(4)乙容器中C点时,CO的物质的量百分数为
您最近半年使用:0次
2024-05-03更新
|
234次组卷
|
2卷引用:广东省东莞市东华高级中学2023-2024学年高一下学期前段考试化学试题
8 . 工业合成氨是人类科学技术的一项重大突破,选择高效催化剂实现降能提效是目前研究的重点。回答下列问题:
(1)合成氨反应为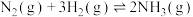
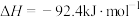 ,理论上
,理论上___________ (填“高”或“低”,下同)温有利于提高反应速率,___________ 温有利于提高平衡转化率。
(2)合成氨反应在催化作用的化学吸附及初步表面反应历程如下:
①写出 参与化学吸附的反应方程式:
参与化学吸附的反应方程式:___________ 。
②以上历程须克服的最大能垒为___________ eV。
(3)在t℃、压强为0.9MPa的条件下,向一恒压密闭容器中通入氢氮比为3的混合气体,体系中气体的含量与时间变化关系如图所示: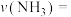
___________ 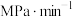 ,该反应的
,该反应的
___________ (用数字表达式表示, 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
②下列叙述能说明该条件下反应达到平衡状态的是___________ (填标号)。
a.氨气的体积分数保持不变 b.容器中氢氮比保持不变
c. 和
和 的平均反应速率之比为1∶2 d.气体密度保持不变
的平均反应速率之比为1∶2 d.气体密度保持不变
③若起始条件相同,在恒容容器中发生反应,则达到平衡时H2的含量符合图中___________ (填“d”“e”“f”或“g”)点。
(1)合成氨反应为
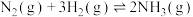
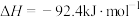 ,理论上
,理论上(2)合成氨反应在催化作用的化学吸附及初步表面反应历程如下:
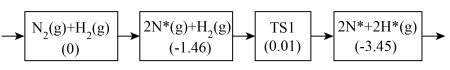
①写出
 参与化学吸附的反应方程式:
参与化学吸附的反应方程式:②以上历程须克服的最大能垒为
(3)在t℃、压强为0.9MPa的条件下,向一恒压密闭容器中通入氢氮比为3的混合气体,体系中气体的含量与时间变化关系如图所示:
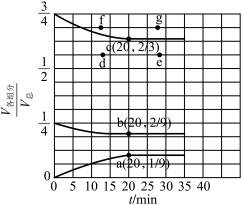
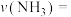
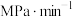 ,该反应的
,该反应的
 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。②下列叙述能说明该条件下反应达到平衡状态的是
a.氨气的体积分数保持不变 b.容器中氢氮比保持不变
c.
 和
和 的平均反应速率之比为1∶2 d.气体密度保持不变
的平均反应速率之比为1∶2 d.气体密度保持不变③若起始条件相同,在恒容容器中发生反应,则达到平衡时H2的含量符合图中
您最近半年使用:0次
解题方法
9 . 在相同条件下通入一定量X,研究催化剂对反应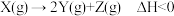 的影响,各物质浓度c随反应时间t的部分变化曲线如图。下列说法正确的是
的影响,各物质浓度c随反应时间t的部分变化曲线如图。下列说法正确的是
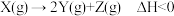 的影响,各物质浓度c随反应时间t的部分变化曲线如图。下列说法正确的是
的影响,各物质浓度c随反应时间t的部分变化曲线如图。下列说法正确的是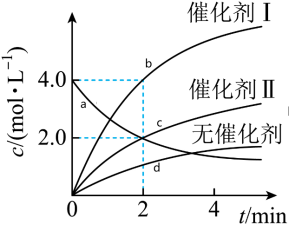
| A.无催化剂时,反应不能进行 |
| B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低 |
C.使用催化剂Ⅰ,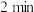 时, 时,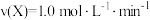 |
| D.c曲线可表示使用催化剂I时Z的浓度随t的变化 |
您最近半年使用:0次
解题方法
10 . 船舶柴油机发动机工作时,反应产生的 尾气是空气主要污染物之一,研究
尾气是空气主要污染物之一,研究 的转化方法和机理具有重要意义。
的转化方法和机理具有重要意义。
已知: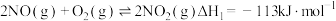 ;
; ;
;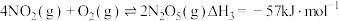
(1) 氧化脱除
氧化脱除 的总反应是
的总反应是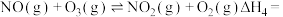
_______ 。
(2)该反应过程有两步: ,反应中各物质浓度变化如图所示。则速率常数
,反应中各物质浓度变化如图所示。则速率常数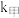
_______  (填“
(填“ ”、“
”、“ ”或“
”或“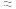 ”),原因是
”),原因是 _______ 。 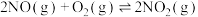 的反应历程分两步:
的反应历程分两步:
①则反应Ⅰ与反应Ⅱ的活化能:
_______ 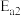 (填“
(填“ ”“
”“ ”或“
”或“ ”)。反应
”)。反应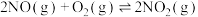 的平衡常数
的平衡常数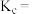
_______ (用 、
、 、
、 、
、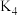 表示)。
表示)。
②在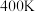 、初始压强为
、初始压强为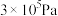 的恒温刚性容器(体积为VL)中,按
的恒温刚性容器(体积为VL)中,按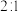 通入
通入 和
和 一定条件下发生反应。达平衡时
一定条件下发生反应。达平衡时 转化率为
转化率为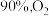 转化率为
转化率为
____________ 。
(4)某研究小组将 、
、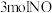 和一定量的
和一定量的 充入
充入 密闭容器中,在
密闭容器中,在 催化剂表面发生反应
催化剂表面发生反应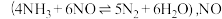 的转化率随温度的变化情况如图所示:
的转化率随温度的变化情况如图所示:  内温度从
内温度从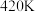 升高到
升高到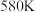 ,此时段内
,此时段内 的平均反应速率
的平均反应速率
_______ (保留 位有效数字)。
位有效数字)。
②无氧条件下, 生成
生成 的转化率较低,原因可能是
的转化率较低,原因可能是 _______ 。
 尾气是空气主要污染物之一,研究
尾气是空气主要污染物之一,研究 的转化方法和机理具有重要意义。
的转化方法和机理具有重要意义。 已知:
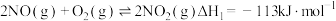 ;
; ;
;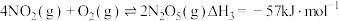
(1)
 氧化脱除
氧化脱除 的总反应是
的总反应是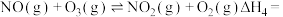
(2)该反应过程有两步:
 ,反应中各物质浓度变化如图所示。则速率常数
,反应中各物质浓度变化如图所示。则速率常数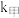
 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是 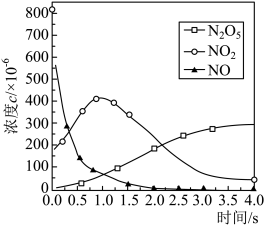
 的反应历程分两步:
的反应历程分两步: | 步骤 | 反应 | 活化能 | 正反应速率方程 | 逆反应速率方程 |
| Ⅰ |  (快) (快) |  | 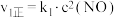 | 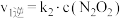 |
| Ⅱ | 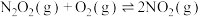 (慢) | 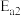 | 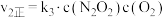 |  |

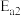 (填“
(填“ ”“
”“ ”或“
”或“ ”)。反应
”)。反应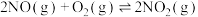 的平衡常数
的平衡常数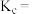
 、
、 、
、 、
、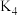 表示)。
表示)。 ②在
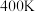 、初始压强为
、初始压强为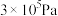 的恒温刚性容器(体积为VL)中,按
的恒温刚性容器(体积为VL)中,按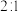 通入
通入 和
和 一定条件下发生反应。达平衡时
一定条件下发生反应。达平衡时 转化率为
转化率为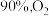 转化率为
转化率为
(4)某研究小组将
 、
、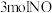 和一定量的
和一定量的 充入
充入 密闭容器中,在
密闭容器中,在 催化剂表面发生反应
催化剂表面发生反应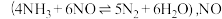 的转化率随温度的变化情况如图所示:
的转化率随温度的变化情况如图所示: 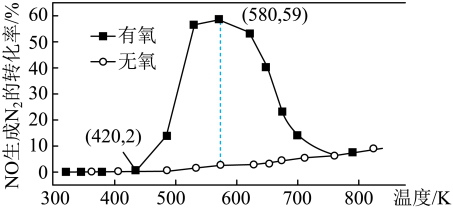
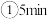 内温度从
内温度从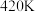 升高到
升高到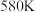 ,此时段内
,此时段内 的平均反应速率
的平均反应速率
 位有效数字)。
位有效数字)。 ②无氧条件下,
 生成
生成 的转化率较低,原因可能是
的转化率较低,原因可能是
您最近半年使用:0次



