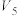名校
解题方法
1 . Ⅰ.铁是生产生活、科学研究中的重要物质,研究与Fe相关的反应时要关注反应的快慢和程度,某些有铁参与的反应可设计成原电池。
(1)以下是相同条件下,等体积等浓度的H2O2溶液分解的对比实验时,放出 O2的体积随时间的变化关系示意图(线a为使用FeCl3作催化剂,线b为不使用催化剂),其中正确的图像是______(填字母)。
Ⅱ.已知下列热化学为程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H1=﹣25 kJ·mol-1
②Fe2O3(s)+CO(g) = 2FeO(s)+CO2(g) △H2=﹣3 kJ·mol-1
(2)写出Fe被CO2氧化成FeO(s) 和 CO的热化学方程式_______ 。
一定温度下,向某密闭容器中加入足量铁并充入一定量的CO2气体,发生第(2)题的反应。反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。_____ v逆(CO2)(填“>”“<”或“=”)。
(4)0~4min内, CO的平均反应速率v(CO)=____ 。
(5)仅改变下列条件,化学反应速率减小的是___ (填字母)。
A.减少铁的质量 B.降低温度 C.保持压强不变,充入He使容器的体积增大
Ⅲ.某化学兴趣小组利用反应Cu + 2FeCl3 = CuCl2 + 2FeCl2,设计了如图所示的原电池装置。___ 极(填“正”或“负”),。
(7)写出b电极上的电极反应式______ 。
(1)以下是相同条件下,等体积等浓度的H2O2溶液分解的对比实验时,放出 O2的体积随时间的变化关系示意图(线a为使用FeCl3作催化剂,线b为不使用催化剂),其中正确的图像是______(填字母)。
A. | B.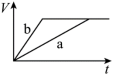 |
C.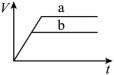 | D.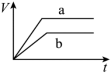 |
Ⅱ.已知下列热化学为程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H1=﹣25 kJ·mol-1
②Fe2O3(s)+CO(g) = 2FeO(s)+CO2(g) △H2=﹣3 kJ·mol-1
(2)写出Fe被CO2氧化成FeO(s) 和 CO的热化学方程式
一定温度下,向某密闭容器中加入足量铁并充入一定量的CO2气体,发生第(2)题的反应。反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
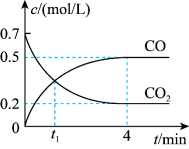
(4)0~4min内, CO的平均反应速率v(CO)=
(5)仅改变下列条件,化学反应速率减小的是
A.减少铁的质量 B.降低温度 C.保持压强不变,充入He使容器的体积增大
Ⅲ.某化学兴趣小组利用反应Cu + 2FeCl3 = CuCl2 + 2FeCl2,设计了如图所示的原电池装置。
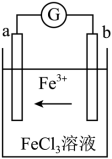
(7)写出b电极上的电极反应式
您最近一年使用:0次
名校
解题方法
2 . 某温度时,在容积为3 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由图中数据分析,下列结论正确的是

| A.该反应的化学方程式为2Z+Y = 3X |
| B.3min 时,正、逆反应都不再继续进行,反应达到化学平衡 |
| C.反应到3min时,容器中的反应完成程度达到了最大 |
| D.温度、体积不变,3min 时充入1 mol He使压强增大,正逆反应速率都增大 |
您最近一年使用:0次
名校
解题方法
3 . 化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①各时间段反应速率最大的是______________ (填“0~1”“1~2”“2~3”“3~4”或“4~5”)min,原因是______________________ ;
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率为__________ (设溶液体积不变)。
(2)另一学生为控制反应速率,防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是 (填字母)。
(3)已知硫代硫酸钠与稀硫酸反应生成S单质和 ,反应化学方程式为:
,反应化学方程式为:

某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
①该实验Ⅰ、Ⅱ可探究温度对反应速率的影响,因此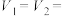
__________ ,
__________ 。
②若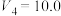 ,
, ,则实验①、③可探究
,则实验①、③可探究__________ 对反应速率的影响。
③可用热的NaOH浓溶液洗掉反应后试管中残余的固体。固体溶解时的离子方程式为______ 。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率为
(2)另一学生为控制反应速率,防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是 (填字母)。
| A.蒸馏水 | B.KCl溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
 ,反应化学方程式为:
,反应化学方程式为:
某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度/℃ |
| 稀 |
| ||
V/mL | c(mol/L) | V/mL | c(mol/L) | V/mL | ||
Ⅰ | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
Ⅱ | 40 |
| 0.10 |
| 0.50 |
|
Ⅲ | 20 |
| 0.10 | 4.0 | 0.50 |
|
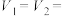

②若
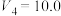 ,
, ,则实验①、③可探究
,则实验①、③可探究③可用热的NaOH浓溶液洗掉反应后试管中残余的固体。固体溶解时的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 以分子中只含一个碳原子的化合物为原料,用化工方法制造产品的化学体系总称为“一碳化学”。回答下列问题:
(1)CO(g)与H2O(g)在恒容密闭容器中反应:CO(g)+H2O(g) CO2(g)+H2(g)。
CO2(g)+H2(g)。
①该反应的氧化剂是_______ (填化学式)。
②下列说法正确的是_______ (填字母)。
A.升高反应温度,可使CO完全转化
B.充入He,可加快反应速率
C.反应达到平衡后,反应速率为零
D.使用合适催化剂可以加快反应速率
③下列描述中能说明该反应达到平衡状态的是_______ 。
A.CO、H2和CO2三种物质的浓度相等
B.混合气体的密度不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗2molH2的同时消耗2molCO
(2)在容积为2L的恒温密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。反应过程中测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。
CH3OH(g)+H2O(g)。反应过程中测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。
①3~6min内,v(H2)=_______ 。
②第3min时
_______ 第9min时 (填“>”、“<”或“=”),第12min时,
(填“>”、“<”或“=”),第12min时,
_______  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
③求12min末时,混合气体中CH3OH的物质的量分数__________ 。(写出计算过程,要求列出三段式)【已知:B的物质的量分数=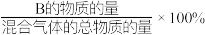 】
】
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为CH3OH+8OH﹣﹣6e﹣= +6H2O。则下列说法正确的是
+6H2O。则下列说法正确的是_______ (填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子
(1)CO(g)与H2O(g)在恒容密闭容器中反应:CO(g)+H2O(g)
 CO2(g)+H2(g)。
CO2(g)+H2(g)。①该反应的氧化剂是
②下列说法正确的是
A.升高反应温度,可使CO完全转化
B.充入He,可加快反应速率
C.反应达到平衡后,反应速率为零
D.使用合适催化剂可以加快反应速率
③下列描述中能说明该反应达到平衡状态的是
A.CO、H2和CO2三种物质的浓度相等
B.混合气体的密度不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗2molH2的同时消耗2molCO
(2)在容积为2L的恒温密闭容器中,充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。反应过程中测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。
CH3OH(g)+H2O(g)。反应过程中测得CO2和CH3OH(g)的物质的量随时间的变化情况如下表。| 时间 | 0min | 3min | 6min | 9min | 12min |
| n(CH3OH)/mol | 0 | 0.50 | a | 0.75 | 0.75 |
| n(CO2)/mol | 1 | 0.50 | 0.35 | 0.25 | 0.25 |
②第3min时

 (填“>”、“<”或“=”),第12min时,
(填“>”、“<”或“=”),第12min时,
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)③求12min末时,混合气体中CH3OH的物质的量分数
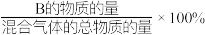 】
】(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为CH3OH+8OH﹣﹣6e﹣=
 +6H2O。则下列说法正确的是
+6H2O。则下列说法正确的是①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子
您最近一年使用:0次
名校
解题方法
5 . 工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为 和
和 ),其反应的化学方程式为
),其反应的化学方程式为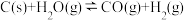 ,请回答下列问题:
,请回答下列问题:
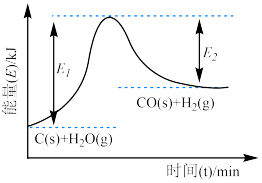
(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是__________。
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是__________。
(3)在体积均为 的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和
的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和 水蒸气,在不同温度下反应的过程如下图所示:
水蒸气,在不同温度下反应的过程如下图所示: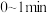 内的平均反应速率
内的平均反应速率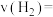
________ 。
②甲容器中,A点正反应速率__________ B点的逆反应速率(填“<”“>”或“=”)。
③反应过程中,两个容器温度:甲__________ 乙(填“<” “>”或“=”)。
④乙容器中C点时, 的物质的量百分数为
的物质的量百分数为__________ 。
(4)在 溶液条件下,以
溶液条件下,以 为原料,可制成一种燃料电池,写出该电池的负极反应式
为原料,可制成一种燃料电池,写出该电池的负极反应式____________________ ,当燃料电池消耗 (标况下)时,正极上有
(标况下)时,正极上有_________ 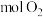 参与反应。
参与反应。
 和
和 ),其反应的化学方程式为
),其反应的化学方程式为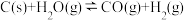 ,请回答下列问题:
,请回答下列问题:(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是__________。
| A.铝粉与氧化铁的反应 | B.氯化铵与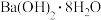 的反应 的反应 |
| C.锌片与稀硫酸的反应 | D.钠与冷水的反应 |
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是__________。
A.充入 使容器压强增大,提高反应速率 使容器压强增大,提高反应速率 |
B.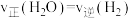 ,说明反应达到平衡状态 ,说明反应达到平衡状态 |
| C.容器中焦炭的质量不再变化,说明反应达到平衡状态 |
D.容器中水蒸气与氢气的体积比为 时,说明反应达到平衡状态 时,说明反应达到平衡状态 |
(3)在体积均为
 的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和
的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和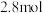 水蒸气,在不同温度下反应的过程如下图所示:
水蒸气,在不同温度下反应的过程如下图所示: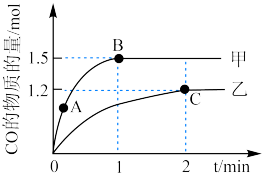
 内的平均反应速率
内的平均反应速率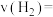
②甲容器中,A点正反应速率
③反应过程中,两个容器温度:甲
④乙容器中C点时,
 的物质的量百分数为
的物质的量百分数为(4)在
 溶液条件下,以
溶液条件下,以 为原料,可制成一种燃料电池,写出该电池的负极反应式
为原料,可制成一种燃料电池,写出该电池的负极反应式 (标况下)时,正极上有
(标况下)时,正极上有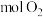 参与反应。
参与反应。
您最近一年使用:0次
2024-04-10更新
|
449次组卷
|
3卷引用:广东省江门市培英高级中学2023-2024学年高一下学期期中考试化学试题
名校
解题方法
6 . 反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2⇌2HCl的反应速率v=kc(H2)mc(Cl2)n,式中k为常数,m、n值可用下表中数据确定。由此可推得的m、n值正确的是
| c(H2)(mol·L-1) | c(Cl2)(mol·L-1) | v(mol·L-1·s-1) |
| 1.0 | 1.0 | 1.0 k |
| 2.0 | 1.0 | 2.0 k |
| 2.0 | 4.0 | 4.0 k |
| A.m=1,n=1 | B.m= ,n= ,n= |
C.m= ,n=1 ,n=1 | D.m=1,n= |
您最近一年使用:0次
名校
解题方法
7 . 对可逆反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),下列叙述不正确的是
| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成xmolNO的同时,生成xmolNH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器的容积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率关系:3v正(NH3)=2v逆(H2O) |
您最近一年使用:0次
名校
解题方法
8 . 反应A(g)+3B(g)⇌2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是
| A.v(A)=0.15mol•L-1•min-1 | B.v(B)=0.01mol•L-1•s-1 |
| C.v(C)=0.0075mol•L-1•s-1 | D.v(D)=0.40mol•L-1•min-1 |
您最近一年使用:0次
9 . “碳中和”是国家战略,其目的是实现 的排放量和利用量达到相等,将
的排放量和利用量达到相等,将 资源化是实现“碳中和”目标的重要手段.回答下列问题:
资源化是实现“碳中和”目标的重要手段.回答下列问题:
(1)下列措施有利于“碳中和”的是_______________(填标号)。
(2) 和
和 在催化剂作用下发生反应可合成清洁能源甲醇:
在催化剂作用下发生反应可合成清洁能源甲醇:

①已知该反应的正反应率 (
( 为正反应的速率常数),某温度时测得数据如表中所示.则此温度下表中
为正反应的速率常数),某温度时测得数据如表中所示.则此温度下表中
_______________ 。
②在一定条件下,体系中 的平衡转化率
的平衡转化率 与
与 和
和 的关系如图所示,
的关系如图所示, 和
和 分别表示温度或压强.
分别表示温度或压强. 表示的物理量是
表示的物理量是_______________ (填“温度”或“压强”),
_______________  (填“>”或“<”)。
(填“>”或“<”)。

③为探究该反应原理,进行如下实验:在一恒温,体积为 恒容密闭容器中,充入
恒容密闭容器中,充入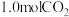 和
和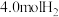 ,进行该反应(不考虑其它副反应),平衡时测得
,进行该反应(不考虑其它副反应),平衡时测得 的物质的量为
的物质的量为 .则该温度下平衡常数
.则该温度下平衡常数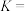
_______________ (保留2位有效数字)。
(3)若 和
和 按一定比例反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示.当温度为
按一定比例反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示.当温度为 时,图中
时,图中 点
点_______________ (填“是”或“不是”)处于平衡状态.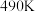 之后,甲醇产率下降,请分析其变化产生可能的原因:
之后,甲醇产率下降,请分析其变化产生可能的原因:_______________ 。(写出其中一种)。

(4) 是一种廉价的碳资源,其综合利用具有重要意义.
是一种廉价的碳资源,其综合利用具有重要意义. 可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在
可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在_______________ 极,该电极反应式是:_______________ 。
 的排放量和利用量达到相等,将
的排放量和利用量达到相等,将 资源化是实现“碳中和”目标的重要手段.回答下列问题:
资源化是实现“碳中和”目标的重要手段.回答下列问题:(1)下列措施有利于“碳中和”的是_______________(填标号)。
| A.植树造林,发展绿色经济 | B.通过裂化将重油转化为汽油 |
C.在燃煤中添加 或 或 | D.大力开采和使用可燃冰 |
(2)
 和
和 在催化剂作用下发生反应可合成清洁能源甲醇:
在催化剂作用下发生反应可合成清洁能源甲醇:
①已知该反应的正反应率
 (
( 为正反应的速率常数),某温度时测得数据如表中所示.则此温度下表中
为正反应的速率常数),某温度时测得数据如表中所示.则此温度下表中
 |  |  | |
| 1 | 0.02 | 0.01 |  |
| 2 | 0.04 | 0.01 |  |
 的平衡转化率
的平衡转化率 与
与 和
和 的关系如图所示,
的关系如图所示, 和
和 分别表示温度或压强.
分别表示温度或压强. 表示的物理量是
表示的物理量是
 (填“>”或“<”)。
(填“>”或“<”)。
③为探究该反应原理,进行如下实验:在一恒温,体积为
 恒容密闭容器中,充入
恒容密闭容器中,充入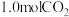 和
和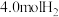 ,进行该反应(不考虑其它副反应),平衡时测得
,进行该反应(不考虑其它副反应),平衡时测得 的物质的量为
的物质的量为 .则该温度下平衡常数
.则该温度下平衡常数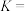
(3)若
 和
和 按一定比例反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示.当温度为
按一定比例反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示.当温度为 时,图中
时,图中 点
点 之后,甲醇产率下降,请分析其变化产生可能的原因:
之后,甲醇产率下降,请分析其变化产生可能的原因:
(4)
 是一种廉价的碳资源,其综合利用具有重要意义.
是一种廉价的碳资源,其综合利用具有重要意义. 可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在
可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在
您最近一年使用:0次
名校
解题方法
10 . CO和NO都是有毒气体,但新的研究表明,它们都是生命体系气体信号分子,在人体内具有重要的生理作用,H2是高中阶段常见的气体。回答下列问题:
(1)反应2NO(g)+2H2(g)⇌N2(g)+2H2O(g) △H=-664kJ/mol是联合硝酸工业减少污染物排放的重要反应。该反应分为三步完成(都是双分子反应,即反应物都只有两种分子),前两步反应如下:
第1步:2NO(g)⇌N2O2(g)△H=-103kJ/mol
第2步:N2O2(g)+H2(g)⇌N2O(g)+H2O(g)△H=-17kJ/mol
①写出第3步反应的热化学方程式:_______ 。
②基元反应mA(g)+nB(g)⇌pC(g)+qD(g),正反应速率υ正=κcm(A)•cn(B)。
2NO(g)+2H2(g)⇌N2(g)+2H2O(g)的正反应速率υ正=k1c2(NO),总反应速率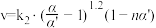 ,α是平衡转化率,α′是瞬时转化率,k、k1、k2均为速率常数,受温度影响,温度升高,速率常数增大。
,α是平衡转化率,α′是瞬时转化率,k、k1、k2均为速率常数,受温度影响,温度升高,速率常数增大。
Ⅰ.复杂反应分为多步进行时,决定反应速率的是最_______ (填“快”或“慢”)的一步,3步基元反应中,活化能最高的一步是第_______ 步。
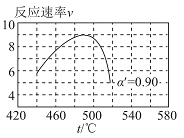
Ⅱ.温度升高,α_______ (填“变大”、“变小”或“不变”),在α′=0.90时,一系列温度下的总反应速率—时间(υ-t)曲线如图所示,分析图中曲线先升后降的原因:_______ 。
(2)用FeO冶炼Fe的过程涉及如下反应:
反应Ⅰ:FeO(s)+CO(g)⇌Fe(s)+CO2(g)
反应Ⅱ:FeO(s)+C(s)⇌Fe(s)+CO(g)
①将FeO和CO放入恒容密闭容器中,下列事实能说明反应Ⅰ和Ⅱ均已达到平衡状态的是_______ (填选项字母)。
A.容器内气体的密度不再发生变化 B. CO的生成速率等于消耗速率。
C.容器内气体总压强不再发生变化 D. 容器内CO和CO2的物质的量相等
②在一个体积可变的容器中,维持温度1200K不变(此时反应Ⅰ的分压平衡常数KP1=1.00)。压缩容器体积,达到新平衡时,CO的分压_______ (填“变大”、“变小”或“不变”)。
(1)反应2NO(g)+2H2(g)⇌N2(g)+2H2O(g) △H=-664kJ/mol是联合硝酸工业减少污染物排放的重要反应。该反应分为三步完成(都是双分子反应,即反应物都只有两种分子),前两步反应如下:
第1步:2NO(g)⇌N2O2(g)△H=-103kJ/mol
第2步:N2O2(g)+H2(g)⇌N2O(g)+H2O(g)△H=-17kJ/mol
①写出第3步反应的热化学方程式:
②基元反应mA(g)+nB(g)⇌pC(g)+qD(g),正反应速率υ正=κcm(A)•cn(B)。
2NO(g)+2H2(g)⇌N2(g)+2H2O(g)的正反应速率υ正=k1c2(NO),总反应速率
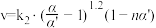 ,α是平衡转化率,α′是瞬时转化率,k、k1、k2均为速率常数,受温度影响,温度升高,速率常数增大。
,α是平衡转化率,α′是瞬时转化率,k、k1、k2均为速率常数,受温度影响,温度升高,速率常数增大。Ⅰ.复杂反应分为多步进行时,决定反应速率的是最
Ⅱ.温度升高,α

(2)用FeO冶炼Fe的过程涉及如下反应:
反应Ⅰ:FeO(s)+CO(g)⇌Fe(s)+CO2(g)
反应Ⅱ:FeO(s)+C(s)⇌Fe(s)+CO(g)
①将FeO和CO放入恒容密闭容器中,下列事实能说明反应Ⅰ和Ⅱ均已达到平衡状态的是
A.容器内气体的密度不再发生变化 B. CO的生成速率等于消耗速率。
C.容器内气体总压强不再发生变化 D. 容器内CO和CO2的物质的量相等
②在一个体积可变的容器中,维持温度1200K不变(此时反应Ⅰ的分压平衡常数KP1=1.00)。压缩容器体积,达到新平衡时,CO的分压
您最近一年使用:0次

 溶液
溶液