名校
解题方法
1 . 在2L恒容密闭容器中,800℃时,反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表所示。
2NO2(g)体系中,n(NO)随时间的变化如表所示。

(1)图中,A点处v正___________ v逆(填“大于”“小于”或“等于”)。
(2)图中表示NO2变化的曲线是___________ 。用NO表示从0~2s内该反应的平均速率v=___________ 。
(3)下列能说明该反应已经达到平衡状态的是___________ (填字母,下同)。
a.v(NO2)=2v(O2) b.容器内颜色保持不变
c.v逆(NO)=2v正(O2) d.消耗1molO2同时生成2molNO2
(4)下列能使该反应的反应速率增大的是___________ 。
a.及时分离出NO2气体 b.适当升高温度 c.选择高效的催化剂
(5)氢氧燃料电池是符合绿色化学理念的新型发电装置,如图电池正极通入的是:___________ (填“H2”或“O2”),其电极反应式为___________ 。

 2NO2(g)体系中,n(NO)随时间的变化如表所示。
2NO2(g)体系中,n(NO)随时间的变化如表所示。| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(1)图中,A点处v正
(2)图中表示NO2变化的曲线是
(3)下列能说明该反应已经达到平衡状态的是
a.v(NO2)=2v(O2) b.容器内颜色保持不变
c.v逆(NO)=2v正(O2) d.消耗1molO2同时生成2molNO2
(4)下列能使该反应的反应速率增大的是
a.及时分离出NO2气体 b.适当升高温度 c.选择高效的催化剂
(5)氢氧燃料电池是符合绿色化学理念的新型发电装置,如图电池正极通入的是:

您最近一年使用:0次
2023-07-14更新
|
223次组卷
|
2卷引用:广东省河源市龙川县第一中学2022-2023学年高一下学期7月期末考试化学试题
名校
2 . 在一定条件下,向 密闭容器中进行一定量
密闭容器中进行一定量 和
和 的反应:
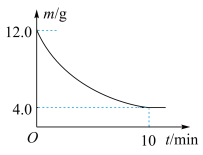
的反应: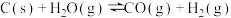 ,反应时间与残留固体质量的关系如图所示。下列说法正确的是
,反应时间与残留固体质量的关系如图所示。下列说法正确的是
 密闭容器中进行一定量
密闭容器中进行一定量 和
和 的反应:
的反应: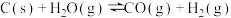 ,反应时间与残留固体质量的关系如图所示。下列说法正确的是
,反应时间与残留固体质量的关系如图所示。下列说法正确的是
| A.升高温度时,正反应速率增大,逆反应速率减小 |
B. 末时, 末时, |
C.增加 的质量时,正反应速率将增大 的质量时,正反应速率将增大 |
| D.随着反应的进行,达到平衡状态前,混合气体的压强一直增大 |
您最近一年使用:0次
2023-05-01更新
|
354次组卷
|
3卷引用:广东省河源市龙川县第一中学2022-2023学年高一下学期7月期末考试化学试题
广东省河源市龙川县第一中学2022-2023学年高一下学期7月期末考试化学试题(已下线)广东省深圳市龙岗区龙城高级中学、深圳市第二高级中学2022-2023学年高一下学期期中联考化学试题云南省保山市高(完)中C、D类学校2022-2023学年高二下学期6月份联考化学试题
名校
解题方法
3 . 用下列装置不能达到实验目的的是
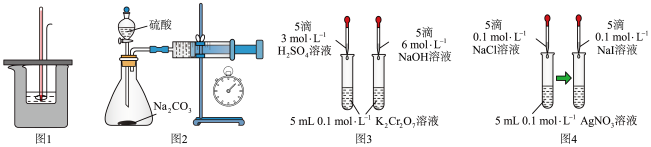

| A.图1:测量强酸强碱中和反应的反应热 |
B.图2:测定 和稀硫酸反应的速率 和稀硫酸反应的速率 |
| C.图3:验证浓度对化学平衡的影响 |
D.图4:证明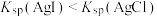 |
您最近一年使用:0次
2023-01-14更新
|
353次组卷
|
3卷引用:广东省河源市龙川县第一中学2022-2023学年高二上学期期末考试化学试题
名校
4 . 在一定条件下发生反应:2A(g)=2B(g)+C(g),将2molA通入2L容积恒定的密闭容器中,若维持容器内温度不变,5min末测得A的物质的量为0.8mol。用B的浓度变化来表示该反应的速率[mol·(L·min)-1]为
| A.0.24 | B.0.08 | C.0.06 | D.0.12 |
您最近一年使用:0次
2022-01-15更新
|
518次组卷
|
8卷引用:广东省河源市龙川县第一中学2023-2024学年高二上学期11月期中化学试题
广东省河源市龙川县第一中学2023-2024学年高二上学期11月期中化学试题北京市海淀区2021~2022学年高二上学期期末化学试题(已下线)2.1.1 化学反应速率-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)北京市丰台区2023-2024学年高二上学期期中联考(B卷)化学试题北京市第九十六中学2022-2023学年高二上学期期中考试化学试题北京市第十五中学2022-2023学年高二上学期期中考试 化学试题北京市第一六一中学2023-2024学年高二上学期10月月考化学试题北京市北京师范大学附属中学平谷第一分校2023-2024学年高二上学期期中考试化学试题
解题方法
5 . 温度为500℃时,反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g)在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率
4NO(g)+6H2O(g)在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率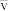 (x)为
(x)为
 4NO(g)+6H2O(g)在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率
4NO(g)+6H2O(g)在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率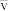 (x)为
(x)为A.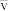 (O2)=0.01mol/(L•s) (O2)=0.01mol/(L•s) | B.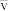 (NO)=0.08mol/(L•s) (NO)=0.08mol/(L•s) |
C.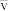 (H2O)=0.003mol/(L•s) (H2O)=0.003mol/(L•s) | D.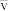 (NH3)=0.003mol/(L•s) (NH3)=0.003mol/(L•s) |
您最近一年使用:0次
2021-05-15更新
|
102次组卷
|
2卷引用:广东省连平县忠信中学2020-2021学年高一下学期第二次段考化学试题
6 . “绿水青山就是金山银山”,研究并消除氮氧化物污染对建设美丽家乡,打造宜居环境有重要意义。
(1)已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114kJ∙mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ∙mol-1
N2(g)+O2(g)=2NO(g) ΔH3=+181kJ∙mol-1
若某反应的平衡常数表达式为K=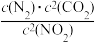 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___ 。
(2)T℃时,存在如下平衡:2NO2(g) N2O4(g)。该反应正逆反应速率与NO2、N2O4的浓度关系为:v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~lgc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
N2O4(g)。该反应正逆反应速率与NO2、N2O4的浓度关系为:v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~lgc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
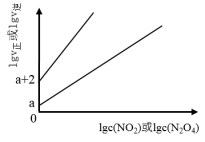
①T℃时,该反应的平衡常数K=___ 。
②T℃时,往刚性容器中充入一定量NO2,平衡后测得c(N2O4)为1.0mol/L,则平衡时NO2的物质的量分数为___ (以分数表示)。平衡后v正=__ (用含a的表达式表示)。
(3)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在t2时刻改变某一条件,其反应过程如图所示。
N2(g)+CO2(g)。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在t2时刻改变某一条件,其反应过程如图所示。

①则t2时刻改变的条件为__ 。
②t1时刻的v逆__ t2时刻的v正(填“>”“<”或“=”)。
(4)在恒容密闭容器中发生反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H<0。下列说法正确的是
CO(NH2)2(s)+H2O(g) △H<0。下列说法正确的是___ 。
A.及时分离出生成的尿素,有利于NH3的转化率增大
B.反应达到平衡后,混合气体的密度不再发生改变
C.反应在任何温度下都能自发进行
D.当尿素的质量不变时,说明反应达到平衡
(1)已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114kJ∙mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ∙mol-1
N2(g)+O2(g)=2NO(g) ΔH3=+181kJ∙mol-1
若某反应的平衡常数表达式为K=
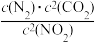 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(2)T℃时,存在如下平衡:2NO2(g)
 N2O4(g)。该反应正逆反应速率与NO2、N2O4的浓度关系为:v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~lgc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
N2O4(g)。该反应正逆反应速率与NO2、N2O4的浓度关系为:v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~lgc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
①T℃时,该反应的平衡常数K=
②T℃时,往刚性容器中充入一定量NO2,平衡后测得c(N2O4)为1.0mol/L,则平衡时NO2的物质的量分数为
(3)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在t2时刻改变某一条件,其反应过程如图所示。
N2(g)+CO2(g)。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在t2时刻改变某一条件,其反应过程如图所示。
①则t2时刻改变的条件为
②t1时刻的v逆
(4)在恒容密闭容器中发生反应2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) △H<0。下列说法正确的是
CO(NH2)2(s)+H2O(g) △H<0。下列说法正确的是A.及时分离出生成的尿素,有利于NH3的转化率增大
B.反应达到平衡后,混合气体的密度不再发生改变
C.反应在任何温度下都能自发进行
D.当尿素的质量不变时,说明反应达到平衡
您最近一年使用:0次
2021-02-23更新
|
895次组卷
|
8卷引用:广州大学附属东江中学2021届高三一模考试模拟测试化学试题
解题方法
7 . Ⅰ.影响化学反应速率的因素有多种,请在横线上填入与下列各项关系最为密切的影响化学反应速率的因素(填“温度”、“浓度”、“催化剂”、“压强”、“物质本身的性质”或“固体表面积”):
(1)夏天的食品易变霉,在冬天不易发生该现象:_______ 。
(2)同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢:_______ 。
(3)MnO2加入双氧水中放出气泡加快:__________ 。
Ⅱ.在一定温度下,4 L密闭容器内某一反应中气体M、气体N的物质的量浓度随时间变化的曲线如图所示。
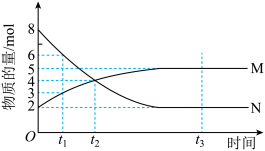
(1)比较t2时刻,正、逆反应速率大小:v(正)________ (填“>”“=”或“<”)v(逆)。
(2)若t2=2 min,反应开始至t2时刻,M的平均化学反应速率v(M)=______ mol·L-1·min-1。
(3)t1、t2、t3三个时刻中处于平衡状态的时刻为_________ (填“t1”“t2”或“t3”)。
(4)如果升高温度,则v(逆)________ (填“增大”“减小”或“不变”)。
(1)夏天的食品易变霉,在冬天不易发生该现象:
(2)同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢:
(3)MnO2加入双氧水中放出气泡加快:
Ⅱ.在一定温度下,4 L密闭容器内某一反应中气体M、气体N的物质的量浓度随时间变化的曲线如图所示。

(1)比较t2时刻,正、逆反应速率大小:v(正)
(2)若t2=2 min,反应开始至t2时刻,M的平均化学反应速率v(M)=
(3)t1、t2、t3三个时刻中处于平衡状态的时刻为
(4)如果升高温度,则v(逆)
您最近一年使用:0次
名校
解题方法
8 . 一定条件下反应2SO2(g)+O2(g) 2SO3(g)在恒容密闭容器中进行,从反应开始至10s时,O2的浓度减少了0.3mol·L-1。则0~10s内平均反应速率为
2SO3(g)在恒容密闭容器中进行,从反应开始至10s时,O2的浓度减少了0.3mol·L-1。则0~10s内平均反应速率为
 2SO3(g)在恒容密闭容器中进行,从反应开始至10s时,O2的浓度减少了0.3mol·L-1。则0~10s内平均反应速率为
2SO3(g)在恒容密闭容器中进行,从反应开始至10s时,O2的浓度减少了0.3mol·L-1。则0~10s内平均反应速率为| A.v(O2)=0.03mol·L-1·s-1 | B.v(O2)=0.3mol·L-1·s-1 |
| C.v(SO2)=0.03mol·L-1·s-1 | D.v(SO3)=0.03mol·L-1·s-1 |
您最近一年使用:0次
2020-06-13更新
|
417次组卷
|
9卷引用:广东省连平县忠信中学2020-2021学年高二下学期第二次段考化学试题
9 . I:已知:反应aA(g)+bB(g) ⇌cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
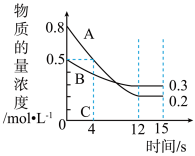
(1)经测定前4 s内v(C)=0.025 mol·L-1·s-1,则该反应的化学方程式为_______________ 。
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 0mol·L-1·s-1; 乙:v(B)=0.10 mol·L-1·s-1; 丙:v(C)=2.4mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______ (用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
(3)哪一时间段反应速率最大______ (填0~1、1~2、2~3、3~4、4~5、5~6 min,下同),原因是_____________ 。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________ (填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g) ⇌2HI(g)已达平衡状态的是________ 。
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)= v(HI)
v(HI)

(1)经测定前4 s内v(C)=0.025 mol·L-1·s-1,则该反应的化学方程式为
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 0mol·L-1·s-1; 乙:v(B)=0.10 mol·L-1·s-1; 丙:v(C)=2.4mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
| 时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
| 氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g) ⇌2HI(g)已达平衡状态的是
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=
 v(HI)
v(HI)
您最近一年使用:0次
名校
10 . 在5L的密闭容器中进行以下反应:4NH3+5O2=4NO+6H2O,半分钟后冷却至室温,测得NO的物质的量增加了0.3mol,则此反应的平均反应速率υ(X)为( )
| A.υ(H2O)=0.12mol·L-1·min-1 | B.υ(O2)=0.30mol·L-1·min-1 |
| C.υ(NO)=0.008mol·L-1·s-1 | D.υ(NH3)=0.002mol·L-1·s-1 |
您最近一年使用:0次
2019-06-22更新
|
178次组卷
|
2卷引用:广东省广州大学附属东江中学2018-2019学年高一下学期期末考试化学试题



