名校
1 . 一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质量的变化如图所示。下列推断合理的是
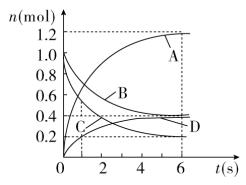
A.该反应的化学方程式为: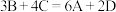 |
B.反应进行到1s时, |
| C.反应进行到6s时,B的平均反应速率为0.05 mol/(L·s) |
| D.反应进行到6s时,各物质的反应速率相等 |
您最近半年使用:0次
名校
2 . 某化学小组选用酸性高锰酸钾溶液和草酸( )溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:
)溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:
(1)实验原理的离子方程式:____________ 。
(2)实验2中的
______ ,目的是____________ 。
(3)根据上表中的实验数据,可以得到的结论是____________ 。
(4)利用实验1中数据计算,用 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为
______ mol/(L⋅min)。
 )溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:
)溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
a mol/L |
| 0.05 mol/L | 3 mol/L稀硫酸 | ||
1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
2 | 2.0 | v | 4.0 | 2.0 | 5.2 |
3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
(2)实验2中的

(3)根据上表中的实验数据,可以得到的结论是
(4)利用实验1中数据计算,用
 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为
您最近半年使用:0次
2024-05-04更新
|
147次组卷
|
2卷引用:北京交大附中2023-2024学年高一下学期期中考试化学试题
名校
解题方法
3 . 工业制硫酸的一步重要反应是SO2的催化氧化。在2L密闭容器中,充入SO2和足量O2,在催化剂、500℃的条件下发生反应。SO2、SO3的物质的量随时间的变化如图。下列说法不正确 的是
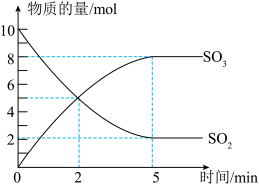
| A.在上述条件下,SO2不可能100%地转化为SO3 |
| B.反应到2min时,正逆反应速率相等 |
| C.反应开始至5min末,以SO2浓度的变化表示该反应的平均反应速率是0.8mol/(L·min) |
| D.使用催化剂是为了加快反应速率,提高生产效率 |
您最近半年使用:0次
2024-05-04更新
|
216次组卷
|
2卷引用:北京市陈经纶中学2023-2024学年高一下学期期中诊断化学试卷
2024·天津河北·一模
4 . 氢能的开发和利用是推动我国能源结构转型,保障国家能源安全,实现“碳达峰”、“碳中和”目标的重要途径。目前,我国已成为世界第一大产氢国,主要有三类工业制氢路线:
(1)化工燃料重整制氢
已知:
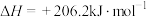

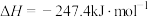
则 与
与 反应生成
反应生成 和
和 的反应热是
的反应热是___________  。
。
(2)工业副产氢
已知:工业上用水煤气法制氢气,有关化学方程式是:
反应一:

反应二:

①反应一在 时达到化学平衡状态,则此温度下该反应的平衡常数表达式
时达到化学平衡状态,则此温度下该反应的平衡常数表达式
___________ 。
②在 时将
时将 和
和 各
各 通入体积为
通入体积为 的密闭容器中反应发生反应二,
的密闭容器中反应发生反应二, 时达到平衡状态,该反应的平衡常数是9,则
时达到平衡状态,该反应的平衡常数是9,则 的转化率是
的转化率是___________ ,用 的浓度变化表示的反应速率
的浓度变化表示的反应速率 是
是___________  。
。
(3)清洁能源电解制氢
已知:利用电解饱和食盐水可制得氢气,下图为电解装置示意图: 电极是极
电极是极___________ (填“阴”或“阳”), 电极的电极反应式
电极的电极反应式___________ 。
②假设室温条件下电解 饱和食盐水一段时间,当两极产生的气体共
饱和食盐水一段时间,当两极产生的气体共 (标准状况下)时,溶液的
(标准状况下)时,溶液的 为
为___________ (溶液体积没有变化)。
(1)化工燃料重整制氢
已知:

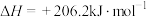

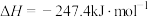
则
 与
与 反应生成
反应生成 和
和 的反应热是
的反应热是 。
。(2)工业副产氢
已知:工业上用水煤气法制氢气,有关化学方程式是:
反应一:


反应二:


①反应一在
 时达到化学平衡状态,则此温度下该反应的平衡常数表达式
时达到化学平衡状态,则此温度下该反应的平衡常数表达式
②在
 时将
时将 和
和 各
各 通入体积为
通入体积为 的密闭容器中反应发生反应二,
的密闭容器中反应发生反应二, 时达到平衡状态,该反应的平衡常数是9,则
时达到平衡状态,该反应的平衡常数是9,则 的转化率是
的转化率是 的浓度变化表示的反应速率
的浓度变化表示的反应速率 是
是 。
。(3)清洁能源电解制氢
已知:利用电解饱和食盐水可制得氢气,下图为电解装置示意图:

 电极是极
电极是极 电极的电极反应式
电极的电极反应式②假设室温条件下电解
 饱和食盐水一段时间,当两极产生的气体共
饱和食盐水一段时间,当两极产生的气体共 (标准状况下)时,溶液的
(标准状况下)时,溶液的 为
为
您最近半年使用:0次
5 . 工业上以1,4-丁二醇(BD)为原料催化脱氢制备γ-丁内酯(BL),其副反应产物为四氢呋喃( ,THF)、正丁醇(BuOH)以及其他四碳有机物。其他条件相同时,不同温度下,向1L容器中通入4×10-2molBD反应2h,测得BL、THF、BuOH在四碳有机产物中的物质的量分数如下:
,THF)、正丁醇(BuOH)以及其他四碳有机物。其他条件相同时,不同温度下,向1L容器中通入4×10-2molBD反应2h,测得BL、THF、BuOH在四碳有机产物中的物质的量分数如下:
| 温度/℃ | 220 | 240 | 250 | 255 |
| BL/% | 60.2 | 84.6 | 92.6 | 95.2 |
| THF/% | 1.2 | 1.8 | 1.9 | 2.1 |
| BuOH/% | 0.2 | 0.3 | 0.4 | 0.6 |
已知:HO(CH2)4OH(g,BD)
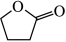 (g,BL)+2H2(g) ΔH>0
(g,BL)+2H2(g) ΔH>0
| A.220℃,2h时n(BL)=9.03×10-3mol,则BD的总转化率为37.5% |
| B.250℃,2h时n(BD)+n(BL)+n(THF)+n(BuOH)<4×10-2mol |
| C.255℃,2h时n(BL)=1.5×10-2mol,则0~2h内υ(H2)主反应=1.5×10-2mol·L−1·h−1 |
| D.由表中数据可知,220~255℃,催化剂活性、选择性均随着温度的升高而提高 |
您最近半年使用:0次
名校
6 . 研究化学反应的能量变化和速率变化是研究化学反应的重要角度。
(1)化学反应中能量变化的主要原因是___________ 。
(2)由天然气和水反应制备氢气: ,该反应过程中能量变化如下图所示,则该反应为
,该反应过程中能量变化如下图所示,则该反应为___________ (填“吸热”或“放热”)反应。已知破坏1 mol化学键需要吸收的热量如表所示,则该反应吸收或放出的热量为___________ kJ(用含a、b、c、d的代数式表示)。
(3)某兴趣小组将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是___________。
(4)在容积不变的10 L密闭容器中进行如下反应: ,开始时A的物质的量为3 mol B的物质的量为5 mol;5 min末测得C的物质的量为3 mol,用D表示的化学反应速率
,开始时A的物质的量为3 mol B的物质的量为5 mol;5 min末测得C的物质的量为3 mol,用D表示的化学反应速率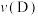 为0.02 mol/(L·min)。
为0.02 mol/(L·min)。
①5 min末A的物质的量浓度为___________ 。
②前5 min内用B表示的化学反应速率 为
为___________
③化学方程式中n的值为___________ 。
(1)化学反应中能量变化的主要原因是
(2)由天然气和水反应制备氢气:
 ,该反应过程中能量变化如下图所示,则该反应为
,该反应过程中能量变化如下图所示,则该反应为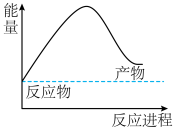
| 化学键 |  |  |  |  |
| 吸收热量(kJ/mol) | a | b | c | d |
(3)某兴趣小组将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是___________。
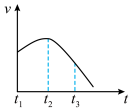
A.从 的原因是镁与酸的反应是放热反应,体系温度升高 的原因是镁与酸的反应是放热反应,体系温度升高 |
B.从 的原因水蒸发,致使酸的浓度升高 的原因水蒸发,致使酸的浓度升高 |
C.从 的原因是随着反应的进行镁条的质量下降 的原因是随着反应的进行镁条的质量下降 |
D.从 的原因是随着反应的进行, 的原因是随着反应的进行, 的浓度逐渐下降 的浓度逐渐下降 |
(4)在容积不变的10 L密闭容器中进行如下反应:
 ,开始时A的物质的量为3 mol B的物质的量为5 mol;5 min末测得C的物质的量为3 mol,用D表示的化学反应速率
,开始时A的物质的量为3 mol B的物质的量为5 mol;5 min末测得C的物质的量为3 mol,用D表示的化学反应速率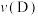 为0.02 mol/(L·min)。
为0.02 mol/(L·min)。①5 min末A的物质的量浓度为
②前5 min内用B表示的化学反应速率
 为
为③化学方程式中n的值为
您最近半年使用:0次
解题方法
7 . 大气中 含量的控制和
含量的控制和 资源化利用具有重要意义。
资源化利用具有重要意义。
(1) 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:
Ⅰ: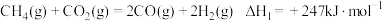
Ⅱ: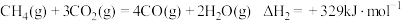
反应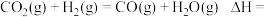
___________
(2)工业上可利用 制备
制备 :
:
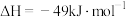
① 时,该反应的平衡常数
时,该反应的平衡常数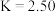 ,该温度下某时刻测得体系内四种物质的浓度均为
,该温度下某时刻测得体系内四种物质的浓度均为 ,则此时
,则此时
___________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②提高反应速率且增大 的平衡产率,可采取的措施
的平衡产率,可采取的措施___________ 。
A.升高反应温度
B.使用合适的催化剂
C.增大体系压强
D.从平衡体系中及时分离出
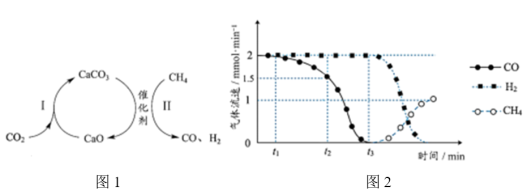
(3)一种捕获 并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以
并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的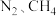 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳,推测发生了副反应(反应Ⅲ):
,在催化剂上有积碳,推测发生了副反应(反应Ⅲ): 。
。___________ 。
② 时间段内,反应Ⅱ速率减小至0的原因
时间段内,反应Ⅱ速率减小至0的原因___________ 。
③ 时刻,反应II和反应Ⅲ生成
时刻,反应II和反应Ⅲ生成 的速率之比为
的速率之比为___________ 。
(4)在铜基配合物的催化作用下,利用电化学原理可将 转化为碳基燃料(包括
转化为碳基燃料(包括 、烷烃和羧酸等),其装置原理如图所示。
、烷烃和羧酸等),其装置原理如图所示。___________ 。
②当有 通过质子交换膜时,理论上最多生成
通过质子交换膜时,理论上最多生成 的质量为
的质量为___________ 。
 含量的控制和
含量的控制和 资源化利用具有重要意义。
资源化利用具有重要意义。(1)
 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:Ⅰ:
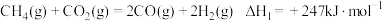
Ⅱ:
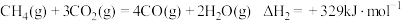
反应
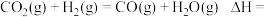
(2)工业上可利用
 制备
制备 :
:
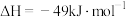
①
 时,该反应的平衡常数
时,该反应的平衡常数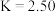 ,该温度下某时刻测得体系内四种物质的浓度均为
,该温度下某时刻测得体系内四种物质的浓度均为 ,则此时
,则此时
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②提高反应速率且增大
 的平衡产率,可采取的措施
的平衡产率,可采取的措施A.升高反应温度
B.使用合适的催化剂
C.增大体系压强
D.从平衡体系中及时分离出

(3)一种捕获
 并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以
并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的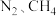 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳,推测发生了副反应(反应Ⅲ):
,在催化剂上有积碳,推测发生了副反应(反应Ⅲ): 。
。
②
 时间段内,反应Ⅱ速率减小至0的原因
时间段内,反应Ⅱ速率减小至0的原因③
 时刻,反应II和反应Ⅲ生成
时刻,反应II和反应Ⅲ生成 的速率之比为
的速率之比为(4)在铜基配合物的催化作用下,利用电化学原理可将
 转化为碳基燃料(包括
转化为碳基燃料(包括 、烷烃和羧酸等),其装置原理如图所示。
、烷烃和羧酸等),其装置原理如图所示。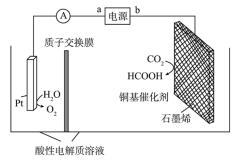
②当有
 通过质子交换膜时,理论上最多生成
通过质子交换膜时,理论上最多生成 的质量为
的质量为
您最近半年使用:0次
解题方法
8 . AOPs(高级氧化技术)通过产生·OH(羟基自由基)能有效去除废水中有机污染物。
I.芬顿反应是AOPs中使用最广泛的方法,主要反应过程如下:
i.Fe2+ + H2O2 + H+ =Fe3+ + ·OH + H2O (快反应)
ii.·OH + OM → CO2 + H2O(快反应,OM为有机物)
iii.2Fe3+ + H2O2 =2Fe2+ + O2 + 2H+(慢反应)
反应过程中存在副反应:·OH + Fe2+ + H+ = Fe3+ + H2O。
(1)决定芬顿反应速率的是过程___________ (填“i”“ii”或“iii”)。
(2)·OH氧化苯酚的化学方程式为___________ 。
II.用铁粉代替Fe2+,并加入硼(B),可加快Fe3+转化为Fe2+,提高有机污染物的去除率。
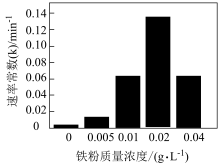
(3)①B与Fe3+反应生成硼酸(H3BO3)的离子方程式为___________ 。
②相同时间内,铁粉投加量与有机污染物去除率的关系如下图所示(k越大,去除效果越好)。铁粉质量浓度大于0.02 g ∙ L−1时,有机污染物去除率下降的原因可能是___________ 。
III.相比于传统的芬顿反应,电芬顿反应具有无需投加H2O2等优点。该方法是利用O2在电极放电生成H2O2,与加入的Fe2+构成芬顿体系,如图1所示。
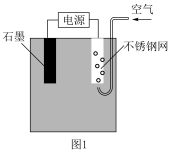
(4)石墨做___________ 极。
(5)溶液pH对H2O2生成量的影响如图2所示。
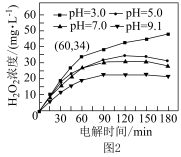
①pH=3,电解时间在0 ~ 60 min内,v(H2O2)=___________ mol·L-1·min-1。
②电解相同时间,随着溶液pH升高,生成的H2O2浓度逐渐减小,结合电极反应式分析原因___________ 。
I.芬顿反应是AOPs中使用最广泛的方法,主要反应过程如下:
i.Fe2+ + H2O2 + H+ =Fe3+ + ·OH + H2O (快反应)
ii.·OH + OM → CO2 + H2O(快反应,OM为有机物)
iii.2Fe3+ + H2O2 =2Fe2+ + O2 + 2H+(慢反应)
反应过程中存在副反应:·OH + Fe2+ + H+ = Fe3+ + H2O。
(1)决定芬顿反应速率的是过程
(2)·OH氧化苯酚的化学方程式为
II.用铁粉代替Fe2+,并加入硼(B),可加快Fe3+转化为Fe2+,提高有机污染物的去除率。
(3)①B与Fe3+反应生成硼酸(H3BO3)的离子方程式为
②相同时间内,铁粉投加量与有机污染物去除率的关系如下图所示(k越大,去除效果越好)。铁粉质量浓度大于0.02 g ∙ L−1时,有机污染物去除率下降的原因可能是

III.相比于传统的芬顿反应,电芬顿反应具有无需投加H2O2等优点。该方法是利用O2在电极放电生成H2O2,与加入的Fe2+构成芬顿体系,如图1所示。

(4)石墨做
(5)溶液pH对H2O2生成量的影响如图2所示。

①pH=3,电解时间在0 ~ 60 min内,v(H2O2)=
②电解相同时间,随着溶液pH升高,生成的H2O2浓度逐渐减小,结合电极反应式分析原因
您最近半年使用:0次
9 . 历史上诺贝尔化学奖曾经3次颁给研究合成氨的化学家。合成氨的原理为  。回答下列问题。
。回答下列问题。
(1)t℃时,向填充有催化剂、体积为2L 的刚性容器中充入一定量的 和N2合成氨,实验中测得 c(NH3)随时间的变化如表所示:
和N2合成氨,实验中测得 c(NH3)随时间的变化如表所示:
5~15min内 N2的平均反应速率  =
=___________ 
下列情况能说明反应达到平衡状态的是________ (填标号)。
A.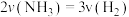 B. 混合气体的相对分子质量不再变化
B. 混合气体的相对分子质量不再变化
C. N2体积分数不再变化 D. 混合气体的密度保持不变
(2)如表列出了在不同温度和压强下,反应达到平衡时) 的百分含量
的百分含量  。
。
①从表中数据得出,最优的条件是___________ 。
②工业上通常选择在400~500℃和10~30MPa条件下合成氨, 原因是___________ 。
 。回答下列问题。
。回答下列问题。(1)t℃时,向填充有催化剂、体积为2L 的刚性容器中充入一定量的
 和N2合成氨,实验中测得 c(NH3)随时间的变化如表所示:
和N2合成氨,实验中测得 c(NH3)随时间的变化如表所示:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L⁻¹ | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 =
=
下列情况能说明反应达到平衡状态的是
A.
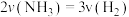 B. 混合气体的相对分子质量不再变化
B. 混合气体的相对分子质量不再变化C. N2体积分数不再变化 D. 混合气体的密度保持不变
(2)如表列出了在不同温度和压强下,反应达到平衡时)
 的百分含量
的百分含量  。
。压强/MPa 温度/℃ | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.5 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
②工业上通常选择在400~500℃和10~30MPa条件下合成氨, 原因是
您最近半年使用:0次
名校
解题方法
10 . 二氧化碳的捕集和转化是科学研究中的热点问题,我国科研人员提出了由 和
和 转化为
转化为 和
和 的反应历程,其示意图如图。
的反应历程,其示意图如图。
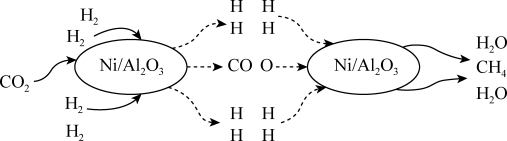
(1)根据信息可知该可逆反应的化学方程式为 ,催化剂
,催化剂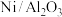
___________ (填“能”或“不能”) 提高平衡转化率。
提高平衡转化率。
(2)200℃下,在一密闭容器中充入一定量的 与
与 发生反应
发生反应 。一段时间后反应达平衡若其他条件不变,温度从200℃升至400℃,反应重新达到平衡时,
。一段时间后反应达平衡若其他条件不变,温度从200℃升至400℃,反应重新达到平衡时, 的体积分数增加。下列说法正确的是
的体积分数增加。下列说法正确的是___________ (填字母)。
a.该反应的 b.200℃下,减小
b.200℃下,减小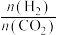 的值,
的值, 的平衡转化率升高
的平衡转化率升高
c.平衡常数大小:K(400℃)>K(200℃) d.反应达到平衡时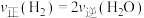
(3)一定条件下,反应体系中 平衡转化率
平衡转化率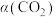 与L和X的关系如图所示,L和X表示温度或压强。
与L和X的关系如图所示,L和X表示温度或压强。
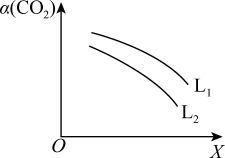
①L表示的物理量是___________ 。
②
___________  (填“<”或“>”),判断理由是
(填“<”或“>”),判断理由是___________ 。
(4)向1L恒容密闭容器中加入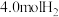 ,
,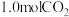 ,控制条件(催化剂、温度为
,控制条件(催化剂、温度为 )使之发生上述反应,测得容器内气体的压强随时间的变化如图所示:
)使之发生上述反应,测得容器内气体的压强随时间的变化如图所示:
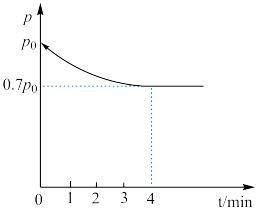
①求4min内 的反应速率
的反应速率
___________ 。
②此温度下,该反应的化学平衡常数
___________ 。
(5)下列情况,不能用勒夏特列原理解释的是___________ (填字母)。
a. 、
、 、HI平衡混合气体加压后颜色变深
、HI平衡混合气体加压后颜色变深
b.夏天,打开冰镇啤酒瓶,立即冒出大量泡沫
c.生活中,用饱和碳酸钠溶液洗去锅碗瓢盆上的油污,且热溶液的效果更好
d.在醋酸溶液中,加入一些醋酸钠固体使溶液的pH增大
 和
和 转化为
转化为 和
和 的反应历程,其示意图如图。
的反应历程,其示意图如图。
(1)根据信息可知该可逆反应的化学方程式为
 ,催化剂
,催化剂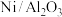
 提高平衡转化率。
提高平衡转化率。(2)200℃下,在一密闭容器中充入一定量的
 与
与 发生反应
发生反应 。一段时间后反应达平衡若其他条件不变,温度从200℃升至400℃,反应重新达到平衡时,
。一段时间后反应达平衡若其他条件不变,温度从200℃升至400℃,反应重新达到平衡时, 的体积分数增加。下列说法正确的是
的体积分数增加。下列说法正确的是a.该反应的
 b.200℃下,减小
b.200℃下,减小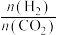 的值,
的值, 的平衡转化率升高
的平衡转化率升高c.平衡常数大小:K(400℃)>K(200℃) d.反应达到平衡时
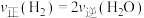
(3)一定条件下,反应体系中
 平衡转化率
平衡转化率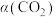 与L和X的关系如图所示,L和X表示温度或压强。
与L和X的关系如图所示,L和X表示温度或压强。
①L表示的物理量是
②

 (填“<”或“>”),判断理由是
(填“<”或“>”),判断理由是(4)向1L恒容密闭容器中加入
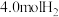 ,
,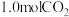 ,控制条件(催化剂、温度为
,控制条件(催化剂、温度为 )使之发生上述反应,测得容器内气体的压强随时间的变化如图所示:
)使之发生上述反应,测得容器内气体的压强随时间的变化如图所示:
①求4min内
 的反应速率
的反应速率②此温度下,该反应的化学平衡常数

(5)下列情况,不能用勒夏特列原理解释的是
a.
 、
、 、HI平衡混合气体加压后颜色变深
、HI平衡混合气体加压后颜色变深b.夏天,打开冰镇啤酒瓶,立即冒出大量泡沫
c.生活中,用饱和碳酸钠溶液洗去锅碗瓢盆上的油污,且热溶液的效果更好
d.在醋酸溶液中,加入一些醋酸钠固体使溶液的pH增大
您最近半年使用:0次




