1 . 在2L的密闭容器中通入 和
和 ,使其发生反应
,使其发生反应 。在10s内用
。在10s内用 的浓度变化表示的化学反应速率为
的浓度变化表示的化学反应速率为 ,则这10s内消耗的
,则这10s内消耗的 的物质的量是
的物质的量是
 和
和 ,使其发生反应
,使其发生反应 。在10s内用
。在10s内用 的浓度变化表示的化学反应速率为
的浓度变化表示的化学反应速率为 ,则这10s内消耗的
,则这10s内消耗的 的物质的量是
的物质的量是| A.0.8mol | B.0.4mol | C.0.2mol | D.1.6mol |
您最近一年使用:0次
名校
解题方法
2 . 在 反应中,表示该反应速率最快的是
反应中,表示该反应速率最快的是
 反应中,表示该反应速率最快的是
反应中,表示该反应速率最快的是A.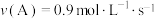 | B. |
C. | D. |
您最近一年使用:0次
名校
3 . 400℃时,向容积为1L的密闭容器中充入一定量的CO和H2,发生如下反应: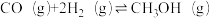 。反应过程中测得的部分数据见下表:
。反应过程中测得的部分数据见下表:
下列说法中,不正确的是
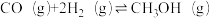 。反应过程中测得的部分数据见下表:
。反应过程中测得的部分数据见下表:| t/min | 0 | 10 | 20 | 30 |
| n(CO)/mol | 0.10 | 0.04 | 0.02 | |
| n(H2)/mol | 0.20 | 0.04 |
| A.反应在前10min内的平均速率为v(H2)=0.012 mol.L-1.min-1 |
| B.400°C时,该反应的平衡常数数值为2.5×103 |
| C.保持其他条件不变,升高温度,平衡时c(CH3OH)=0.06mol.L-1,则反应的△H<0 |
| D.400℃时,30分钟后再向容器中充入0.15 mol H2(g)和0.15 mol CH3OH(g),则平衡向正向移动,平衡常数增大。 |
您最近一年使用:0次
名校
4 . 已知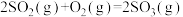
 ,在一定温度下在10 L容器中充入2 mol SO2和1 mol O2,反应2 min后达到平衡,压强变为原来的0.8,
,在一定温度下在10 L容器中充入2 mol SO2和1 mol O2,反应2 min后达到平衡,压强变为原来的0.8,
资料:容积和温度恒定时,气体压强与气体物质的量成正比;
(1)根据已知条件列出三段式__________ ;
(2)根据三段式可计算出:SO2的反应速率为___________  ,达到平衡时SO2的转化率为
,达到平衡时SO2的转化率为___________ ;该温度下反应的平衡常数为___________ 。
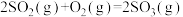
 ,在一定温度下在10 L容器中充入2 mol SO2和1 mol O2,反应2 min后达到平衡,压强变为原来的0.8,
,在一定温度下在10 L容器中充入2 mol SO2和1 mol O2,反应2 min后达到平衡,压强变为原来的0.8,资料:容积和温度恒定时,气体压强与气体物质的量成正比;

(1)根据已知条件列出三段式
(2)根据三段式可计算出:SO2的反应速率为
 ,达到平衡时SO2的转化率为
,达到平衡时SO2的转化率为
您最近一年使用:0次
名校
解题方法
5 . 对于反应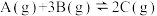 ,下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
,下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
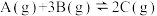 ,下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
,下列各数据表示不同条件下的反应速率,其中反应进行得最快的是A. | B. |
C. | D. |
您最近一年使用:0次
6 . 合成氨是人类科技发展史上的一项重大突破。
(1)在一定条件下,N2(g)和H2(g)反应生成0.2 molNH3(g),放出9.24kJ的热量。在下图中画出合成氨反应中用焓(H)变表示反应热的示意图________ 。

(2)将N2和H2通入体积为2L的恒温恒容密闭容器中,5min后达到化学平衡,测得NH3的浓度为0.2mol/L,这段时间内用N2的浓度变化表示的化学反应速率为______________ mol/(L.min)。
(3)理论上,为了增大平衡时H2的转化率,可采取的措施是______________ (写出一条)。
(4)下图是某压强下N2和H2按物质的量之比1:3投料进行反应,反应混合物中NH3的物质的量分数随温度的变化曲线。I是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线,下列说法正确的是______________ 。

a.图中a点,容器内n(N2):n(NH3)=1:4
b.图中b点,v正<v逆
c.400~530℃,Ⅱ中NH3的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
(1)在一定条件下,N2(g)和H2(g)反应生成0.2 molNH3(g),放出9.24kJ的热量。在下图中画出合成氨反应中用焓(H)变表示反应热的示意图

(2)将N2和H2通入体积为2L的恒温恒容密闭容器中,5min后达到化学平衡,测得NH3的浓度为0.2mol/L,这段时间内用N2的浓度变化表示的化学反应速率为
(3)理论上,为了增大平衡时H2的转化率,可采取的措施是
(4)下图是某压强下N2和H2按物质的量之比1:3投料进行反应,反应混合物中NH3的物质的量分数随温度的变化曲线。I是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线,下列说法正确的是

a.图中a点,容器内n(N2):n(NH3)=1:4
b.图中b点,v正<v逆
c.400~530℃,Ⅱ中NH3的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
您最近一年使用:0次
名校
7 . 某温度下,在容积为1L的密闭容器中充入1 mol CO2和3.25mol H2,发生反应: ,测得CH3OH(g)的物质的量随时间的变化如图所示。已知:此温度下该反应的平衡常数K=2.25。下列说法正确的是
,测得CH3OH(g)的物质的量随时间的变化如图所示。已知:此温度下该反应的平衡常数K=2.25。下列说法正确的是
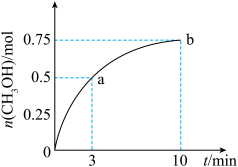
 ,测得CH3OH(g)的物质的量随时间的变化如图所示。已知:此温度下该反应的平衡常数K=2.25。下列说法正确的是
,测得CH3OH(g)的物质的量随时间的变化如图所示。已知:此温度下该反应的平衡常数K=2.25。下列说法正确的是
| A.点b所对应的状态为化学平衡状态 |
| B.0~10min,v(H2)=0.075mol·L-1·min-1 |
| C.点a时c(CO2)=0.25mol·L-1 |
D.欲增大平衡状态时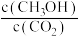 的值,可保持其他条件不变,升高温度 的值,可保持其他条件不变,升高温度 |
您最近一年使用:0次
8 . 在容积为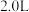 的密闭容器中,通入一定量的
的密闭容器中,通入一定量的 ,发生反应:
,发生反应: 。
。 时,各物质浓度随时间变化如下图所示。
时,各物质浓度随时间变化如下图所示。

(1)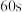 内,
内,
_____ 。
(2)下列叙述中,能说明该反应达到化学平衡状态的是_____(填字母序号)。
(3)降低温度,混合气体的颜色变浅,正反应是_____ 反应(填“放热”或“吸热”)。
(4)欲提高 的平衡转化率,理论上可以采取的措施为
的平衡转化率,理论上可以采取的措施为_____ 。
A.增大压强 B.升高温度 C.加入催化剂
(5) 时,该反应的化学平衡常数值为
时,该反应的化学平衡常数值为_____ 。
(6) 时,在容器中按初始浓度
时,在容器中按初始浓度 投料,反应进行
投料,反应进行_____ (填“正向”或“逆向”)。
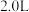 的密闭容器中,通入一定量的
的密闭容器中,通入一定量的 ,发生反应:
,发生反应: 。
。 时,各物质浓度随时间变化如下图所示。
时,各物质浓度随时间变化如下图所示。
(1)
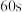 内,
内,
(2)下列叙述中,能说明该反应达到化学平衡状态的是_____(填字母序号)。
A. 的生成速率是 的生成速率是 的生成速率的2倍 的生成速率的2倍 |
B.单位时间内消耗amol ,同时生成 ,同时生成 |
| C.容器内的压强不再变化 |
| D.容器内混合气体的密度不再变化 |
(3)降低温度,混合气体的颜色变浅,正反应是
(4)欲提高
 的平衡转化率,理论上可以采取的措施为
的平衡转化率,理论上可以采取的措施为A.增大压强 B.升高温度 C.加入催化剂
(5)
 时,该反应的化学平衡常数值为
时,该反应的化学平衡常数值为(6)
 时,在容器中按初始浓度
时,在容器中按初始浓度 投料,反应进行
投料,反应进行
您最近一年使用:0次
名校
解题方法
9 . 恒温恒容的密闭容器中,某催化剂表面发生氨的分解反应: ,测得不同起始浓度和催化剂表面积下氨的浓度随时间的变化
,测得不同起始浓度和催化剂表面积下氨的浓度随时间的变化
下列说法不正确的是
 ,测得不同起始浓度和催化剂表面积下氨的浓度随时间的变化
,测得不同起始浓度和催化剂表面积下氨的浓度随时间的变化| 编号 | 时间/min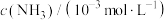 表面积/cm  | 0 | 20 | 40 | 60 | 80 |
| ① | a | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 |
| ② | a | 1.20 | 0.80 | 0.40 | x | |
| ③ | 2a | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
A.实验①,0∼40min,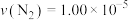 mol⋅L mol⋅L ∙min ∙min |
| B.相同条件下,增加氨气的浓度,反应速率增大 |
| C.相同条件下,增加催化剂的表面积,反应速率增大 |
D.实验②,60min时处于平衡状态, |
您最近一年使用:0次
2023-11-23更新
|
77次组卷
|
31卷引用:北京师范大学附属中学2022-2023学年高二上学期10月月考化学试题
北京师范大学附属中学2022-2023学年高二上学期10月月考化学试题(已下线)考点21 化学反应速率-备战2023年高考化学一轮复习考点帮(全国通用)黑龙江省双鸭山市第一中学2021-2022学年高一下学期期末考试化学试题黑龙江省鹤岗市第一中学2021-2022学年高一下学期期末考试化学试题(已下线)第16练 化学反应的速率与限度-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第20讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(全国通用)浙江省浙里卷天下2022-2023学年高三8月开学测试化学试题江西省新余市第一中学2022-2023学年高二上学期开学考试化学试题辽宁省朝阳市建平县实验中学2022-2023学年高二上学期第一次月考化学试题(已下线)第19讲 化学平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点21 化学反应速率-备战2023年高考化学考试易错题(已下线)易错点22 化学反应平衡和移动-备战2023年高考化学考试易错题天津市五校(杨村宝坻蓟州芦台静海一中)2022-2023学年高二上学期期中考试化学试题黑龙江省佳木斯市第一中学2022-2023学年高三上学期第三次调研化学试题(已下线)2023年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷A(已下线)化学预测卷(五)-预测卷(浙江专版)(已下线)专题09 化学反应速率与化学平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)安徽省合肥一六八中学2022-2023学年高二上学期化学学科学情调研试题辽宁省营口市2022-2023学年高三上学期期末考试化学试题安徽省六安第一中学2022-2023学年高二上学期期末考试化学试题上海市奉贤区2022-2023学年高三上学期一模练习卷化学试题(已下线)第13练 化学反应速率与化学平衡的综合考查 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点21 化学反应速率(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)第二章 章末训练(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)河南省周口恒大中学2023-2024学年高二上学期11月期中考试化学试题吉林省长春市第二实验中学2023-2024学年高二上学期10月月考化学试题(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题安徽省淮北市树人高级中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
10 . 具有十八面体结构的Ag3PO4晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物,
I.配位-沉淀法制备Ag3PO4高效光催化剂

已知:i.Ag3PO4难溶于水,可溶于硝酸;
ii.Ag3PO4沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能;
iii.银氨溶液中存在: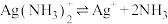 。
。
(1)配制银氨溶液时的反应有 、
、___________ 。
(2)加入 溶液后得到Ag3PO4固体,该反应的离子方程式为
溶液后得到Ag3PO4固体,该反应的离子方程式为___________ 。
(3) 和Na3PO4在溶液中反应也可制得Ag3PO4固体,但制得的Ag3PO4固体光催化性能极差。从速率角度解释其原因:
和Na3PO4在溶液中反应也可制得Ag3PO4固体,但制得的Ag3PO4固体光催化性能极差。从速率角度解释其原因:___________ 。
II.Ag3PO4光催化剂的使用和再生
已知:Ag3PO4晶体在光照条件下发挥催化作用时,首先引发反应S1。
S1: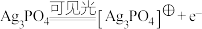
(4) Ag3PO4光催化CO2制备甲醇可实现“碳中和”,S1的后续反应如下。
 ,
,
则由CO2制备甲醇的总反应的化学方程式为___________ 。
(5) Ag3PO4光催化降解有机污染物时,有机污染物被氧化成CO2和H2O。S1的后续反应如下。
S2: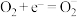 ,
,
S3:……
注:Ag3PO4在该催化过程中可能发生光腐蚀,生成单质银,影响其光催化性能。
①用Ag3PO4依次降解三份相同的含有RhB(一种桃红色有机污染物)的废水,测得3次降解过程中RhB的残留率( ,即时浓度与起始浓度之比)随时间变化的曲线如图,下列说法正确的是
,即时浓度与起始浓度之比)随时间变化的曲线如图,下列说法正确的是___________ (填字母序号)。

a.·OH和 是降解RhB的重要氧化剂
是降解RhB的重要氧化剂
b.第1次使用后Ag3PO4的光催化性能降低
c.该实验条件下,Ag3PO4使用两次即基本失效
第1次光降解时,0~25min内的反应速率为___________  。(废水中RhB初始浓度
。(废水中RhB初始浓度 为100mg/L,RhB的摩尔质量为Mg/mol)
为100mg/L,RhB的摩尔质量为Mg/mol)
②Ag3PO4光催化降解含苯废水时,S3为___________ 。
I.配位-沉淀法制备Ag3PO4高效光催化剂

已知:i.Ag3PO4难溶于水,可溶于硝酸;
ii.Ag3PO4沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能;
iii.银氨溶液中存在:
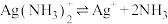 。
。(1)配制银氨溶液时的反应有
 、
、(2)加入
 溶液后得到Ag3PO4固体,该反应的离子方程式为
溶液后得到Ag3PO4固体,该反应的离子方程式为(3)
 和Na3PO4在溶液中反应也可制得Ag3PO4固体,但制得的Ag3PO4固体光催化性能极差。从速率角度解释其原因:
和Na3PO4在溶液中反应也可制得Ag3PO4固体,但制得的Ag3PO4固体光催化性能极差。从速率角度解释其原因:II.Ag3PO4光催化剂的使用和再生
已知:Ag3PO4晶体在光照条件下发挥催化作用时,首先引发反应S1。
S1:
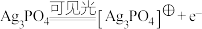
(4) Ag3PO4光催化CO2制备甲醇可实现“碳中和”,S1的后续反应如下。
 ,
,
则由CO2制备甲醇的总反应的化学方程式为
(5) Ag3PO4光催化降解有机污染物时,有机污染物被氧化成CO2和H2O。S1的后续反应如下。
S2:
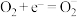 ,
,
S3:……
注:Ag3PO4在该催化过程中可能发生光腐蚀,生成单质银,影响其光催化性能。
①用Ag3PO4依次降解三份相同的含有RhB(一种桃红色有机污染物)的废水,测得3次降解过程中RhB的残留率(
 ,即时浓度与起始浓度之比)随时间变化的曲线如图,下列说法正确的是
,即时浓度与起始浓度之比)随时间变化的曲线如图,下列说法正确的是
a.·OH和
 是降解RhB的重要氧化剂
是降解RhB的重要氧化剂b.第1次使用后Ag3PO4的光催化性能降低
c.该实验条件下,Ag3PO4使用两次即基本失效
第1次光降解时,0~25min内的反应速率为
 。(废水中RhB初始浓度
。(废水中RhB初始浓度 为100mg/L,RhB的摩尔质量为Mg/mol)
为100mg/L,RhB的摩尔质量为Mg/mol)②Ag3PO4光催化降解含苯废水时,S3为
您最近一年使用:0次



