解题方法
1 . 甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1<0 K1
CH3OH(g) ΔH1<0 K1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2<0 K2
CH3OCH3(g)+H2O(g) ΔH2<0 K2
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3<0 K3
CO2(g)+H2(g) ΔH3<0 K3
(1)则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=___________ (用含ΔH1、ΔH2、ΔH3的代数式表示),K=___________ (用含K1、K2、K3的代数式表示)。
(2)反应②达平衡后采取下列措施,能提高CH3OCH3产率的有___________ (填字母,下同)。
A.加入CH3OH B.升高温度 C.增大压强 D.移出H2O E.使用催化剂
(3)以下说法能说明反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)达到平衡状态的
CH3OCH3(g)+CO2(g)达到平衡状态的___________ 。
A.H2和CO2的浓度之比为3∶1
B.单位时间内断裂3个H—H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)200 ℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生反应:
2CH3OH(g) CH3OCH3(g)+H2O(g),测得CH3OH(g)的浓度随时间(t)的变化如下表:
CH3OCH3(g)+H2O(g),测得CH3OH(g)的浓度随时间(t)的变化如下表:
①10~30 min内,用CH3OCH3(g)表示该反应的平均速率为___________ 。
②反应达平衡时,容器内的压强为P0.该反应在200 ℃时的平衡常数Kp=___________ (以分压表示,分压=总压×物质的量分数)。
③200℃时,向该容器中投入三种成分的浓度如下:
该时刻,正、逆反应速率的大小关系为:v正(CH3OH)___________ v逆(CH3OH)(填“>”“<”或“=”)。
①CO(g)+2H2(g)
 CH3OH(g) ΔH1<0 K1
CH3OH(g) ΔH1<0 K1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2<0 K2
CH3OCH3(g)+H2O(g) ΔH2<0 K2③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3<0 K3
CO2(g)+H2(g) ΔH3<0 K3(1)则反应3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=(2)反应②达平衡后采取下列措施,能提高CH3OCH3产率的有
A.加入CH3OH B.升高温度 C.增大压强 D.移出H2O E.使用催化剂
(3)以下说法能说明反应3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)达到平衡状态的
CH3OCH3(g)+CO2(g)达到平衡状态的A.H2和CO2的浓度之比为3∶1
B.单位时间内断裂3个H—H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)200 ℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生反应:
2CH3OH(g)
 CH3OCH3(g)+H2O(g),测得CH3OH(g)的浓度随时间(t)的变化如下表:
CH3OCH3(g)+H2O(g),测得CH3OH(g)的浓度随时间(t)的变化如下表:| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(CH3OH)/(mol·L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
②反应达平衡时,容器内的压强为P0.该反应在200 ℃时的平衡常数Kp=
③200℃时,向该容器中投入三种成分的浓度如下:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| c/(mol·L-1) | 0.54 | 0.68 | 0.68 |
您最近一年使用:0次
名校
解题方法
2 . 直接将CO2转化为有机物并非植物的“专利”,科学家通过多种途径实现了CO2合成甲醛,总反应为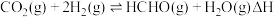 。转化步骤如下图所示:
。转化步骤如下图所示:

(1)甲醇与甲醛中∠OCH键角较大的是_______ ,导致键角不同的原因是_______ 。
(2)已知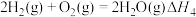 ,则总反应的
,则总反应的
_______ (用图1中焓变以及 表示)。
表示)。
(3)T℃,在容积为2L的恒容密闭容器中充入1molCO2和一定量H2,只发生可逆反应①。若起始时容器内气体压强为1.2kPa,达到平衡时,CH3OH(g)的分压与起始投料比[n(H2)/n(CO2)]的变化关系如下图2所示
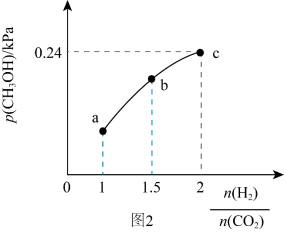
(i)若5min时到达c点,则0~5min时的平均反应速率v(H2)=_______  ;
;
(ii)Kp=_______ (写计算表达式);
(4)在恒温恒容条件下只发生反应②。关于该步骤的下列说法错误的是_______。
(5)已知Arrhenius公式: (Ea为活化能,k为速率常数,R和C为常数)。反应①②的有关数据分别如下图3所示,Ea相对较小的是
(Ea为活化能,k为速率常数,R和C为常数)。反应①②的有关数据分别如下图3所示,Ea相对较小的是_______ (填编号①、②);研究表明,加入某极性介质有助于加快整个反应的合成速率,原因可能是_______ 。

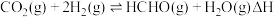 。转化步骤如下图所示:
。转化步骤如下图所示:
(1)甲醇与甲醛中∠OCH键角较大的是
(2)已知
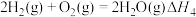 ,则总反应的
,则总反应的
 表示)。
表示)。(3)T℃,在容积为2L的恒容密闭容器中充入1molCO2和一定量H2,只发生可逆反应①。若起始时容器内气体压强为1.2kPa,达到平衡时,CH3OH(g)的分压与起始投料比[n(H2)/n(CO2)]的变化关系如下图2所示

(i)若5min时到达c点,则0~5min时的平均反应速率v(H2)=
 ;
;(ii)Kp=
(4)在恒温恒容条件下只发生反应②。关于该步骤的下列说法错误的是_______。
A.若反应②正向为自发反应,需满足 |
| B.若气体的平均相对分子质量保持不变,说明反应②体系已经达到平衡 |
| C.增大O2的浓度,HCHO(g)的平衡物质的量分数一定增大 |
| D.反应②体系始终存在v生成(H2O2)=v消耗(CH3OH) |
 (Ea为活化能,k为速率常数,R和C为常数)。反应①②的有关数据分别如下图3所示,Ea相对较小的是
(Ea为活化能,k为速率常数,R和C为常数)。反应①②的有关数据分别如下图3所示,Ea相对较小的是
您最近一年使用:0次
解题方法
3 .  可转化成有机物实现碳循环。在体积为2 L的恒容绝热(与外界没有热交换)密闭容器中,充入2 mol
可转化成有机物实现碳循环。在体积为2 L的恒容绝热(与外界没有热交换)密闭容器中,充入2 mol  和5 mol
和5 mol  ,一定条件下发生反应:
,一定条件下发生反应: ,此反应为放热反应,测得
,此反应为放热反应,测得 的物质的量随时间变化如图1所示。
的物质的量随时间变化如图1所示。

(1)0~10 min内, 的平均反应速率
的平均反应速率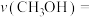
_______  ,第20 min时,
,第20 min时, 的浓度
的浓度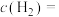
_______  。
。
(2)0~10 min内的平均反应速率_______ (填“>”、“<”或“=”)10~20 min内的平均反应速率,可能的原因是_______ (填标号)。
a.0~10 min内,反应物浓度更大
b.0~10 min内,容器内温度较低
c.0~10 min内,生成物浓度更大
(3)下列能说明上述反应达到平衡状态的是_______ (填标号)。
a.容器内温度不随时间的变化而变化
b.混合气体中各成分浓度之比为
c.单位时间内消耗a mol ,同时生成a mol
,同时生成a mol 
d.混合气体的平均相对分子质量不随时间的变化而变化
(4)CO与 反应可制备
反应可制备 ,
, 可作为燃料使用,用
可作为燃料使用,用 和
和 组成的碱性燃料电池的结构示意图如图2,电池总反应为
组成的碱性燃料电池的结构示意图如图2,电池总反应为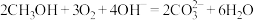 ,则该燃料电池的正极为电极
,则该燃料电池的正极为电极_______ (填“A”或“B”),负极的电极反应式为_______ 。
 可转化成有机物实现碳循环。在体积为2 L的恒容绝热(与外界没有热交换)密闭容器中,充入2 mol
可转化成有机物实现碳循环。在体积为2 L的恒容绝热(与外界没有热交换)密闭容器中,充入2 mol  和5 mol
和5 mol  ,一定条件下发生反应:
,一定条件下发生反应: ,此反应为放热反应,测得
,此反应为放热反应,测得 的物质的量随时间变化如图1所示。
的物质的量随时间变化如图1所示。
(1)0~10 min内,
 的平均反应速率
的平均反应速率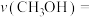
 ,第20 min时,
,第20 min时, 的浓度
的浓度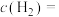
 。
。(2)0~10 min内的平均反应速率
a.0~10 min内,反应物浓度更大
b.0~10 min内,容器内温度较低
c.0~10 min内,生成物浓度更大
(3)下列能说明上述反应达到平衡状态的是
a.容器内温度不随时间的变化而变化
b.混合气体中各成分浓度之比为

c.单位时间内消耗a mol
 ,同时生成a mol
,同时生成a mol 
d.混合气体的平均相对分子质量不随时间的变化而变化
(4)CO与
 反应可制备
反应可制备 ,
, 可作为燃料使用,用
可作为燃料使用,用 和
和 组成的碱性燃料电池的结构示意图如图2,电池总反应为
组成的碱性燃料电池的结构示意图如图2,电池总反应为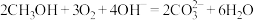 ,则该燃料电池的正极为电极
,则该燃料电池的正极为电极
您最近一年使用:0次
名校
4 . 下列装置或操作不能达到目的的是

| A.①:制取无水MgCl2 | B.②:测定锌与稀硫酸反应的速率 |
| C.③:验证AgCl和AgI的Ksp大小 | D.④:研究浓度对反应速率的影响 |
您最近一年使用:0次
2022-01-23更新
|
465次组卷
|
6卷引用:广东省罗定中学城东学校2023-2024学年高二上学期12月月考化学试题
解题方法
5 . 氨能源的循环利用是目前研究的热点之一。
已知:NH3(g)= H2(g)+
H2(g)+ N2(g) △H1=+45.9kJ•mol-1
N2(g) △H1=+45.9kJ•mol-1
(1)1100℃时,在钨丝表面NH3分解的半衰期(浓度减小一半所需时间)如表所示:
表中的t5的值为__ ;c(NH3)的值从4.56×10-3变化至2.28×10-3的过程中,平均反应速率 (NH3)=
(NH3)=__ (保留三位有效数字)mol•L-1•s-1。
(2)在101kPa下,NH3分解的平衡转化率与温度的关系如图a所示:

①温度为300°C,总压为101kPa时,图a中 (正)>
(正)> (逆)的点是
(逆)的点是__ (填“a”“b”或“c”)。
②为降低NH3分解的活化能可采取的措施有__ 。
(3)已知液氨中存在下列平衡:2NH3(l)=NH +NH
+NH 。用溶有金属氨基化合物(如KNH2)的液氨作电解质电解制氢的工作原理如图b所示:
。用溶有金属氨基化合物(如KNH2)的液氨作电解质电解制氢的工作原理如图b所示:

①电极X的名称是__ (填“阳极”或“阴极”)。
②图b中阳极的电极反应式为__ 。
已知:NH3(g)=
 H2(g)+
H2(g)+ N2(g) △H1=+45.9kJ•mol-1
N2(g) △H1=+45.9kJ•mol-1(1)1100℃时,在钨丝表面NH3分解的半衰期(浓度减小一半所需时间)如表所示:
| c(NH3)/mol·L-1 | 4.56×10-3 | 2.28×10-3 | 1.14×10-3 | 5.70×10-4 | 2.85×10-4 |
| 时间/s | 0 | 440 | 660 | 770 | t5 |
表中的t5的值为
 (NH3)=
(NH3)=(2)在101kPa下,NH3分解的平衡转化率与温度的关系如图a所示:

①温度为300°C,总压为101kPa时,图a中
 (正)>
(正)> (逆)的点是
(逆)的点是②为降低NH3分解的活化能可采取的措施有
(3)已知液氨中存在下列平衡:2NH3(l)=NH
 +NH
+NH 。用溶有金属氨基化合物(如KNH2)的液氨作电解质电解制氢的工作原理如图b所示:
。用溶有金属氨基化合物(如KNH2)的液氨作电解质电解制氢的工作原理如图b所示:
①电极X的名称是
②图b中阳极的电极反应式为
您最近一年使用:0次
解题方法
6 . NH3的催化氧化是制备硝酸的重要反应之一。下面是对氨的催化氧化进行的研究。氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g),在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度随时间的变化如下表:
(1)c1=__ mol/L;c2=____ mol/L。
(2)0~2min内,v(NH3)=__ mol/(L·min)。
(3)工业上需要加快氨气的反应速率,下列措施可行的是__ (填标号)。
A.使用合适的催化剂
B.减小O2的浓度
C.适当升高温度
(4)反应达到平衡时,O2的转化率为__ (精确到小数点后1位数字)%。
| 0 | 1min | 2min | 3min | 4min | |
| c(NH3)/mol.L-1 | 0.800 | c1 | 0.300 | 0.200 | 0.200 |
| c(O2)/mol.L-1 | 1.600 | 1.100 | 0.975 | 0.850 | c2 |
(1)c1=
(2)0~2min内,v(NH3)=
(3)工业上需要加快氨气的反应速率,下列措施可行的是
A.使用合适的催化剂
B.减小O2的浓度
C.适当升高温度
(4)反应达到平衡时,O2的转化率为
您最近一年使用:0次
7 . 可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到化学平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到化学平衡状态的是( )
 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到化学平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到化学平衡状态的是( )| A.3v正(N2)=v正(H2) | B.v正(N2)=v逆(NH3) |
| C.2v正(H2)=3v逆(NH3) | D.v正(N2)=v逆(H2) |
您最近一年使用:0次
2020-08-28更新
|
224次组卷
|
3卷引用:广东省云浮市2019-2020学年高一下学期期末考试化学试题
8 . 在2L密闭容器内,800℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如表所示:
(1)上述反应________ (填“是”或“不是”)可逆反应,在第5s时,NO的转化率为________ 。
(2)如图中表示O2变化曲线的是________ ,用O2表示从0~2s内该反应的平均速率v=________ 。
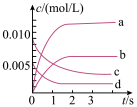
(3)能说明该反应已达到平衡状态的是________ 。
a.v(NO2)=2v(O2) b.容器内气体总质量保持不变
c.v逆(NO)=2v正(O2) d.容器内气体密度保持不变
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应
(2)如图中表示O2变化曲线的是

(3)能说明该反应已达到平衡状态的是
a.v(NO2)=2v(O2) b.容器内气体总质量保持不变
c.v逆(NO)=2v正(O2) d.容器内气体密度保持不变
您最近一年使用:0次
2020-07-07更新
|
202次组卷
|
5卷引用:广东省郁南县连滩中学2019-2020学年高一下学期期中考试化学试题
广东省郁南县连滩中学2019-2020学年高一下学期期中考试化学试题福建省漳州市第一中学2019-2020学年高一3月在线测试(实验班)化学试题湖南省长沙市芙蓉区长沙铁路第一中学2019-2020学年高一下学期第二次月考化学试题(已下线)2.2.2 化学平衡状态(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)(已下线)6.2.2 化学反应的限度(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)
名校
9 . 将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g),反应进行到10 s末,测得A的物质的量为1.8 mol, B的物质的量为0.6 mol,C的物质的量为0.8 mol,则:
2C(g)+2D(g),反应进行到10 s末,测得A的物质的量为1.8 mol, B的物质的量为0.6 mol,C的物质的量为0.8 mol,则:
(1)用C表示10 s内反应的平均反应速率为__________ ;
(2)反应前A的物质的量浓度是__________ ;
(3)10 s末,生成物D的浓度为________ ;
(4)若改变下列条件,生成D的速率如何变化(用“增大”“减小”或“不变”填空)。
 2C(g)+2D(g),反应进行到10 s末,测得A的物质的量为1.8 mol, B的物质的量为0.6 mol,C的物质的量为0.8 mol,则:
2C(g)+2D(g),反应进行到10 s末,测得A的物质的量为1.8 mol, B的物质的量为0.6 mol,C的物质的量为0.8 mol,则:(1)用C表示10 s内反应的平均反应速率为
(2)反应前A的物质的量浓度是
(3)10 s末,生成物D的浓度为
(4)若改变下列条件,生成D的速率如何变化(用“增大”“减小”或“不变”填空)。
| 编号 | 改变的条件 | 生成D的速率 |
| ① | 降低温度 | |
| ② | 增大A的浓度 | |
| ③ | 使用催化剂 | |
| ④ | 恒容下充入Ne(不参与体系反应) |
您最近一年使用:0次
2020-04-18更新
|
329次组卷
|
8卷引用:广东省郁南县连滩中学2019-2020学年高一下学期期中考试化学试题
广东省郁南县连滩中学2019-2020学年高一下学期期中考试化学试题(已下线)2010-2011学年河北省邯郸市高一下学期期末考试化学试卷(已下线)2010—2011学年山东省微山一中高一下学期期末考试化学试卷2017届湖北省老河口市江山中学高三10月月考化学卷(已下线)2019年3月31日 《每日一题》 必修2 每周一测【全国百强校】山西省晋中市平遥中学2018-2019学年高一下学期期中考试化学试题甘肃省靖远县第四中学2019-2020学年高一下学期期中考试化学(普通班)试题山东省济宁市泗水县2020-2021学年高一下学期期中考试化学试题
11-12高一下·广东云浮·期中
名校
解题方法
10 . 在一密闭容器中充入一定量的H2和N2经测定反应开始后3s末的V(H2)=0.3 mol·L-1·s-1,则3s末NH3的浓度为
| A.0.4 mol·L-1 | B.0.6 mol·L-1 | C.0.9 mol·L-1 | D.1.2 mol·L-1 |
您最近一年使用:0次
2016-06-24更新
|
311次组卷
|
4卷引用:2011-2012学年广东省罗定市高一下学期期中质检理综化学试卷
(已下线)2011-2012学年广东省罗定市高一下学期期中质检理综化学试卷2015-2016学年江西金溪一中高一下第二次月考化学试卷青海省西宁市第二十一中学2016-2017学年高一6月月考化学试题广东省广州市天河区华南师范大学附属中学2020届高三化学专题训练(7)



