名校
1 . 氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以H2O2分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验。
(1)实验①和②的目的是___________ 。同学甲在进行实验①和②时并没有观察到明显现象。资料显示,通常条件下过氧化氢稳定,不易分解。为了达到实验目的,可采取的改进方法是___________ (写出一种即可)。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图所示。分析该图能得出的结论是___________ 。

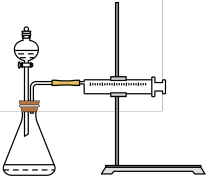
(3)同学乙设计了如图所示的实验装置对过氧化氢的分解速率进行定量分析,以生成20mL气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是___________ 。
(4)向某体积固定的密闭容器中加入0.6molA、0.2molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
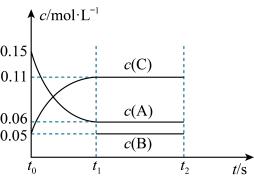
①写出反应的化学方程式:___________ ;
②B的起始的物质的量是___________ ;平衡时体系内的压强为初始状态的___________ 倍。
| 实验编号 | 温度(℃) | 反应物 | 催化剂 |
| ① | 20 | 25mL3%H2O2溶液 | 无 |
| ② | 20 | 25mL5%H2O2溶液 | 无 |
| ③ | 20 | 25mL5%H2O2溶液 | 0.1gMnO2 |
| ④ | 20 | 25mL5%H2O2溶液 | 1~2滴1mol/LFeCl3溶液 |
| ⑤ | 30 | 25mL5%H2O2溶液 | 0.1gMnO2 |
(1)实验①和②的目的是
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图所示。分析该图能得出的结论是

(3)同学乙设计了如图所示的实验装置对过氧化氢的分解速率进行定量分析,以生成20mL气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是

(4)向某体积固定的密闭容器中加入0.6molA、0.2molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:

①写出反应的化学方程式:
②B的起始的物质的量是
您最近一年使用:0次
2023-10-04更新
|
22次组卷
|
2卷引用:广东省 广州市西关培英中学2023-2024学年高二上学期11月期中化学试题
名校
2 . 某小组利用 溶液和硫酸酸化的
溶液和硫酸酸化的 溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性
溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性 溶液褪色所需时间来判断反应的快慢。在稀硫酸体积相同条件下,该小组设计了如下方案。
溶液褪色所需时间来判断反应的快慢。在稀硫酸体积相同条件下,该小组设计了如下方案。
已知:
(1)表中V1=_______ mL,V2=_______ mL。
(2)探究温度对化学反应速率影响的实验编号是_______ (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是_______ 。为了让现象更加明显,能否用0.2mol/L酸性 溶液代替0.1mol/L酸性
溶液代替0.1mol/L酸性 溶液
溶液_______ (是或否)
(3)实验①测得 溶液的褪色时间为2min,这段时。间内平均反应速率
溶液的褪色时间为2min,这段时。间内平均反应速率
_______  。
。
(4)该化学小组同学根据经验绘制了 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中
随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

①该小组同学提出的假设是_______ 。
②请你帮助该小组同学完成实验方案,固体a为_______ 。
③若该小组同学提出的假设成立,应观察到的现象是_______ 。
 溶液和硫酸酸化的
溶液和硫酸酸化的 溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性
溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性 溶液褪色所需时间来判断反应的快慢。在稀硫酸体积相同条件下,该小组设计了如下方案。
溶液褪色所需时间来判断反应的快慢。在稀硫酸体积相同条件下,该小组设计了如下方案。已知:

| 实验编号 | 0.1mol/L酸性 溶液的体积/mL 溶液的体积/mL |  溶液的体积/mL 溶液的体积/mL |  的体积/mL 的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
| 1 | 10 | V1 | 35 | 25 | t1 |
| 2 | 10 | 10 | 30 | 25 | t2 |
| 3 | 10 | 10 | V2 | 50 | t3 |
(2)探究温度对化学反应速率影响的实验编号是
 溶液代替0.1mol/L酸性
溶液代替0.1mol/L酸性 溶液
溶液(3)实验①测得
 溶液的褪色时间为2min,这段时。间内平均反应速率
溶液的褪色时间为2min,这段时。间内平均反应速率
 。
。(4)该化学小组同学根据经验绘制了
 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中
随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是
②请你帮助该小组同学完成实验方案,固体a为
| 实验编号 | 0.1mol/L酸性 溶液的体积/mL 溶液的体积/mL |  溶液的体积/mL 溶液的体积/mL |  的体积/mL 的体积/mL | 实验温度/℃ | 加入少量固体/g | 溶液褪色所需时间/min |
| 4 | 10 | 10 | 30 | 25 | 固体a | t4 |
您最近一年使用:0次
2023·新疆乌鲁木齐·一模
名校
解题方法
3 . 实验小组探究 溶液与
溶液与 溶液的反应及其速率,实验过程和现象如表。已知:
溶液的反应及其速率,实验过程和现象如表。已知:
i、 具有强氧化性,能完全电离,
具有强氧化性,能完全电离, 易被还原为
易被还原为 ;
;
ii、淀粉检测 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝:
即可快速变蓝:
iii、可与 发生反应:
发生反应: 。
。
(1)实验1-1的目的是___________ 。
(2) 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
为了研究 与
与 反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。
反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。
(3)实验2-1不能用于测定 与KI反应的速率,原因除变色时间过短外还有
与KI反应的速率,原因除变色时间过短外还有___________ 。
(4)加入 溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
猜想1: 先与
先与 反应,使
反应,使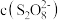 降低;
降低;
猜想2: 先与
先与 反应,___________。
反应,___________。
①甲同学提出猜想1的依据:由信息iii推测, 的还原性
的还原性___________ (填“强于”或“弱于”) 的。
的。
②乙同学根据现有数据证明猜想1不成立,理由是___________ 。
③补全猜想2:___________ 。
(5)查阅文献表明猜想2成立。根据实验2-2的数据,计算 内的平均反应速率
内的平均反应速率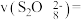
___________  (写出计算式)。
(写出计算式)。
 溶液与
溶液与 溶液的反应及其速率,实验过程和现象如表。已知:
溶液的反应及其速率,实验过程和现象如表。已知:i、
 具有强氧化性,能完全电离,
具有强氧化性,能完全电离, 易被还原为
易被还原为 ;
;ii、淀粉检测
 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝:
即可快速变蓝:iii、可与
 发生反应:
发生反应: 。
。| 编号 | 1-1 | 1-2 |
| 实验操作 | 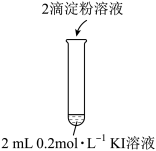 | 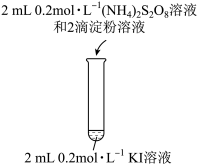 |
| 现象 | 无明显现象 | 溶液立即变蓝 |
(2)
 与
与 反应的离子方程式为
反应的离子方程式为为了研究
 与
与 反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。
反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。| 编号 | 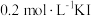 溶液 溶液 | 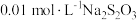 溶液 溶液 | 蒸馏水 | 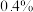 的淀粉溶液/滴 的淀粉溶液/滴 | 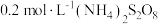 溶液 溶液 | 变色时间/s |
| 2-1 | 2 | 0 | 2.8 | 2 | 0.2 | 立即 |
| 2-2 | 2 | 0.8 | 0.2 | 2 | 0 | 30 |
 与KI反应的速率,原因除变色时间过短外还有
与KI反应的速率,原因除变色时间过短外还有(4)加入
 溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。猜想1:
 先与
先与 反应,使
反应,使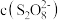 降低;
降低;猜想2:
 先与
先与 反应,___________。
反应,___________。①甲同学提出猜想1的依据:由信息iii推测,
 的还原性
的还原性 的。
的。②乙同学根据现有数据证明猜想1不成立,理由是
③补全猜想2:
(5)查阅文献表明猜想2成立。根据实验2-2的数据,计算
 内的平均反应速率
内的平均反应速率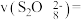
 (写出计算式)。
(写出计算式)。
您最近一年使用:0次
名校
4 . 白醋是照调中的酸味辅料,能改善调节人体的新陈代谢,其主要成分为CH3COOH,为一元弱酸,回答下列问题:
(1)25℃时,pH=5的醋酸溶液中,由水电离出的c(H+)=_____ mol∙L−1。
(2)已知CH3COOH的Ka=1.74×10−5,NH3∙H2O的Kb=1.74×10−5,则CH3COONH4的浓溶液呈_____ (填“酸性”或“中性”或“碱性”);将CH3COONH4加到Mg(OH)2悬浊液中,发现沉淀溶解,试解释原因:______ (用文字和方程式说明)。
(3)用如图所示装置测定Zn和4.0 mol∙L−1、2.0 mol∙L−1醋酸的反应速率:
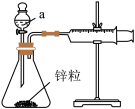
①仪器a的名称为_____ 。
②Zn和醋酸溶液反应的离子方程式为______ 。
③设计实验方案:在不同浓度醋酸溶液下,测定_____ (要求所测得的数据能直观体现反应速率大小)。
(1)25℃时,pH=5的醋酸溶液中,由水电离出的c(H+)=
(2)已知CH3COOH的Ka=1.74×10−5,NH3∙H2O的Kb=1.74×10−5,则CH3COONH4的浓溶液呈
(3)用如图所示装置测定Zn和4.0 mol∙L−1、2.0 mol∙L−1醋酸的反应速率:

①仪器a的名称为
②Zn和醋酸溶液反应的离子方程式为
③设计实验方案:在不同浓度醋酸溶液下,测定
您最近一年使用:0次
5 . 白醋是烹调中的酸味辅料,能改善调节人体的新陈代谢,其主要成分为CH3COOH,为一元弱酸,回答下列问题:
(1)25℃时,pH=5的醋酸溶液中,由水电离出的c(H+)=_______ mol·L-1
(2)已知CH3COOH的Ka=1.74×10-5,NH3·H2O的Kb=1.74×10-5,则CH3COONH4的浓溶液呈_______ (填“酸性”或“中性”或“碱性”);将CH3COONH4加入到Mg(OH)2悬浊液中,发现沉淀溶解,试解释原因:_______ (用文字和方程式说明)。
(3)用如图所示装置测定Zn和4.0mol·L-1、2.0mol·L-1醋酸的反应速率:

①仪器a的名称为_______ 。
②Zn和醋酸溶液反应的离子方程式为_______ 。
③检查装置气密性的操作方法是_______ 。
④设计实验方案:在不同浓度醋酸溶液下,测定_______ (要求所测得的数据能直观体现反应速率大小)。
(1)25℃时,pH=5的醋酸溶液中,由水电离出的c(H+)=
(2)已知CH3COOH的Ka=1.74×10-5,NH3·H2O的Kb=1.74×10-5,则CH3COONH4的浓溶液呈
(3)用如图所示装置测定Zn和4.0mol·L-1、2.0mol·L-1醋酸的反应速率:

①仪器a的名称为
②Zn和醋酸溶液反应的离子方程式为
③检查装置气密性的操作方法是
④设计实验方案:在不同浓度醋酸溶液下,测定
您最近一年使用:0次
6 . 诺贝尔化学奖特别青睐合成氨相关研究,曾3次颁奖于该领域研究成果。当前,氨的合成与应用仍然受到广大化学家的重点关注。回答下列问题:
I.研究发现,一定温度和压强下,在催化剂表面,反应N2(g)+3H2(g)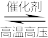 2NH3(g)的相关能量(E)变化如图所示:
2NH3(g)的相关能量(E)变化如图所示:

(1)每生成2molNH3时__ (填放出”或“吸收”)__ kJ的能量。
(2)在恒容密闭容器中发生上述反应,能说明该反应达到平衡状态的是__ 。
a.容器内混合气体的质量不再变化
b.c(N2):c(H2):c(NH3)=1:3:2
c.容器内NH3的浓度不再变化
d.容器内混合气体的物质的量不再变化
(3)一定温度下,在体积为2L的密闭容器中,充入1molN2和3molH2模拟工业合成氨的反应。10min时,测得容器中气体的总物质的量是起始时的0.8倍,用NH3的浓度变化表示的化学反应速率为__ 。
II.某氨-空气燃料电池的工作原理是氨气与氧生成一种常见的无毒气体和水,其装置如图所示:

(4)溶液c最好选择___ (填“酸性”、“碱性”或“中性”)溶液。
(5)正极的电极反应式为__ 。
I.研究发现,一定温度和压强下,在催化剂表面,反应N2(g)+3H2(g)
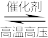 2NH3(g)的相关能量(E)变化如图所示:
2NH3(g)的相关能量(E)变化如图所示:
(1)每生成2molNH3时
(2)在恒容密闭容器中发生上述反应,能说明该反应达到平衡状态的是
a.容器内混合气体的质量不再变化
b.c(N2):c(H2):c(NH3)=1:3:2
c.容器内NH3的浓度不再变化
d.容器内混合气体的物质的量不再变化
(3)一定温度下,在体积为2L的密闭容器中,充入1molN2和3molH2模拟工业合成氨的反应。10min时,测得容器中气体的总物质的量是起始时的0.8倍,用NH3的浓度变化表示的化学反应速率为
II.某氨-空气燃料电池的工作原理是氨气与氧生成一种常见的无毒气体和水,其装置如图所示:

(4)溶液c最好选择
(5)正极的电极反应式为
您最近一年使用:0次
名校
7 . H2O2能缓慢分解生成水和氧气,但分解速率较慢,加入催化剂会加快分解速率。某化学兴趣小组为研究不同催化剂对H2O2分解反应的催化效果,设计了如图甲、乙、丙所示的三组实验。

(1)定性分析:可以通过观察甲装置的______ 现象,而定性得出关于FeCl3和CuSO4催化效果的结论。
查阅资料知:将作为催化剂的Fe3+溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是2Fe3++H2O2=2Fe2++O2↑+2H+和_____ 。
(2)定量测定:用乙装置做对照试验,实验时组装好装置乙,关闭A的旋塞,将注射器活塞向外拉出一段距离后松开,观察活塞是否回到原来的位置。这一操作的实验目的是_____ 。实验时以2min时间为准,需要测量的数据是_____ 。(其它可能影响实验的因素均已忽略)
(3)定量分析:利用丙装置探究MnO2对H2O2分解的催化效果。将30mL5%H2O2溶液一次性加入盛有0.10molMnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V量气管)]与时间(t/min)的关系如图所示。图中b点_____ 90mL(填“大于”、“小于”或“等于”)。

(4)该小组利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如表系列实验:
实验1、2可探究______ 对反应速率的影响,因此V1=_____ mL。在以上条件下进行实验,产生浑浊的时间由长到短的顺序是_____ (填写序号)。

(1)定性分析:可以通过观察甲装置的
查阅资料知:将作为催化剂的Fe3+溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是2Fe3++H2O2=2Fe2++O2↑+2H+和
(2)定量测定:用乙装置做对照试验,实验时组装好装置乙,关闭A的旋塞,将注射器活塞向外拉出一段距离后松开,观察活塞是否回到原来的位置。这一操作的实验目的是
(3)定量分析:利用丙装置探究MnO2对H2O2分解的催化效果。将30mL5%H2O2溶液一次性加入盛有0.10molMnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V量气管)]与时间(t/min)的关系如图所示。图中b点

(4)该小组利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如表系列实验:
| 序号 | 0.1mol/LNa2S2O3溶液 | 0.1mol/LH2SO4溶液 | 蒸馏水 | 反应温度 |
| 1 | 5mL | 5mL | 10mL | 15℃ |
| 2 | 5mL | V1mL | 5mL | 15℃ |
| 3 | 5mL | 10mL | 5mL | 35℃ |
| 4 | 10mL | 10mL | 0 | 35℃ |
您最近一年使用:0次
名校
8 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】
【实验内容及记录】
(1)请完成此实验设计,其中: =
=______ , =
=______ 。
(2)实验①、②探究的是______ 对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是______ 。
(3)探究温度对化学反应速率的影响,应选择______ (填实验编号)。
(4)利用实验①中的数据,计算用 表示的化学反应速率为
表示的化学反应速率为______  。
。
(5)据实验资料记载, 对该反应有催化作用。某小组同学计划设计实验验证
对该反应有催化作用。某小组同学计划设计实验验证 对该反应有催化作用,请填写表中空白。
对该反应有催化作用,请填写表中空白。
若所加固体对反应确有催化作用,则
______ 2.7(填写“>”、“<”或“=”)。
【实验原理】

【实验内容及记录】
| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
  溶液 溶液 |  |  稀 稀 溶液 溶液 | 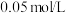  溶液 溶液 | |||
| ① | 25 | 3.0 |  | 2.0 | 3.0 | 1.5 |
| ② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| ③ | 50 | 2.0 |  | 2.0 | 3.0 | 1.0 |
 =
= =
=(2)实验①、②探究的是
(3)探究温度对化学反应速率的影响,应选择
(4)利用实验①中的数据,计算用
 表示的化学反应速率为
表示的化学反应速率为 。
。(5)据实验资料记载,
 对该反应有催化作用。某小组同学计划设计实验验证
对该反应有催化作用。某小组同学计划设计实验验证 对该反应有催化作用,请填写表中空白。
对该反应有催化作用,请填写表中空白。| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/mL | 溶液褪至无色 所需时间/min | ||||
  溶液 溶液 |  |  稀 稀 溶液 溶液 | 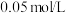  溶液 溶液 | 再向试管中加入少量某种固体 | |||
| ⑤ | 25 | 2.0 | 3.0 | 2.0 | 3.0 |  | |

您最近一年使用:0次
名校
解题方法
9 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验。
【实验原理】
【实验内容及记录】
(1)请完成上述实验设计,其中:a=_______ ,b=_______ ,说明原因:_______ 。
(2)探究温度对化学反应速率的影响,应选择_______ (填实验编号),实验结论为_______ 。
(3)利用实验①中的数据,计算用 表示的化学反应速率为
表示的化学反应速率为_______ (保留两位有效数字)。
(4)该小组同学根据经验绘制了实验②中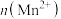 随时间变化的趋势如图甲所示,但查阅资料发现该实验过程中
随时间变化的趋势如图甲所示,但查阅资料发现该实验过程中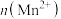 随时间变化的实际趋势如图乙所示。
随时间变化的实际趋势如图乙所示。

该小组同学根据图乙所示信息提出了新的假设,并设计以下实验方案继续进行实验。
Ⅰ.该小组同学提出的假设是_______ 。
Ⅱ.若该小组同学提出的假设成立,应观察到的现象是_______ 。
【实验原理】
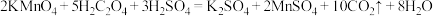
【实验内容及记录】
| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L  溶液 溶液 |  | 3mol/L  溶液 溶液 | 0.05mol/L  溶液 溶液 | |||
| ① | 25 | 3.0 | a | 2.0 | 3.0 | 1.5 |
| ② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| ③ | 50 | 2.0 | b | 2.0 | 3.0 | 1.7 |
(1)请完成上述实验设计,其中:a=
(2)探究温度对化学反应速率的影响,应选择
(3)利用实验①中的数据,计算用
 表示的化学反应速率为
表示的化学反应速率为(4)该小组同学根据经验绘制了实验②中
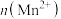 随时间变化的趋势如图甲所示,但查阅资料发现该实验过程中
随时间变化的趋势如图甲所示,但查阅资料发现该实验过程中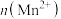 随时间变化的实际趋势如图乙所示。
随时间变化的实际趋势如图乙所示。
该小组同学根据图乙所示信息提出了新的假设,并设计以下实验方案继续进行实验。
| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L  溶液 溶液 |  | 3mol/L  溶液 溶液 | 0.05mol/L  溶液 溶液 | ||||
| ④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 |  | d |
Ⅱ.若该小组同学提出的假设成立,应观察到的现象是
您最近一年使用:0次
2023-05-19更新
|
437次组卷
|
2卷引用:广东省华南师范大学附属中学2022-2023学年高二上学期期中考试化学试题
10 . 双氧水(H2O2)和水都是极弱电解质,但H2O2溶液显酸性
(1)若把H2O2看成二元弱酸。请写出其在水中的电离方程式:_________ 。
(2)二氧化锰是实验室制取氧气的催化剂。下列是某同学设计实验探究双氧水分解实验方案:
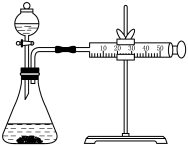
①利用实验Ⅰ和Ⅲ,探究________ 对化学反应速率的影响,实验待测数据是_________ :若在本组实验中现象不明显,可采取的措施是_________________ 。
(3)加0.1 mol MnO2,粉末于50mL过氧化氢溶液(H2O2,ρ=1.1 gmL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。
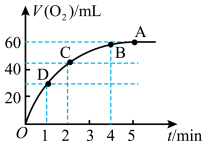
①前4min内氧气的产生速率为________ mLmin-1
②A、B、C、D各点反应速率由快到慢的顺序为_____________ 。
③解释反应速率变化的原因_________________ 。
④计算H2O2初始状态的浓度______________ 。
(1)若把H2O2看成二元弱酸。请写出其在水中的电离方程式:
(2)二氧化锰是实验室制取氧气的催化剂。下列是某同学设计实验探究双氧水分解实验方案:
| 实验 | 20.0mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
| Ⅰ | 5% | 0.2g | 20°C | |
| Ⅱ | 5% | 0.5g | 20°C | |
| Ⅲ | 10% | 0.2g | 20°C |

①利用实验Ⅰ和Ⅲ,探究
(3)加0.1 mol MnO2,粉末于50mL过氧化氢溶液(H2O2,ρ=1.1 gmL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。

①前4min内氧气的产生速率为
②A、B、C、D各点反应速率由快到慢的顺序为
③解释反应速率变化的原因
④计算H2O2初始状态的浓度
您最近一年使用:0次



