1 . H2O2是一种“绿色”试剂,应用于多个领域。回答下列问题:
(l)H2O2分子中__________ (填字母)。
a.含有离子键 b.只含极性共价键 c.只含非极性共价键 d.既含有极性共价键又含有非极性共价键
(2)若向2mL30%的H2O2溶液中通入SO2,反应后的溶液中滴入BaCl2溶液,发现有白色沉淀,则说明H2O2具有_____ (填“氧化性”或“还原性”),写出H2O2与SO2反应的化学方程式:_____ 。
(3)实验发现,向20mL0.40mol•L-1H2O2溶液中加入少量KI溶液可以加快其分解速率。有人提出反应机理可能有2步:i.H2O2+I-=H2O+IO-,ii.H2O2+IO-=H2O+O2↑+I-。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下:
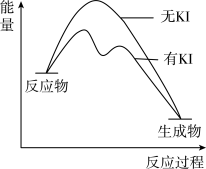
①KI________ (填“能”或“不能”)影响H2O2分解反应的能量变化。
②反应i是________ (填“吸热”或“放热”,下同)反应,反应ii是________ 反应。
③若不考虑溶液体积变化,则0~10min的平均反应速率:v(H2O2)=_________ mol·L-1·min-1。
(l)H2O2分子中
a.含有离子键 b.只含极性共价键 c.只含非极性共价键 d.既含有极性共价键又含有非极性共价键
(2)若向2mL30%的H2O2溶液中通入SO2,反应后的溶液中滴入BaCl2溶液,发现有白色沉淀,则说明H2O2具有
(3)实验发现,向20mL0.40mol•L-1H2O2溶液中加入少量KI溶液可以加快其分解速率。有人提出反应机理可能有2步:i.H2O2+I-=H2O+IO-,ii.H2O2+IO-=H2O+O2↑+I-。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下:

t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
①KI
②反应i是
③若不考虑溶液体积变化,则0~10min的平均反应速率:v(H2O2)=
您最近一年使用:0次
解题方法
2 . 某研究性学习小组利用 溶液和酸性
溶液和酸性 溶液的反应进行了一系列探究外界条件的改变对化学反应速率的影响实验,相关实验如下:
溶液的反应进行了一系列探究外界条件的改变对化学反应速率的影响实验,相关实验如下:
(1)实验中发生的化学反应的离子方程式为___________ 。
(2)通过实验1、4,可探究___________ (填外部因素)对化学反应速率的影响。通过实验3、5,可探究温度对化学反应速率的影响,则
___________ ,
___________ ;实验得出
___________ (填“>”、“=”或“<”) 。
。
(3)0~5min内,实验2中高锰酸钾的平均反应速率为___________  。进行实验4时发现溶液几乎没有褪色,原因可能是
。进行实验4时发现溶液几乎没有褪色,原因可能是___________ 。
(4)甲同学在实验1、2、3中观察到 溶液褪色速率开始时较慢,反应一段时间后逐渐加快。查阅资料获悉:
溶液褪色速率开始时较慢,反应一段时间后逐渐加快。查阅资料获悉:
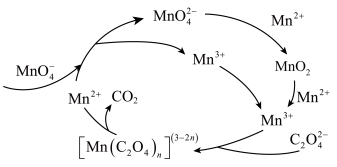
ⅰ. 与酸性
与酸性 溶液反应的一种机理如图所示:
溶液反应的一种机理如图所示:
ⅱ. 在溶液中呈紫红色,能发生反应
在溶液中呈紫红色,能发生反应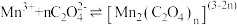 ,
,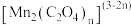 通常呈青绿色;
通常呈青绿色; 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。
①仅由图示机理分析,反应一段时间后溶液褪色速率突然加快的原因可能为___________ 。
②乙同学将实验1中溶液pH调至1时再次做实验,发现溶液紫色并未直接褪去,而是先变为青色溶液,一段时间后青色溶液逐渐褪至无色。乙同学结合上述信息,推测紫色溶液变为青色溶液时,青色溶液中可能含有 。指导老师否定了该猜想,理由是
。指导老师否定了该猜想,理由是___________ 。
 溶液和酸性
溶液和酸性 溶液的反应进行了一系列探究外界条件的改变对化学反应速率的影响实验,相关实验如下:
溶液的反应进行了一系列探究外界条件的改变对化学反应速率的影响实验,相关实验如下:| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/mL | 溶液颜色褪至无色所需时间/min | |||
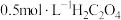 溶液 溶液 |  | 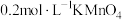 溶液 溶液 |  稀硫酸 稀硫酸 | |||
| 1 | 25 | 3.0 | 3.0 | 2.0 | 2.0 | 6.4 |
| 2 | 25 | 4.0 | 2.0 |  | 2.0 | 5.0 |
| 3 | 25 | 5.0 | 1.0 | 2.0 |  |  |
| 4 | 25 | 1.5 | 4.5 | 2.0 | 2.0 |  |
| 5 | 50 | 5.0 | 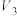 | 2.0 | 2.0 | 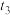 |
(1)实验中发生的化学反应的离子方程式为
(2)通过实验1、4,可探究



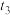 。
。(3)0~5min内,实验2中高锰酸钾的平均反应速率为
 。进行实验4时发现溶液几乎没有褪色,原因可能是
。进行实验4时发现溶液几乎没有褪色,原因可能是(4)甲同学在实验1、2、3中观察到
 溶液褪色速率开始时较慢,反应一段时间后逐渐加快。查阅资料获悉:
溶液褪色速率开始时较慢,反应一段时间后逐渐加快。查阅资料获悉:ⅰ.
 与酸性
与酸性 溶液反应的一种机理如图所示:
溶液反应的一种机理如图所示:
ⅱ.
 在溶液中呈紫红色,能发生反应
在溶液中呈紫红色,能发生反应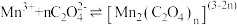 ,
,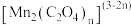 通常呈青绿色;
通常呈青绿色; 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。①仅由图示机理分析,反应一段时间后溶液褪色速率突然加快的原因可能为
②乙同学将实验1中溶液pH调至1时再次做实验,发现溶液紫色并未直接褪去,而是先变为青色溶液,一段时间后青色溶液逐渐褪至无色。乙同学结合上述信息,推测紫色溶液变为青色溶液时,青色溶液中可能含有
 。指导老师否定了该猜想,理由是
。指导老师否定了该猜想,理由是
您最近一年使用:0次
2023-11-22更新
|
84次组卷
|
3卷引用:广西贵港市部分学校2023-2024学年高二上学期期中联考化学试题
3 . 我国向世界郑重承诺力争在2030年前实现碳达峰,在2060年前实现碳中和。在实现碳达峰和碳中和的过程中化学发挥着重要的作用。
Ⅰ.以 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 的反应:
的反应: 为温室气体减排提供了一个新途径,该反应转化过程及各分子化学键完全断裂时的能量变化如图所示:
为温室气体减排提供了一个新途径,该反应转化过程及各分子化学键完全断裂时的能量变化如图所示:

(1)根据数据计算, ,
,
_______ kJ/mol
(2)将一氧化碳与氧气的反应设计成燃料电池,工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中 可以在固体介质NASICON中自由移动。
可以在固体介质NASICON中自由移动。

工作时,负极电极反应式_______ 。
Ⅱ.科学家开发高效多功能催化剂,高选择性利用 和
和 制备
制备 ,实现废旧物资循环利用。反应原理是
,实现废旧物资循环利用。反应原理是 。
。
(3)在恒温恒容条件下充入 和
和 发生上述反应。
发生上述反应。
①下列情况表明该反应已达到平衡状态的是_______ (填标号)。
A.混合气体的密度不随时间变化 B.混合气体的总压强不随时间变化
C.混合气体的平均摩尔质量不随时间变化 D. 和
和 的浓度之比不随时间变化
的浓度之比不随时间变化
②其他条件相同,只改变下列一个条件,能提高 生成速率的是
生成速率的是_______ (填标号)。
A.降低温度 B.再充入 C.充入
C.充入 D.及时移走部分
D.及时移走部分
(4)在恒容密闭容器中充入一定量 和
和 发生上述反应,测得一定时间内
发生上述反应,测得一定时间内 的转化率与催化剂Cat1、Cat2以及温度的关系如图,催化效率较高的是
的转化率与催化剂Cat1、Cat2以及温度的关系如图,催化效率较高的是_______ (填“Cat1”或“Cat2”),理由是_______ 。

(5)在某温度下,向一容积为2L的恒容密闭容器中充入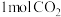 和
和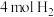 ,发生上述反应,测得气体总压强变化如图。
,发生上述反应,测得气体总压强变化如图。

0~10min内,
_______  ;0~5min内
;0~5min内
_______ (填“大于”“小于”或“等于”)5~10min内 。
。
Ⅰ.以
 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 的反应:
的反应: 为温室气体减排提供了一个新途径,该反应转化过程及各分子化学键完全断裂时的能量变化如图所示:
为温室气体减排提供了一个新途径,该反应转化过程及各分子化学键完全断裂时的能量变化如图所示:
(1)根据数据计算,
 ,
,
(2)将一氧化碳与氧气的反应设计成燃料电池,工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中
 可以在固体介质NASICON中自由移动。
可以在固体介质NASICON中自由移动。
工作时,负极电极反应式
Ⅱ.科学家开发高效多功能催化剂,高选择性利用
 和
和 制备
制备 ,实现废旧物资循环利用。反应原理是
,实现废旧物资循环利用。反应原理是 。
。(3)在恒温恒容条件下充入
 和
和 发生上述反应。
发生上述反应。①下列情况表明该反应已达到平衡状态的是
A.混合气体的密度不随时间变化 B.混合气体的总压强不随时间变化
C.混合气体的平均摩尔质量不随时间变化 D.
 和
和 的浓度之比不随时间变化
的浓度之比不随时间变化②其他条件相同,只改变下列一个条件,能提高
 生成速率的是
生成速率的是A.降低温度 B.再充入
 C.充入
C.充入 D.及时移走部分
D.及时移走部分
(4)在恒容密闭容器中充入一定量
 和
和 发生上述反应,测得一定时间内
发生上述反应,测得一定时间内 的转化率与催化剂Cat1、Cat2以及温度的关系如图,催化效率较高的是
的转化率与催化剂Cat1、Cat2以及温度的关系如图,催化效率较高的是
(5)在某温度下,向一容积为2L的恒容密闭容器中充入
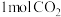 和
和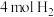 ,发生上述反应,测得气体总压强变化如图。
,发生上述反应,测得气体总压强变化如图。
0~10min内,

 ;0~5min内
;0~5min内
 。
。
您最近一年使用:0次
4 . I.某研究性学习小组利用草酸(H2C2O4)溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
(1)草酸为弱酸,写出草酸与高锰酸钾反应的离子方程式___________ 。
(2)通过实验A、B,可探究出___________ (填外部因素)的改变对化学反应速率的影响,其中V1=___________ 、T1=___________ ;通过实验___________ (填实验序号)可探究出温度变化对化学反应速率的影响。
(3)若t1<8,则由此实验可以得出的结论是___________ ;忽略溶液体积的变化,利用实验B中数据计算,0-8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4) ___________ 。
Ⅱ.催化剂在生产和科技领域起到重大作用。某化学研究小组的同学分别设计了如图1所示的实验,用控制变量法比较和对分解的催化效果。请回答相关问题;
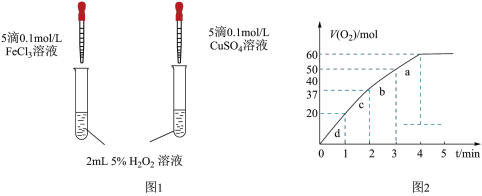
(4)定性分析:某同学通过观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,该结论___________ 填(“合理”或“不合理”),原因___________ 。
| 实验序号 | 实验 温度 | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
| V/mL | c/ mol∙L-1 | V/mL | c/ mol∙L-1 | V/mL | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(2)通过实验A、B,可探究出
(3)若t1<8,则由此实验可以得出的结论是
Ⅱ.催化剂在生产和科技领域起到重大作用。某化学研究小组的同学分别设计了如图1所示的实验,用控制变量法比较和对分解的催化效果。请回答相关问题;

(4)定性分析:某同学通过观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,该结论
您最近一年使用:0次
2023-04-17更新
|
202次组卷
|
2卷引用:广西壮族自治区钦州市第四中学2022-2023学年高一下学期3月月考化学试卷
名校
5 . 某学习小组为了探究影响酸性高锰酸钾溶液与NaHSO3溶液反应速率的因素,该小组设计如表实验方案。
下列说法正确的是
| 实验 | 0.2mol·L-1NaHSO3溶液/mL | 0.1mol·L-1KMnO4溶液/mL | 0.6mol·L-1H2SO4溶液/mL | 0.1mol·L-1MnSO4溶液/mL | V(H2O)/mL | 混合溶液褪色时间/min |
| 1 | 3.0 | 2.0 | 1.0 | 0 | 2.0 | 8 |
| 2 | 3.0 | 2.0 | 2.0 | 0 | a | 6 |
| 3 | 4.0 | 2.0 | 2.0 | 0 | 0 | 4 |
| 4 | 3.0 | 2.0 | 1.0 | 0.5 | b | 3 |
A.该反应的离子方程式为5SO +2MnO +2MnO +6H+=2Mn2++5SO +6H+=2Mn2++5SO +3H2O +3H2O |
| B.a=1.0、b=1.5 |
C.实验3从反应开始到反应结束这段时间内反应速率v(MnO )=0.025mol·L-1·min-1 )=0.025mol·L-1·min-1 |
D.实验4与实验1相比,说明SO 可能是该反应的催化剂 可能是该反应的催化剂 |
您最近一年使用:0次
2022-05-27更新
|
555次组卷
|
7卷引用:广西玉林市普通高中2021-2022学年高一下学期期末考试化学试题
广西玉林市普通高中2021-2022学年高一下学期期末考试化学试题山西省吕梁市临县第一中学2021-2022学年高一下学期5月月考化学试题河南省开封市五县2021-2022学年高二下学期期末考试化学试题(已下线)2.1.2 影响化学反应速率的因素 活化能 -2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)(已下线)化学反应速率与化学平衡——课时2化学反应速率的影响因素新疆生产建设兵团第一师高级中学2022-2023学年高一下学期4月月考化学试题(已下线)第05练 化学反应的速率与限度-2023年【暑假分层作业】高一化学(人教版2019必修第二册)
6 . 一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是
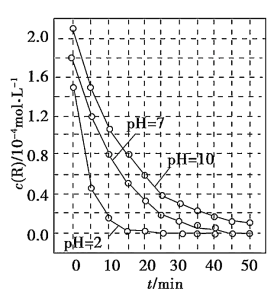

| A.在0-50min之间, pH =2和 PH= 7时 R 的降解百分率相等 |
| B.溶液酸性越强, R 的降解速率越小 |
| C.R的起始浓度越小,降解速率越大 |
| D.在 20-25min之间, pH =10时 R 的平均降解速率为 0.04mol·L-1·min-1 |
您最近一年使用:0次
2019-01-30更新
|
2383次组卷
|
44卷引用:广西柳州地区民族高级中学2022-2023学年高一下学期期中考试化学试题
广西柳州地区民族高级中学2022-2023学年高一下学期期中考试化学试题2012年普通高等学校招生全国统一考试理综化学部分(福建卷)(已下线)2012-2013学年吉林省长春市十一高中高二上学期期末考试化学试卷2015届湖北省襄阳市普通高中高三1月调研理综化学试卷2015-2016学年安徽省屯溪一中高二上期中测试化学试卷2015-2016学年安徽省合肥中科大附中高二下期中理科化学试卷2017届河北省沧州市第一中学高三上周测化学试卷2016-2017学年安徽师大附中高二上10月月考化学卷2016-2017学年湖北省武钢三中高二上月考一化学卷辽宁省大连育明高级中学2018届高三人教版选修四同步周测三化学试题浙江省金华市2018届高三9月十校联考化学试题重庆市巴蜀中学2017-2018学年高二10月月考化学试题河南省林州市第一中学2017-2018学年高二(火箭班)上学期期末考试化学试题(已下线)2018年9月20日 《每日一题》一轮复习-化学反应速率的计算与比较河南省鹤壁市淇县第一中学2018-2019学年高二(普通班)上学期第一次月考化学试题甘肃省岷县第二中学2018-2019学年高二上学期期中考试化学试题福建省泉州市泉港区第一中学2018-2019学年高二上学期期末考试化学试题【校级联考】浙江省温州新力量联盟2018-2019学年高二下学期期中考试化学试题步步为赢 高二化学寒假作业:作业五 化学平衡的图像分析浙江省桐乡市茅盾中学2020年高二(上)期末模拟卷(已下线)【南昌新东方】2018-2019 莲塘一中 高三11月 012鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第3节 化学反应的速率 课时2 影响化学反应速率的因素鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第3节 化学反应的速率高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时3 影响化学反应速率的因素综合分析黑龙江省哈尔滨市第六中学2020-2021学年高二10月月考化学试题福建省福州第一中学2020-2021学年高二上学期期中考试化学试题浙江省浙北G2(嘉兴一中、湖州中学)2020-2021学年高二上学期期中联考化学试题福建省连城县第一中学2020-2021学年高二上学期第二次月考化学(高考科)试题江西省抚州市金溪县第一中学2020-2021学年高二上学期第一次月考化学试题选择性必修1 专题2 第一单元 课时3 影响化学反应速率的因素综合分析重庆两江新区西大附中2021-2022学年高二上学期(秋季)开学考试化学试题黑龙江省哈尔滨市第六中学校2021-2022学年高二上学期10月阶段性总结化学试题辽宁省营口市普通高中2021-2022学年高三上学期期末教学质量检测化学试题山西省太原市第五中学2021-2022学年高一下学期5月阶段性检测化学试题北京市大兴区兴华中学2021-2022学年高三下学期月考化学试题山西省太原市第五实验中学2021-2022学年高一下学期5月阶段性检测化学试题湖南省长沙市长郡中学2022-2023学年高二上学期期中考试化学试题福建省晋江市第一中学2021-2022学年高二上学期期中考试化学试题安徽省怀宁县第二中学2021-2022学年高三上学期期末考试化学试题云南省昆明市昆明行知中学2021-2022学年高二上学期第一次质量检测(10月)化学试题陕西省西安市铁一中学2022-2023学年高一下学期期中考试化学试题广东省台山市华侨中学2022-2023学年高一下学期期中考试化学试题福建省福州市六校2023-2024学年高二上学期期中联考化学试题福建省晋江市磁灶中学等校2022-2023学年高二上学期期中联考化学试题
名校
7 . 2022年5月10日天舟四号货运飞船成功对接空间站天和核心舱并转入组合体飞行,空间站的水气整合系统利用“萨巴蒂尔反应”,将CO2转化为CH4和水蒸气,配合O2生成系统可实现O2的再生。回答下列问题:
已知萨巴蒂尔反应为:CO2(g)+ 4H2(g) CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
反应I:2H2(g)+O2(g)=2H2O(g) △H2=-483 kJ/mol
反应II:CO2(g)+ 2H2O(g) CH4(g)+2O2(g) △H3=+802.3 kJ/mol
CH4(g)+2O2(g) △H3=+802.3 kJ/mol
(1)若“萨巴蒂尔反应”的逆反应活化能E逆=akJ/mol,则正反应活化能为_______ kJ/mol。
(2)“萨巴蒂尔反应”在固定容积的密闭容器中发生,若要提高CO2的平衡转化率,可采取的措施有_______ (写两条)。
(3)在某一恒容密闭容器中加入CO2、H2,其分压分别为15kPa、30kPa,加入催化剂并加热使其发生“萨巴蒂尔反应”。研究表明CH4的反应速率v(CH4)= 1.2×10-6p(CO2)p4(H2) (kPa﹒s-1),某时刻测得H2O(g)的分压为10kPa,则该时刻v(H2)=_______ kPa﹒s-1。
(4)恒压条件时,按c(CO2):c(H2O)=1:2投料,发生反应II,测得不同温度下平衡时体系中各物质浓度的关系如图。

图中代表CH4浓度的曲线为_______ ;350℃时,A点的平衡常数为
_______ (填计算结果)。
(5)氧再生反应可以通过酸性条件下半导体光催化转化实现,反应机理如图所示:

①光催化CO2转化为CH4的阴极方程式为_______ 。
②催化剂的催化效率和CH4的生成速率随温度的变化关系如图所示。300℃到400℃之间,CH4生成速率加快的原因是_______ 。
已知萨巴蒂尔反应为:CO2(g)+ 4H2(g)
 CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1反应I:2H2(g)+O2(g)=2H2O(g) △H2=-483 kJ/mol
反应II:CO2(g)+ 2H2O(g)
 CH4(g)+2O2(g) △H3=+802.3 kJ/mol
CH4(g)+2O2(g) △H3=+802.3 kJ/mol(1)若“萨巴蒂尔反应”的逆反应活化能E逆=akJ/mol,则正反应活化能为
(2)“萨巴蒂尔反应”在固定容积的密闭容器中发生,若要提高CO2的平衡转化率,可采取的措施有
(3)在某一恒容密闭容器中加入CO2、H2,其分压分别为15kPa、30kPa,加入催化剂并加热使其发生“萨巴蒂尔反应”。研究表明CH4的反应速率v(CH4)= 1.2×10-6p(CO2)p4(H2) (kPa﹒s-1),某时刻测得H2O(g)的分压为10kPa,则该时刻v(H2)=
(4)恒压条件时,按c(CO2):c(H2O)=1:2投料,发生反应II,测得不同温度下平衡时体系中各物质浓度的关系如图。

图中代表CH4浓度的曲线为

(5)氧再生反应可以通过酸性条件下半导体光催化转化实现,反应机理如图所示:

①光催化CO2转化为CH4的阴极方程式为
②催化剂的催化效率和CH4的生成速率随温度的变化关系如图所示。300℃到400℃之间,CH4生成速率加快的原因是
您最近一年使用:0次



