名校
解题方法
1 . 生产、生活中产生的废水、废气是环境污染的重要源头。在环境治理方面人们可利用I2O5和Na2SO3等化工产品实现对废水和废气的治理。
(1)利用I2O5的氧化性处理废气H2S,得到S、I2两种单质,发生反应的化学方程式为________ 。
(2)利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g) 5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
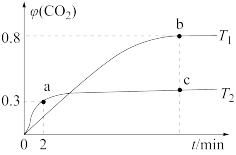
①温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=________ 。
②b点时CO的转化率为__________ ,化学反应的平衡常数K=_______ (填表达式)。
③反应:I2O5(s)+5CO(g) 5CO2(g)+I2(s)的ΔH
5CO2(g)+I2(s)的ΔH______ 0(填“>”“<”或“=”)。
④上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡________ (填“向左”“向右”或“不”)移动。
⑤下列现象,可以表示上述反应达到平衡状态的是________ (填字母)。
A.容器内的压强不再变化
B.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
C.混合气的密度不再变化
D.混合气的平均相对分子质量不再变化
(3)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应:①Na2SO3(aq)+Cl2(g)+H2O(l) =Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol−1
②Cl2(g)+H2O(l) =HCl(aq)+HClO(aq) ΔH2=b kJ·mol−1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:___________ 。
(1)利用I2O5的氧化性处理废气H2S,得到S、I2两种单质,发生反应的化学方程式为
(2)利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g)
 5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH 。 已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
①温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=
②b点时CO的转化率为
③反应:I2O5(s)+5CO(g)
 5CO2(g)+I2(s)的ΔH
5CO2(g)+I2(s)的ΔH④上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡
⑤下列现象,可以表示上述反应达到平衡状态的是
A.容器内的压强不再变化
B.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
C.混合气的密度不再变化
D.混合气的平均相对分子质量不再变化
(3)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应:①Na2SO3(aq)+Cl2(g)+H2O(l) =Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol−1
②Cl2(g)+H2O(l) =HCl(aq)+HClO(aq) ΔH2=b kJ·mol−1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:
您最近一年使用:0次
2020-11-25更新
|
164次组卷
|
6卷引用:甘肃省会宁县第一中学2017-2018学年高二上学期期中考试(理)化学试题
名校
解题方法
2 . 某小组利用H2C2O4溶液与用硫酸酸化的KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时。该小组设计了如下的方案。
(1)该实验是通过___ 来判断反应的快慢。
(2)已知H2C2O4被KMnO4(H+)氧化为CO2逸出,该反应的化学方程式为___ ,为了观察到实验现象从而判断反应的快慢,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)≥___ 。
(3)探究温度对化学反应速率影响的实验编号是__ 和__ (填编号,下同),可探究H2C2O4浓度对化学反应速率影响的实验编号是__ 和__ 。
(4)实验①测得反应所用的时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=__ 。
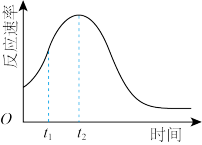
(5)该小组发现室温下反应速率走势如图,其中t1~t2时间内速率变快的主要原因可能是:___ ,若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是___ (填序号)
A.硫酸钾 B.硫酸锰 C.稀硫酸 D.氯化锰
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 蒸馏水 体积/ml | 温度/℃ | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | |||
| ① | 0.50 | 6.0 | 0.010 | 4.0 | 0 | 25 |
| ② | 0.50 | a | 0.010 | 4.0 | c | 25 |
| ③ | 0.50 | 6.0 | 0.010 | 4.0 | 0 | 50 |
(2)已知H2C2O4被KMnO4(H+)氧化为CO2逸出,该反应的化学方程式为
(3)探究温度对化学反应速率影响的实验编号是
(4)实验①测得反应所用的时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=
(5)该小组发现室温下反应速率走势如图,其中t1~t2时间内速率变快的主要原因可能是:
A.硫酸钾 B.硫酸锰 C.稀硫酸 D.氯化锰

您最近一年使用:0次
名校
解题方法
3 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
(1)请完成此实验设计,其中:V1=________ ,V2=__________ 。
(2)实验①、②探究的是_____________ 对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是______________________________________ 。
(3)探究温度对化学反应速率的影响,应选择________________ (填实验编号)。
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为__________ 。
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。
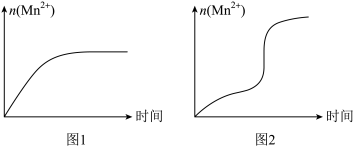
该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
①该小组同学提出的假设是__________________________________________ 。
②若该小组同学提出的假设成立,应观察到_____________________________ 现象。
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
| ① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
| ② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| ③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(2)实验①、②探究的是
(3)探究温度对化学反应速率的影响,应选择
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
| ④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
②若该小组同学提出的假设成立,应观察到
您最近一年使用:0次
2018-06-26更新
|
443次组卷
|
11卷引用:【全国百强校】甘肃省兰州市第一中学2018-2019学年高一下学期期中考试化学试题
【全国百强校】甘肃省兰州市第一中学2018-2019学年高一下学期期中考试化学试题2015-2016学年广东省仲元中学高一下期末理科化学试卷安徽省定远重点中学2017-2018学年高一下学期教学段考化学试题安徽省肥东高级中学2017-2018学年高一下学期第二学段考试化学试题重庆市凤鸣山中学2020-2021学年高二上学期期中考试化学试题四川省泸州市泸县第四中学2021-2022学年高二下学期开学考试化学试题新疆精河县高级中学2021-2022学年高一下学期期中考试化学试题福建省晋江市第一中学2021-2022学年高二上学期线上学习诊断暨单元测试(第一次月考)化学试题广东省深圳市龙华中学2021-2022学年高二上学期第一次考试化学试题湖南省株洲市第一中学2022-2023学年高二上学期期末考试化学试题重庆市长寿中学校2022-2023学年高二上学期1月期末考试化学试题
名校
解题方法
4 . (1)下列8种化学符号: 、
、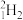 、
、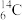 、
、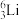 、
、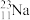 、
、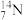 、
、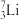 、
、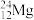
①表示核素的符号共________ 种。
②质量数相等,但不能互称同位素的是________ 和________ 。
(2)为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如图实验,请回答:
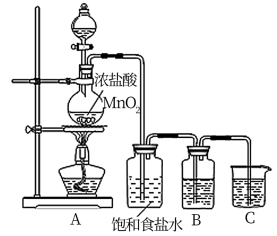
①装置B中盛放的试剂是____________ (填选项),实验现象为____________ 。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
②能证明氯元素比硫元素非金属性强的依据为____________ 。(填序号)
A.盐酸为强酸,氢硫酸为弱酸 B.次氯酸的氧化性比稀硫酸强
C.S2-比Cl-还原性强 D.HCl比H2S稳定
(3)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g) 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为_________ ;5min时,N2O5在混合气体中的体积分数是____________ 。
 、
、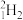 、
、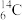 、
、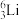 、
、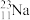 、
、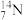 、
、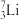 、
、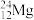
①表示核素的符号共
②质量数相等,但不能互称同位素的是
(2)为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如图实验,请回答:

①装置B中盛放的试剂是
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
②能证明氯元素比硫元素非金属性强的依据为
A.盐酸为强酸,氢硫酸为弱酸 B.次氯酸的氧化性比稀硫酸强
C.S2-比Cl-还原性强 D.HCl比H2S稳定
(3)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)
 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为
您最近一年使用:0次
名校
解题方法
5 . 某化学小组欲测定KClO3溶液与NaHSO3溶液反应的化学反应速率,所用试剂为10mL0.1mol•L-1KClO3溶液和10mL0.3mol•L-1NaHSO3溶液,所得溶液中c(Cl-)随时间变化的曲线如图所示。

(1)该反应的离子方程式是_____ 。
(2)根据实验数据可知,该反应在0~4min内的平均反应速率v(Cl-)=_____ 。
(3)某同学仔细分析实验数据后发现,在反应过程中,该反应的反应速率先增大后减小。该同学设计如表实验方案,进一步探究反应速率先增大的原因。
①补全方案I中的假设:____ 。
②方案II中加入的固体为____ (填化学式)。
③除I、II、III中的假设外,还可以提出的假设是____ 。
④某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:____ 。
(4)试分析反应后期化学反应速率减小的原因:_____ 。

(1)该反应的离子方程式是
(2)根据实验数据可知,该反应在0~4min内的平均反应速率v(Cl-)=
(3)某同学仔细分析实验数据后发现,在反应过程中,该反应的反应速率先增大后减小。该同学设计如表实验方案,进一步探究反应速率先增大的原因。
| 方案 | 假设 | 实验操作 |
| I | _____,反应速率加快 | 向烧杯中加入10mL0.1mol•L-1KClO3溶液和10mL0.3mol•L-1NaHSO3溶液,插入温度计 |
| II | 生成的Cl-对反应有催化作用,加快了反应速率 | 取10mL0.1mol•L-1KClO3溶液于烧杯中,先加入少量_____固体,再加入10mL0.3mol•L-1NaHSO3溶液 |
| III | 反应中溶液酸性增强,加快了反应速率 | 分别向a、b两个烧杯中加入10mL0.1mol•L-1KClO3溶液;向烧杯a中加入1mL蒸馏水,向烧杯b中加入1mL0.2mol•L-1盐酸;再分别向两个烧杯中加入10mL0.3mol•L-1NaHSO3溶液 |
②方案II中加入的固体为
③除I、II、III中的假设外,还可以提出的假设是
④某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:
(4)试分析反应后期化学反应速率减小的原因:
您最近一年使用:0次
2022-09-26更新
|
442次组卷
|
6卷引用:甘肃省平凉市第一中学2022-2023学年高二上学期第一次月考化学试题
名校
解题方法
6 . Ⅰ.某大型化工厂产生的酸性废液中含有 、
、 两种金属离子,某化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。
两种金属离子,某化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。

(1)操作①的名称是_______ 。
(2)沉淀A中含有的金属单质有_______ 。
(3)检验溶液B中含有的金属阳离子的实验方法为:取少量溶液B于洁净的小试管中,加入_______ (填“KSCN”或“ ”)溶液,溶液变红色,即可检验。
”)溶液,溶液变红色,即可检验。
(4)写出溶液B中加入氨水时发生反应的离子方程式_______ 。
Ⅱ.合成氨是人类科技发展史上的一项重大突破,已知:合成氨反应的化学方程式为 。
。
(5)其他条件不变时,升高温度,化学反应速率_______ (填“增大”或“减小”)。
(6)取1 mol 和3 mol
和3 mol  置于1 L的密闭容器中,10 min后达到平衡状态,
置于1 L的密闭容器中,10 min后达到平衡状态, 变为0.6 mol,用
变为0.6 mol,用 表示该反应的反应速率为
表示该反应的反应速率为_______ mol/(L·min), 的转化率为
的转化率为_______ 。
 、
、 两种金属离子,某化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。
两种金属离子,某化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。
(1)操作①的名称是
(2)沉淀A中含有的金属单质有
(3)检验溶液B中含有的金属阳离子的实验方法为:取少量溶液B于洁净的小试管中,加入
 ”)溶液,溶液变红色,即可检验。
”)溶液,溶液变红色,即可检验。(4)写出溶液B中加入氨水时发生反应的离子方程式
Ⅱ.合成氨是人类科技发展史上的一项重大突破,已知:合成氨反应的化学方程式为
 。
。(5)其他条件不变时,升高温度,化学反应速率
(6)取1 mol
 和3 mol
和3 mol  置于1 L的密闭容器中,10 min后达到平衡状态,
置于1 L的密闭容器中,10 min后达到平衡状态, 变为0.6 mol,用
变为0.6 mol,用 表示该反应的反应速率为
表示该反应的反应速率为 的转化率为
的转化率为
您最近一年使用:0次
名校
7 . 教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,某实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):

(1)试写出酸性KMnO4和H2C2O4的离子反应方程式为:___________ 。
(2)该实验探究的是___________ 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是:___________>___________,___________ (填实验序号)。
(3)若实验①在2min末收集了4.48mLCO2(标准状况下),用CO2表示2min内的反应速率为___________ ,则在2min末c(MnO )=
)=___________ (假设混合液体积为50mL)。
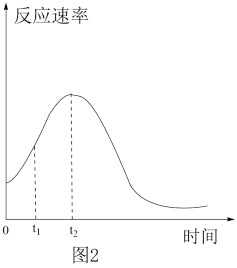
(4)实验小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:产物Mn2+(或MnSO4)是反应的催化剂;②___________ 。

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL0.1mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
| ② | 20mL0.2mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
(2)该实验探究的是
(3)若实验①在2min末收集了4.48mLCO2(标准状况下),用CO2表示2min内的反应速率为
 )=
)=(4)实验小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:产物Mn2+(或MnSO4)是反应的催化剂;②

您最近一年使用:0次
名校
8 . 同学们测定和探究影响反应速率的因素,设计了如下系列实验。
Ⅰ.甲同学测定室温下H2C2O4溶液与用硫酸酸化的KMnO4溶液的反应速率。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时。该小组设计了如下的方案。
(1)写出H2C2O4与KMnO4(H+)反应的离子反应方程式:___________
(2)该实验是通过测定___________ 来计算反应速率。
(3)实验测得反应所用的时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=___________ 。
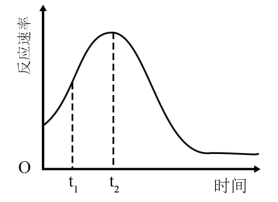
(4)该小组发现室温下反应速率走势如图,其中t1~t2时间内速率变快的主要原因可能是:___________ ,若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是___________ (填序号)。
A.硫酸钾 B.硫酸锰 C.稀硫酸 D.二氯化锰
Ⅱ.乙同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
(5)该实验①、②可探究___________ 对反应速率的影响,因此V1和V3分别是___________ 、___________ 。实验①、③可探究硫酸浓度对反应速率的影响,因此V5=___________ 。
(6)硫代硫酸钠与稀硫酸反应离子反应方程式:___________ 。
Ⅰ.甲同学测定室温下H2C2O4溶液与用硫酸酸化的KMnO4溶液的反应速率。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时。该小组设计了如下的方案。
| H2C2O4溶液 | 酸性KMnO4溶液 | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL |
| 0.50 | 6.0 | 0.020 | 4.0 |
(2)该实验是通过测定
(3)实验测得反应所用的时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=
(4)该小组发现室温下反应速率走势如图,其中t1~t2时间内速率变快的主要原因可能是:
A.硫酸钾 B.硫酸锰 C.稀硫酸 D.二氯化锰

Ⅱ.乙同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
| 实验序号 | 反应温度/℃ | Na2S2O3浓度 | 稀硫酸 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(6)硫代硫酸钠与稀硫酸反应离子反应方程式:
您最近一年使用:0次
2021-06-22更新
|
432次组卷
|
2卷引用:甘肃省静宁县第一中学2020-2021学年高一下学期第三次月考化学(实验班)试题
9 . 一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是
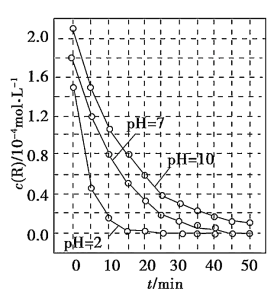

| A.在0-50min之间, pH =2和 PH= 7时 R 的降解百分率相等 |
| B.溶液酸性越强, R 的降解速率越小 |
| C.R的起始浓度越小,降解速率越大 |
| D.在 20-25min之间, pH =10时 R 的平均降解速率为 0.04mol·L-1·min-1 |
您最近一年使用:0次
2019-01-30更新
|
2383次组卷
|
44卷引用:甘肃省岷县第二中学2018-2019学年高二上学期期中考试化学试题
甘肃省岷县第二中学2018-2019学年高二上学期期中考试化学试题2012年普通高等学校招生全国统一考试理综化学部分(福建卷)(已下线)2012-2013学年吉林省长春市十一高中高二上学期期末考试化学试卷2015届湖北省襄阳市普通高中高三1月调研理综化学试卷2015-2016学年安徽省屯溪一中高二上期中测试化学试卷2015-2016学年安徽省合肥中科大附中高二下期中理科化学试卷2017届河北省沧州市第一中学高三上周测化学试卷2016-2017学年安徽师大附中高二上10月月考化学卷2016-2017学年湖北省武钢三中高二上月考一化学卷辽宁省大连育明高级中学2018届高三人教版选修四同步周测三化学试题浙江省金华市2018届高三9月十校联考化学试题重庆市巴蜀中学2017-2018学年高二10月月考化学试题河南省林州市第一中学2017-2018学年高二(火箭班)上学期期末考试化学试题(已下线)2018年9月20日 《每日一题》一轮复习-化学反应速率的计算与比较河南省鹤壁市淇县第一中学2018-2019学年高二(普通班)上学期第一次月考化学试题福建省泉州市泉港区第一中学2018-2019学年高二上学期期末考试化学试题【校级联考】浙江省温州新力量联盟2018-2019学年高二下学期期中考试化学试题步步为赢 高二化学寒假作业:作业五 化学平衡的图像分析浙江省桐乡市茅盾中学2020年高二(上)期末模拟卷(已下线)【南昌新东方】2018-2019 莲塘一中 高三11月 012鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第3节 化学反应的速率 课时2 影响化学反应速率的因素鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第3节 化学反应的速率高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时3 影响化学反应速率的因素综合分析黑龙江省哈尔滨市第六中学2020-2021学年高二10月月考化学试题福建省福州第一中学2020-2021学年高二上学期期中考试化学试题浙江省浙北G2(嘉兴一中、湖州中学)2020-2021学年高二上学期期中联考化学试题福建省连城县第一中学2020-2021学年高二上学期第二次月考化学(高考科)试题江西省抚州市金溪县第一中学2020-2021学年高二上学期第一次月考化学试题选择性必修1 专题2 第一单元 课时3 影响化学反应速率的因素综合分析重庆两江新区西大附中2021-2022学年高二上学期(秋季)开学考试化学试题黑龙江省哈尔滨市第六中学校2021-2022学年高二上学期10月阶段性总结化学试题辽宁省营口市普通高中2021-2022学年高三上学期期末教学质量检测化学试题山西省太原市第五中学2021-2022学年高一下学期5月阶段性检测化学试题北京市大兴区兴华中学2021-2022学年高三下学期月考化学试题山西省太原市第五实验中学2021-2022学年高一下学期5月阶段性检测化学试题湖南省长沙市长郡中学2022-2023学年高二上学期期中考试化学试题福建省晋江市第一中学2021-2022学年高二上学期期中考试化学试题安徽省怀宁县第二中学2021-2022学年高三上学期期末考试化学试题云南省昆明市昆明行知中学2021-2022学年高二上学期第一次质量检测(10月)化学试题陕西省西安市铁一中学2022-2023学年高一下学期期中考试化学试题广西柳州地区民族高级中学2022-2023学年高一下学期期中考试化学试题广东省台山市华侨中学2022-2023学年高一下学期期中考试化学试题福建省福州市六校2023-2024学年高二上学期期中联考化学试题福建省晋江市磁灶中学等校2022-2023学年高二上学期期中联考化学试题
名校
解题方法
10 . 影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。
①实验1、2研究的是_________ 对H2O2分解速率的影响。
②实验2、3的目的是_________ 对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:


①定性分析:如图甲可通过观察_________ ,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________ 。
②定量分析:如图乙所示,实验时以收集到40mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是_________ 。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:某同学认为KMnO4与H2C2O4的反应是_________ 热反应,导致_________ 。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
②实验2、3的目的是
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:


①定性分析:如图甲可通过观察
②定量分析:如图乙所示,实验时以收集到40mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:某同学认为KMnO4与H2C2O4的反应是
您最近一年使用:0次
2020-11-14更新
|
131次组卷
|
2卷引用:甘肃省张掖市第二中学2020-2021学年高二上学期期中考试化学试题



