名校
1 . 能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。
(1)用CO合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g) △H。在恒容的密闭容器中充入一定量的CO和H2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。
CH3OH(g) △H。在恒容的密闭容器中充入一定量的CO和H2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。

则T1___________ T2(填﹤、﹥或=);该正反应的△H___________ 0(填“<”、“>”或“=”);
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+H2O(g) =CO(g)+3H2(g) ΔH1=a kJ/mol
②CH4(g)+CO2(g) =2CO(g)+2H2(g) ΔH2=b kJ/mol
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H3
则反应③的△H3=___________ kJ/mol
(3)用CO2合成甲醇的反应原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H﹤0;
CH3OH(g)+H2O(g) △H﹤0;
在1L的密闭容器中,充入1mol CO2和3 molH2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
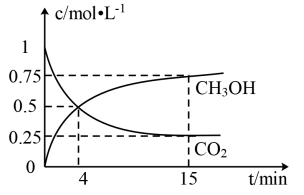
①反应进行到4 min 时,v(正)___________ (填“>”“<”或“=”)v(逆);0~4 min,CO2的平均反应速率v(CO2)=___________ mol·L-1·min-1;该温度下平衡常数为___________ 。
②下列能同时提高反应速率和H2转化率的措施是___________ 。
A.加入催化剂 B.增大H2的浓度 C.升高温度
D.分离出生成物 E.恒温恒容下,充入氦气 F.恒温下,减小容器容积
③下列能说明该反应已达到平衡状态的是___________ 。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1: 3 :1: 1
C.混合气体的摩尔质量不再变化
D.恒温恒容下,气体的密度不再变化
E.恒温恒容下,压强不再变化。
(4)利用甲醇燃料电池设计如下图所示的装置。
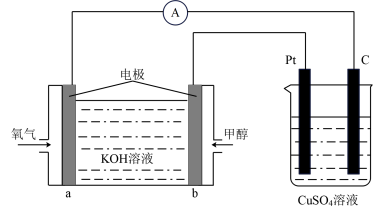
该装置中 Pt 极为___________ 极;写出a极的电极反应式___________ 。
(1)用CO合成甲醇的反应为:CO(g)+2H2(g)
 CH3OH(g) △H。在恒容的密闭容器中充入一定量的CO和H2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。
CH3OH(g) △H。在恒容的密闭容器中充入一定量的CO和H2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。
则T1
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+H2O(g) =CO(g)+3H2(g) ΔH1=a kJ/mol
②CH4(g)+CO2(g) =2CO(g)+2H2(g) ΔH2=b kJ/mol
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H3
则反应③的△H3=
(3)用CO2合成甲醇的反应原理为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H﹤0;
CH3OH(g)+H2O(g) △H﹤0; 在1L的密闭容器中,充入1mol CO2和3 molH2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

①反应进行到4 min 时,v(正)
②下列能同时提高反应速率和H2转化率的措施是
A.加入催化剂 B.增大H2的浓度 C.升高温度
D.分离出生成物 E.恒温恒容下,充入氦气 F.恒温下,减小容器容积
③下列能说明该反应已达到平衡状态的是
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1: 3 :1: 1
C.混合气体的摩尔质量不再变化
D.恒温恒容下,气体的密度不再变化
E.恒温恒容下,压强不再变化。
(4)利用甲醇燃料电池设计如下图所示的装置。

该装置中 Pt 极为
您最近一年使用:0次
23-24高三上·江西·阶段练习
名校
解题方法
2 . 某研究团队以NO和H2为原料,在Fe基催化下有效地合成NH3.回答下列问题:
已知:①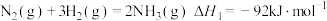
②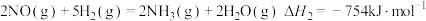
(1)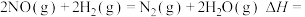
___________  。
。
(2)在一定温度下,向一恒容密闭容器中充入0.2molNO(g)和0.5molH2(g),只发生反应②,达到平衡时生成1.7gNH3(g)。下列叙述正确的是___________ (填标号)。
A.当容器内总压强不变时,该反应达到平衡
B.达到平衡时,反应体系放出的热量为37.7kJ
C.平衡后再充入0.2molNO(g)和0.5molH2(g),NO平衡转化率减小
(3)研究发现, 分两步进行:
分两步进行:
第1步: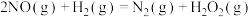 (慢反应);
(慢反应);
第2步:___________ (补充)(快反应)。
加入催化剂,主要是降低第___________ (填“1”或“2”)步反应活化能。
(4) 的反应速率方程式为
的反应速率方程式为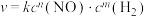 (其中,k为常数,只与温度和催化剂有关)。为了测定反应级数m、n,实验结果如下:
(其中,k为常数,只与温度和催化剂有关)。为了测定反应级数m、n,实验结果如下:
根据上述数据计算:m=___________ ,n=___________ ,c=___________ 。
(5)在一密闭反应器中充入2molNO(g)和5molH2(g),在催化剂10Fe﹣8Cu/TiO2作用下发生反应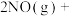
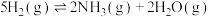 ,
, ,实验测得NO转化率和NH3选择性与温度的关系如图所示。
,实验测得NO转化率和NH3选择性与温度的关系如图所示。

温度高于350℃时,NO转化率增大,但NH3选择性降低,主要原因是___________ 。a点时生成NH3的物质的量为___________ (结果保留3位有效数字)。
(6)某温度下,保持总压强为100kPa,向反应器中充入2molNO(g)和6molH2(g),只发生反应:(a)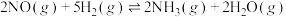 ,(b)
,(b) ,达到平衡时NO转化率为60%,NH3选择性为80%。反应(b)的平衡常数
,达到平衡时NO转化率为60%,NH3选择性为80%。反应(b)的平衡常数
___________  (计算结果保留三位有效数字)。
(计算结果保留三位有效数字)。
已知:①
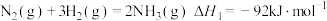
②
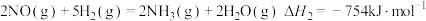
(1)
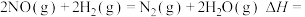
 。
。(2)在一定温度下,向一恒容密闭容器中充入0.2molNO(g)和0.5molH2(g),只发生反应②,达到平衡时生成1.7gNH3(g)。下列叙述正确的是
A.当容器内总压强不变时,该反应达到平衡
B.达到平衡时,反应体系放出的热量为37.7kJ
C.平衡后再充入0.2molNO(g)和0.5molH2(g),NO平衡转化率减小
(3)研究发现,
 分两步进行:
分两步进行:第1步:
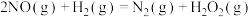 (慢反应);
(慢反应);第2步:
加入催化剂,主要是降低第
(4)
 的反应速率方程式为
的反应速率方程式为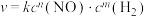 (其中,k为常数,只与温度和催化剂有关)。为了测定反应级数m、n,实验结果如下:
(其中,k为常数,只与温度和催化剂有关)。为了测定反应级数m、n,实验结果如下:| 序号 | 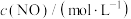 | 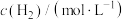 | 速率 |
| I | 0.1 | 0.1 | v |
| II | 0.2 | 0.1 | 4v |
| III | 0.2 | 0.2 | 8v |
| IV | c | 0.4 | 36v |
(5)在一密闭反应器中充入2molNO(g)和5molH2(g),在催化剂10Fe﹣8Cu/TiO2作用下发生反应
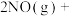
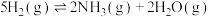 ,
, ,实验测得NO转化率和NH3选择性与温度的关系如图所示。
,实验测得NO转化率和NH3选择性与温度的关系如图所示。
温度高于350℃时,NO转化率增大,但NH3选择性降低,主要原因是
(6)某温度下,保持总压强为100kPa,向反应器中充入2molNO(g)和6molH2(g),只发生反应:(a)
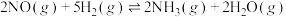 ,(b)
,(b) ,达到平衡时NO转化率为60%,NH3选择性为80%。反应(b)的平衡常数
,达到平衡时NO转化率为60%,NH3选择性为80%。反应(b)的平衡常数
 (计算结果保留三位有效数字)。
(计算结果保留三位有效数字)。
您最近一年使用:0次
2024-01-19更新
|
161次组卷
|
3卷引用:T16-原理综合题
名校
解题方法
3 . 为减少温室效应,可将CO2转化成其它可燃物质,如CH3OH等。探究CO2合成CH3OH的反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:I.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-48.5kJ•mol-1
II.CO(g)+2H2(g)=CH3OH(g) △H2=-92.4kJ•mol-1
Ⅲ.CO2(g)+H2(g)=CO(g)+H2O(g) △H3
回答下列问题:
(1)△H3=__ kJ•mol-1。
(2)已知:在一恒温、恒容密闭容器中充入1molCO2和3molH2,一定条件下发生反应I,测得CO2和CH3OH(g)的浓度随时间变化如图所示。请回答:
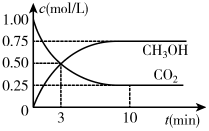
①达到平衡的时刻是__ min(填“3”或“10”)。
②能判断该反应达到化学平衡状态的依据是__ 。
a.容器压强不变
b.混合气体的平均摩尔质量不变
c.v(CH3OH)=v(H2O)
d.c(CH3OH)=c(H2O)
③为了提高H2的转化率,可采取__ (填“增大”或“减小”)CO2浓度的措施。
④该反应的平衡常数K=__ 。
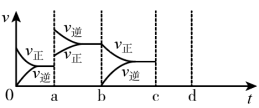
⑤如图表示在密闭容器中上述反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是__ ;b时改变的条件可能是__ 。
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,发生反应I、Ⅱ、Ⅲ,回答下列实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。
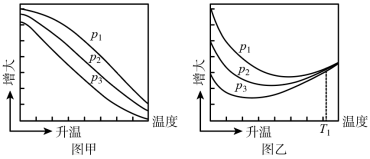
其中纵坐标表示CO2平衡转化率的是图__ (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为__ ;图乙中T1温度时,三条曲线几乎交于一点的原因是__ 。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为__ (填字母代号)。
(5)在一固定容积的密闭容器中进行反应Ⅲ:CO2(g)+H2(g) CO(g)+H2O(g),当温度为850℃时,K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
CO(g)+H2O(g),当温度为850℃时,K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
①此时上述的反应中正、逆反应速率的关系式是__ (填代号)。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
②在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率__ (“增大”、“减小”或“不变”);工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其可能原因是:__ 。
II.CO(g)+2H2(g)=CH3OH(g) △H2=-92.4kJ•mol-1
Ⅲ.CO2(g)+H2(g)=CO(g)+H2O(g) △H3
回答下列问题:
(1)△H3=
(2)已知:在一恒温、恒容密闭容器中充入1molCO2和3molH2,一定条件下发生反应I,测得CO2和CH3OH(g)的浓度随时间变化如图所示。请回答:

①达到平衡的时刻是
②能判断该反应达到化学平衡状态的依据是
a.容器压强不变
b.混合气体的平均摩尔质量不变
c.v(CH3OH)=v(H2O)
d.c(CH3OH)=c(H2O)
③为了提高H2的转化率,可采取
④该反应的平衡常数K=
⑤如图表示在密闭容器中上述反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是

(3)不同压强下,按照n(CO2):n(H2)=1:3投料,发生反应I、Ⅱ、Ⅲ,回答下列实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。

其中纵坐标表示CO2平衡转化率的是图
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为
| A.高温、高压 | B.高温、低压 | C.低温、高压 | D.低温、低压 |
 CO(g)+H2O(g),当温度为850℃时,K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
CO(g)+H2O(g),当温度为850℃时,K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见表:| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
①此时上述的反应中正、逆反应速率的关系式是
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
②在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率
您最近一年使用:0次
2021-12-19更新
|
159次组卷
|
3卷引用:广西壮族自治区南宁市邕宁高级中学2021-2022学年高二上学期期中考试化学(理科)试题
名校
解题方法
4 . 能源开发和利用是科学研究的热点课题。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
II.2CH3OH(g) CH3OCH3(g)+H2O(g) △H2
CH3OCH3(g)+H2O(g) △H2
III.CO(g)+H2O(g) CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
则3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H=
CH3OCH3(g)+CO2(g) △H=___________ (用含△H1、△H2、△H3的代数表示)。
(2)在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
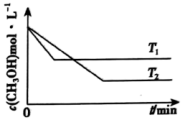
①△H___________ (填“>”“<”或“=”)0,说明理由___________ 。
②在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率___________ (填“增大”“减小”或“不变”)。
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g) CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为___________ 。
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡___________ (填“向左移动”、“向右移动”或“不移动”)。
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
II.CO(g)+2H2(g) CH3OH(g) △H2=-90.4 kJ·mol-1
CH3OH(g) △H2=-90.4 kJ·mol-1
III.CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为___________ mol·L-1(用含a、b、V的代数式表示,下同),反应III的平衡常数为___________ 。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g)
 CH3OH(g) △H1
CH3OH(g) △H1II.2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2
CH3OCH3(g)+H2O(g) △H2III.CO(g)+H2O(g)
 CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3则3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g) △H=
CH3OCH3(g)+CO2(g) △H=(2)在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
①△H
②在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)
 CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1II.CO(g)+2H2(g)
 CH3OH(g) △H2=-90.4 kJ·mol-1
CH3OH(g) △H2=-90.4 kJ·mol-1III.CO2(g)+H2(g)
 CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为
您最近一年使用:0次
2021-07-02更新
|
1670次组卷
|
7卷引用:广西河池市九校2020-2021学年高二下学期第二次联考化学试题
广西河池市九校2020-2021学年高二下学期第二次联考化学试题(已下线)第2章 化学反应速率和化学平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)重庆市缙云教育联盟2021-2022学年高三10月质量检测化学试题(已下线)2.2.3 影响化学平衡的因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第二章 化学反应速率与化学平衡(B卷·能力提升练)【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)河南宏力学校2021-2022学年高二上学期期中考试化学试题浙江省杭师大附中2022-2023学年高二上学期期中考试 化学试题
5 . 随着石油资源的日益枯竭,天然气的廾发利用越来越受到重视。CH4/CO2催化重整制备合成气(CO和H2)是温室气体CO2和CH4资源化利用的重要途径之一,并受了国内外研究人员的高度重视。回答下列问题:
(1)已知:①CH4(g)+H2O(g) CO(g)+3H2(g)△H1=+205.9 kJ·mol-1
CO(g)+3H2(g)△H1=+205.9 kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g)△H2=-41.2 kJ·mol-1
CO2(g)+H2(g)△H2=-41.2 kJ·mol-1
CH4/CO2催化重整反应为CH4(g)+CO2(g) 2CO(g)+2H2(g)△H
2CO(g)+2H2(g)△H
该催化重整反应的△H=______ kJ·mol-1。要缩短该反应达到平衡的时间并提高H2的产率可采取的措施为_____ 。
(2)向2L刚性密闭容器中充入2molCH4和2mol CO2进行催化重整反应,不同温度下平衡体系中CH4和CO的体积分数( )随温度变化如下表所示。
)随温度变化如下表所示。
已知b>a>c,则T1______ T2(填“>”“<”或“=”)。T1下该反应的平衡常数K=_______ (mol2·L-2)
(3)实验研究表明,载体对催化剂性能起着极为重要的作用,在压强0.03MPa,温度750℃条件下,载体对镍基催化剂性能的影响相关数据如下表:
由上表判断,应选择载体为_______ (填化学式),理由是________ 。
(4)现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均充入2mol CH4(g)和2 molCO2(g)进行反应,三个容器的反应压强分别为p1atm、p2atm、p3atm,在其他条件相同的情况下,反应均进行到tmin时,CO2的体积分数如图所示,此时I、Ⅱ、Ⅲ个容器中一定处于化学平衡状态的是_______ 。

(5)利用合成气为原料合成甲醇,其反应为CO(g)+2H2(g) CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
该反应速率的通式为ν正=k正cm(CO)·cn(H2)(k正是与温度有关的速率常数)。由表中数据可确定反应速率的通式中n=____ (取正整数)。若该温度下平衡时组别1的产率为25%,则组别1平衡时的v正=______ (保留1位小数)。
(1)已知:①CH4(g)+H2O(g)
 CO(g)+3H2(g)△H1=+205.9 kJ·mol-1
CO(g)+3H2(g)△H1=+205.9 kJ·mol-1②CO(g)+H2O(g)
 CO2(g)+H2(g)△H2=-41.2 kJ·mol-1
CO2(g)+H2(g)△H2=-41.2 kJ·mol-1CH4/CO2催化重整反应为CH4(g)+CO2(g)
 2CO(g)+2H2(g)△H
2CO(g)+2H2(g)△H该催化重整反应的△H=
(2)向2L刚性密闭容器中充入2molCH4和2mol CO2进行催化重整反应,不同温度下平衡体系中CH4和CO的体积分数(
 )随温度变化如下表所示。
)随温度变化如下表所示。φ 温度 | CH4 | CO |
| T1 | a | a |
| T2 | c | b |
(3)实验研究表明,载体对催化剂性能起着极为重要的作用,在压强0.03MPa,温度750℃条件下,载体对镍基催化剂性能的影响相关数据如下表:
催化剂 | 载体 | 转化率/% | 尾气组成/% | ||||
CH4 | CO2 | CH4 | CO2 | CO | H2 | ||
Ni | MgO | 99.3 | 87.7 | 0.8 | 6.8 | 50.3 | 42.1 |
CaO | 58.8 | 45.8 | 17.7 | 18.8 | 33.7 | 29.8 | |
CeO2 | 62.9 | 57.6 | 17.2 | 19.1 | 34.0 | 29.7 | |
(4)现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均充入2mol CH4(g)和2 molCO2(g)进行反应,三个容器的反应压强分别为p1atm、p2atm、p3atm,在其他条件相同的情况下,反应均进行到tmin时,CO2的体积分数如图所示,此时I、Ⅱ、Ⅲ个容器中一定处于化学平衡状态的是

(5)利用合成气为原料合成甲醇,其反应为CO(g)+2H2(g)
 CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:组别 | 起始浓度/(mol·L-1) | 初始速率/(mol·L-1·min-1) | |
CO | H2 | ||
1 | 0.24 | 0.48 | 0.361 |
2 | 0.24 | 0.96 | 0.720 |
3 | 0.48 | 0.48 | 0.719 |
您最近一年使用:0次
2019-04-21更新
|
608次组卷
|
3卷引用:广西自治区来宾市2020年4月份高三教学质量诊断理科综合化学试题
名校
解题方法
6 . 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)①已如:2SO2(g)+O2(g)⇌2SO3(g) △H=-196.6kJ•mol-1
2NO(g)+O2(g)⇌2NO2(g) △H=-113.0kJ•mol-1
请写出NO2与SO2反应生成SO3(g)和NO的热化学力程 式_________________________ 。
②一定条件下,将NO2与SO2以体积比1:2置于2L密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________ 。(填字母序号)
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO2的同时生成1mlINO2
(2)①工 业上一般以CO和H2为原料合成甲醇。该反应的热化学方程式为:CO(g)+2H2(B) CH3OH(g) △H=-99kJ•mol-1。则反应物的总能量
CH3OH(g) △H=-99kJ•mol-1。则反应物的总能量__________ (填高于、低于或者等于)生成物的总能量。
②在恒温条件下体积为2L的密闭容器中,将1mol CO与3molH2的混合气体在催化剂作用下发生反应生成甲醇。2min时制得生成CH3OH0.2mol,则0~2min的平均反应速率v(H2)=_________ 。CO 的转化率为_______ 。反应前后的压强比为____________ 。
③恒温恒容时,改变下列条件能加快以上反应的速率的是__________ (填字母序号)。
a.充入惰性气体 b.增加CO的量 C.升高温度 d.减小H2的量
(1)①已如:2SO2(g)+O2(g)⇌2SO3(g) △H=-196.6kJ•mol-1
2NO(g)+O2(g)⇌2NO2(g) △H=-113.0kJ•mol-1
请写出NO2与SO2反应生成SO3(g)和NO的热化学力程 式
②一定条件下,将NO2与SO2以体积比1:2置于2L密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO2的同时生成1mlINO2
(2)①工 业上一般以CO和H2为原料合成甲醇。该反应的热化学方程式为:CO(g)+2H2(B)
 CH3OH(g) △H=-99kJ•mol-1。则反应物的总能量
CH3OH(g) △H=-99kJ•mol-1。则反应物的总能量②在恒温条件下体积为2L的密闭容器中,将1mol CO与3molH2的混合气体在催化剂作用下发生反应生成甲醇。2min时制得生成CH3OH0.2mol,则0~2min的平均反应速率v(H2)=
③恒温恒容时,改变下列条件能加快以上反应的速率的是
a.充入惰性气体 b.增加CO的量 C.升高温度 d.减小H2的量
您最近一年使用:0次



