1 . (1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g) + 4NH3(g) 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是____________
a.反应速率 v( NH3) =v( N2) b.容器内压强不再随时间而发生变化 c.容器内 N2的物质的量分数不再随时间而发生变化 d.容器内 n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6 e.12molN-H 键断裂的同时生成 5mol N≡N 键 f.混合气体的总质量不随时间的变化而变化
②某次实验中测得容器内 NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是v(正)___________ v(逆)(填﹥、﹤或﹦),d 点对应的速率关系是v(正) ___________ v(逆) (填﹥、﹤或﹦)。

(2)已知:N≡N的键能为946kJ/mol, H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则N2与H2反应,生成1mol NH3过程中______ (填“吸收”或“放出”)的能量为_______ kJ。
(3)一定条件下,在 5 L密闭容器内,反应 2NO2(g) N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
①用 N2O4 表示 0~2 s 内该反应的平均速率为________ mol•L-1•s-1。在第 5s 时,NO2的转化率为___________ 。
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是______________ 。
③为加快反应速率,可以采取的措施是_______
a.升高温度 b.恒容时充入He气 c.恒压时充入He气 d.恒容时充入NO2
 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。①能说明该反应已达到平衡状态的标志是
a.反应速率 v( NH3) =v( N2) b.容器内压强不再随时间而发生变化 c.容器内 N2的物质的量分数不再随时间而发生变化 d.容器内 n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6 e.12molN-H 键断裂的同时生成 5mol N≡N 键 f.混合气体的总质量不随时间的变化而变化
②某次实验中测得容器内 NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是v(正)

(2)已知:N≡N的键能为946kJ/mol, H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则N2与H2反应,生成1mol NH3过程中
(3)一定条件下,在 5 L密闭容器内,反应 2NO2(g)
 N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
①用 N2O4 表示 0~2 s 内该反应的平均速率为
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是
③为加快反应速率,可以采取的措施是
a.升高温度 b.恒容时充入He气 c.恒压时充入He气 d.恒容时充入NO2
您最近一年使用:0次
解题方法
2 . 一定温度下,将6 mol A和5 mol B混合,充入2 L密闭容器中,发生反应: 3A(g)+B(g) xC(g)+2D(g),经5秒钟后生成1 mol D,并测得此时C的浓度为0.5mol•L-1。下列有关叙述正确的是( )
xC(g)+2D(g),经5秒钟后生成1 mol D,并测得此时C的浓度为0.5mol•L-1。下列有关叙述正确的是( )
 xC(g)+2D(g),经5秒钟后生成1 mol D,并测得此时C的浓度为0.5mol•L-1。下列有关叙述正确的是( )
xC(g)+2D(g),经5秒钟后生成1 mol D,并测得此时C的浓度为0.5mol•L-1。下列有关叙述正确的是( )| A.此时A的浓度为2 mol·L-1 | B.x的值为1 |
| C.B的转化率为20% | D.反应速率v(D)=0.1mol•L-1•s-1 |
您最近一年使用:0次
名校
3 . 已知一定质量的锌粒与稀盐酸反应,生成H2的浓度与反应时间的关系如图所示,下列结论不正确的是


| A.若将锌粒改为锌粉,可加快产生H2的反应速率 |
| B.反应前4min内温度对反应速率的影响比浓度大 |
| C.反应开始2min内平均反应速率最大 |
| D.反应前4min内生成H2的平均速率v(H2)=0.09mol·L-1·min-1 |
您最近一年使用:0次
2020-06-16更新
|
383次组卷
|
8卷引用:广州市海珠区2019—2020学年高一下学期期末教学质量监测化学试题
广州市海珠区2019—2020学年高一下学期期末教学质量监测化学试题河南省平顶山市郏县第一高级中学2017-2018学年高二上学期第一次月考化学试题福建省莆田第一中学2019-2020学年高一下学期期中考试化学试题河南省安阳市林州市第一中学2020-2021学年高二上学期开学考试(实验班)化学试题(已下线)2.2 影响化学反应速率的因素(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)2.2+影响化学反应速率的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)四川省广安友谊中学高2020-2021学年高一下学期6月月考化学试题江西省宁冈中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
4 . 将 N2、H2 的混合气体分别充入甲、乙、丙三个容器中,进行N2 + 3H2 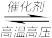 2NH3的反应,测得反应速率分别为:甲:v(H2)=1 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率
2NH3的反应,测得反应速率分别为:甲:v(H2)=1 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率
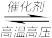 2NH3的反应,测得反应速率分别为:甲:v(H2)=1 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率
2NH3的反应,测得反应速率分别为:甲:v(H2)=1 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率| A.v(甲)>v(乙)>v(丙) | B.v(乙)>v(丙)>v(甲) |
| C.v(丙)>v(甲)>v(乙) | D.v(乙)>v(甲)>v(丙) |
您最近一年使用:0次
2020-06-16更新
|
306次组卷
|
10卷引用:广东省揭阳市揭西县河婆中学2019-2020学年高一下学期期末考试化学试题
广东省揭阳市揭西县河婆中学2019-2020学年高一下学期期末考试化学试题【全国百强校】贵州省铜仁市第一中学2018-2019学年高二上学期期末考试化学试题福建省福州市福州三中 2018-2019 学年高一下学期期中考试化学试题课时1 化学反应的快慢——A学习区 夯实基础(鲁科版(2019)第二册)课时1 化学反应的快慢——A学习区 夯实基础(鲁科版必修2)甘肃省甘南藏族自治州合作第一中学2018-2019学年高一下学期期中考试化学试题课时1 化学反应速率——A学习区 夯实基础(苏教版必修2)安徽省合肥市第十一中学2019-2020学年高一下学期第三次月考化学试题新疆维吾尔自治区阿克苏地区第二中学2021-2022学年高一年级下学期第二次月考化学试题四川省泸县第四中学2022-2023学年高一下学期6月期末考试化学试题
名校
解题方法
5 . 在2L容积不变的容器中,发生N2+3H2⇌2NH3的反应.现通入4molH2和4molN2,10s内用H2表示的反应速率为0.12mol/(L•s),则10s后容器中N2的物质的量是
| A.3.6mol | B.3.2mol | C.2.8mol | D.1.6mol |
您最近一年使用:0次
2020-06-15更新
|
645次组卷
|
27卷引用:广东省佛山市顺德区2018-2019学年高一下学期期末化学试题
广东省佛山市顺德区2018-2019学年高一下学期期末化学试题广东省广州市第八十九中学2021-2022学年高一上学期期中考试化学试题(已下线)2010—2011学年江苏省姜堰市高一下学期期中考试化学试卷(已下线)2010—2011学年山西省平遥中学高一下学期期中考试化学试卷(已下线)2010-2011学年安徽省肥西农兴中学高一下学期期中考试化学试卷(已下线)2012年人教版高中化学必修二第二章 化学反应与能量练习卷2014-2015学年云南省玉溪市第一中学高一下期末化学试卷2015-2016学年河北省广平县一中高一下学期期中考试化学试卷2016-2017学年湖北省沙市中学高一下学期第三次双周考(A卷)化学试卷高中化学人教版 必修2 第二章 化学反应与能量 第三节 化学反应的速率和限度 化学反应的限度山西省祁县中学2017-2018学年高一下学期第一次月考化学试题山东省惠民县第一中学2018-2019学年高一下学期联考化学试题湖北省公安县车胤中学2018-2019学年高一(选考班)下学期期中考试化学试题吉林省吉林市第三中学2018-2019学年高一5月阶段测试化学试题宁夏石嘴山市第三中学2018-2019学年高一下学期期末考试化学试题辽宁省凌源市第三中学2019-2020学年高二下学期第一次月考化学试题黑龙江省大庆中学2019-2020学年高一下学期期中考试化学试题辽宁省锦州市凌海市第三高级中学2019-2020学年高一6月月考化学试题河北省石家庄市第二中学2019-2020高一下期末考试化学模拟试题(三)山西省朔州市怀仁县大地学校2019-2020学年高一下学期期末考试化学试题陕西省咸阳市武功县2020-2021学年高二上学期期中考试化学试题四川省平昌县驷马中学2020-2021学年下学期高二第一次月考化学试题福建省泉州科技中学2020-2021学年高一下学期第一次月考化学试题宁夏长庆高级中学2020-2021学年高一下学期期末考试化学试题湖南省长沙市长郡中学2019-2020学年高二上学期入学考试化学试题江苏省宿迁市沭阳县潼阳中学2021-2022学年高一3月阶段测试化学试题广西龙胜各族自治县龙胜中学2021-2022学年高一下学期期中考试化学试题
名校
解题方法
6 . 将等物质的量的A、B 混合于 2L 的密闭容器中,发生下列反应:3A(g)+B(g)⇌ xC(g) +2D(g),经2min 后测得D 的浓度为 0.5mol·L-1,c(A)∶c(B)=3∶5,以 C 表示的平均速率 v(C)=0.25mol·L-1·min-1,下列说法正确的是
| A.该反应方程式中,x=2 | B.2 min 时,A 的转化率为 50% |
| C.2 min 时,A 的物质的量为 0.75mol | D.反应速率 v(B)=0.25 mol·L-1·min-1 |
您最近一年使用:0次
2020-06-14更新
|
220次组卷
|
2卷引用:广东省深圳市宝安中学高中部2020-2021学年高一下学期期中考试化学试卷
7 . 氯气是一种重要的化工原料,从氯气的发现到氯元素的确认,经历了数位科学家30多年的不懈探索,根据相关信息,回答下列问题:
(1)化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合并加热,很快产生有强烈刺激性气味的黄绿色气体,完成该反应的化学方程式:MnO2+4HCl(浓) MnCl2+Cl2↑+
MnCl2+Cl2↑+___ 。最合理的氯气发生装置是_______ (填字母)。

(2)化学家贝托莱将Cl2的水溶液露置在阳光下,反应生成一种无色无味气体,该气体为_____ 。
(3)化学家泰耐特将Cl2通入石灰乳中,得到一种具有漂白作用的混合液。为证明该混合液的漂白作用,进行如下实验(试剂、材料等任选),完成下表中的空白。
(4)我国学者近年研究了铜基催化剂作用下的反应:4HCl+O2 2H2O+2Cl2,保持其他条件不变,温度为T1和T2时,HCl的反应速率v(HCl)随HCl的转化率
2H2O+2Cl2,保持其他条件不变,温度为T1和T2时,HCl的反应速率v(HCl)随HCl的转化率 (HCl)的变化示意图如下图所示,据图回答:
(HCl)的变化示意图如下图所示,据图回答:

①T1____ T2(填“>”、“<”、“=”);
②在同一温度下, (HCl)越大,v(HCl)越
(HCl)越大,v(HCl)越_____ (填“大”或“小”)。
(1)化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合并加热,很快产生有强烈刺激性气味的黄绿色气体,完成该反应的化学方程式:MnO2+4HCl(浓)
 MnCl2+Cl2↑+
MnCl2+Cl2↑+
(2)化学家贝托莱将Cl2的水溶液露置在阳光下,反应生成一种无色无味气体,该气体为
(3)化学家泰耐特将Cl2通入石灰乳中,得到一种具有漂白作用的混合液。为证明该混合液的漂白作用,进行如下实验(试剂、材料等任选),完成下表中的空白。
| 实验步骤 | 实验现象 | 实验结论 |
| 取 | | 该混合液具有漂白作用 |
(4)我国学者近年研究了铜基催化剂作用下的反应:4HCl+O2
 2H2O+2Cl2,保持其他条件不变,温度为T1和T2时,HCl的反应速率v(HCl)随HCl的转化率
2H2O+2Cl2,保持其他条件不变,温度为T1和T2时,HCl的反应速率v(HCl)随HCl的转化率 (HCl)的变化示意图如下图所示,据图回答:
(HCl)的变化示意图如下图所示,据图回答:
①T1
②在同一温度下,
 (HCl)越大,v(HCl)越
(HCl)越大,v(HCl)越
您最近一年使用:0次
名校
解题方法
8 . 反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1
②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1
④v(D)=0.5 mol·L-1·s-1
下列有关反应速率的比较中正确的是
①v(A)=0.45 mol·L-1·min-1
②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1
④v(D)=0.5 mol·L-1·s-1
下列有关反应速率的比较中正确的是
| A.④>③=②>① | B.①>④>③=② |
| C.①>②>③>④ | D.④>③>②>① |
您最近一年使用:0次
2020-06-14更新
|
310次组卷
|
29卷引用:广东省湛江市雷州市第二中学2020-2021学年高二上学期第一次月考化学试题
广东省湛江市雷州市第二中学2020-2021学年高二上学期第一次月考化学试题2015-2016学年吉林省实验中学高一下期末化学试卷(已下线)2018年12月24日 《每日一题》人教选修4-化学反应速率大小的比较【校级联考】湖南省湘西自治州四校2018-2019学年高二上学期12月联考化学试题【全国百强校】湖南省衡阳市第一中学2018-2019学年高二上学期期末考试化学试题【全国百强校】河北省张家口市第一中学2018-2019学年高一下学期期中考试化学试题2江苏省沭阳县修远中学2018-2019学年高一下学期第二次月考(实验班)化学试题(已下线)第13天 化学反应速率的计算——《2019年暑假作业总动员》高二化学黑龙江省双鸭山市第一中学2019-2020学年高二上学期第一次月考化学试题河北省石家庄二中雄安校区-河北安新中学2019-2020学年高二上学期期中考试化学试题黑龙江省绥化市安达市第七中学2019-2020学年高二上学期期中考试化学试题黑龙江省哈尔滨市阿城区龙涤中学校2019-2020学年高二上学期期中考试化学试题甘肃省古浪县第二中学2019-2020学年高二上学期基础知识竞赛化学试题夯基提能2020届高三化学选择题对题专练——选修四化学反应原理——化学反应速率(提升练习)江西省赣州市蓉江新区潭口中学2019-2020学年高二下学期第一次月考化学试题福建省建瓯市芝华中学2019-2020学年高一下学期居家学习检测化学试题(已下线)【南昌新东方】江西省九江第一中学2018-2019学年高二上学期第二次月考化学试题河北省石家庄市第二中学2019-2020学年高一下学期期末考试化学试题黑龙江省哈尔滨市第一中学校2019-2020学年高一下学期期末考试化学试题山西省忻州市第一中学2020-2021学年高二上学期开学考试化学试题吉林省吉林市第二中学2021届高三上学期9月份考试化学试题安徽省安庆市宿松县程集中学2019-2020学年高二下学期6月月考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 易错疑难集训(二)陕西省黄陵中学2020-2021学年高二(本部)上学期期中考试化学试题四川省自贡市富顺一中2020—2021学年度高二上学期期中考试化学试题(已下线)练习5 化学反应速率-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)河北省衡水市第十四中学2020-2021学年高二上学期三调考试(校内)化学试题湖南省长沙市明德中学2020-2021学年高二上学期第三次月考化学试题吉林省汪清县第六中学2020-2021学年高二上学期期末考试化学试题
名校
解题方法
9 . 一定条件下反应2SO2(g)+O2(g) 2SO3(g)在恒容密闭容器中进行,从反应开始至10s时,O2的浓度减少了0.3mol·L-1。则0~10s内平均反应速率为
2SO3(g)在恒容密闭容器中进行,从反应开始至10s时,O2的浓度减少了0.3mol·L-1。则0~10s内平均反应速率为
 2SO3(g)在恒容密闭容器中进行,从反应开始至10s时,O2的浓度减少了0.3mol·L-1。则0~10s内平均反应速率为
2SO3(g)在恒容密闭容器中进行,从反应开始至10s时,O2的浓度减少了0.3mol·L-1。则0~10s内平均反应速率为| A.v(O2)=0.03mol·L-1·s-1 | B.v(O2)=0.3mol·L-1·s-1 |
| C.v(SO2)=0.03mol·L-1·s-1 | D.v(SO3)=0.03mol·L-1·s-1 |
您最近一年使用:0次
2020-06-13更新
|
418次组卷
|
9卷引用:2019年6月广东省普通高中学业水平考试化学试题
名校
解题方法
10 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=
2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=__________ 。平衡时H2的转化率为__________ %。
(2)平衡后,若提高H2的转化率,可以采取的措施有__________ 。
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g) 2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1__________ K2(填“<”“>”或“=”);
②400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为__________ 。当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正__________ v(N2)逆(填“<”“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是__________ 。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g)
 2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=
2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=(2)平衡后,若提高H2的转化率,可以采取的措施有
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)
 2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
②400℃时,反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
您最近一年使用:0次
2020-06-13更新
|
1377次组卷
|
4卷引用:广东省湛江市第二十一中学2019-2020学年高二上学期期中考试化学试题



