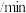解题方法
1 . 为倡导“节能减排”和“低碳经济”,降低大气中CO2含量及有效地开发利用CO2,工业上可用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入1molCO2、3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。经测得CO2和CH3OH的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CO2和CH3OH的物质的量随时间变化如图所示。
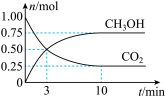
(1)写出该反应的化学平衡常数表达式:K=________ 。
(2)在3min末,反应速率v(正)________ v(逆)(选填>、<或=)。
(3)从反应开始到平衡,平均反应速率v(CO2)=_________ 。达到平衡时,H2的转化率为________ 。
(4)下列措施可以加快反应速率的是________ 。
(5)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为:甲:v(H2)=0.45mol•L-1•s-1;乙:v(CO2)=0.2mol•L-1•s-1;丙:v(CH3OH)=6mol•L-1•min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为________ 。
 CH3OH(g)+H2O(g)。经测得CO2和CH3OH的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CO2和CH3OH的物质的量随时间变化如图所示。
(1)写出该反应的化学平衡常数表达式:K=
(2)在3min末,反应速率v(正)
(3)从反应开始到平衡,平均反应速率v(CO2)=
(4)下列措施可以加快反应速率的是
| A.升高温度 | B.加入催化剂 | C.增大压强 | D.及时分离出CH3OH |
(5)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为:甲:v(H2)=0.45mol•L-1•s-1;乙:v(CO2)=0.2mol•L-1•s-1;丙:v(CH3OH)=6mol•L-1•min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为
您最近一年使用:0次
2023-10-08更新
|
95次组卷
|
2卷引用:浙江省浙南名校联盟2023-2024学年高二上学期10月联考化学试题
解题方法
2 . 在相同条件下研究催化剂Ⅰ、Ⅱ对反应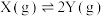 的影响,各物质浓度c随反应时间t的部分变化曲线如图,则下列说法
的影响,各物质浓度c随反应时间t的部分变化曲线如图,则下列说法不正确 的是

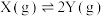 的影响,各物质浓度c随反应时间t的部分变化曲线如图,则下列说法
的影响,各物质浓度c随反应时间t的部分变化曲线如图,则下列说法
A.当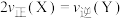 时,说明该反应已经达到平衡状态 时,说明该反应已经达到平衡状态 |
| B.与催化剂Ⅰ相比,使用催化剂Ⅱ反应活化能更高 |
C.使用催化剂Ⅱ时,0~2min内, |
| D.a曲线表示使用催化剂Ⅰ时X的浓度随t的变化 |
您最近一年使用:0次
解题方法
3 . 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。298.15K 时,N2、H2与 NH3 的平均能量与合成氨反应的活化能的曲线图如下所示,据图回答问题:

(1)若反应中生成 2 mol 氨气,则反应___________ (填“吸热”或 “放热”) ___________ kJ
(2)图中曲线___________ (填“a”或“b”)表示加入催化剂的能量变化曲线,催化剂能加快反应速率的原理:___________ ;
(3)目前合成氨工业广泛采用的反应条件是 500℃、20~50MPa、铁触媒作催化剂,反应转化率不超过 50%。工业上为了进一步提高氨气的产率,你认为下列措施经济可行的是:___________ ;
(4)合成氨所需的氢气可由甲烷与水反应制得,发生反应 ;在一定温度下,在体积为 1L 的容器中发生上述反应,各物质的物质的量浓度变化如下
;在一定温度下,在体积为 1L 的容器中发生上述反应,各物质的物质的量浓度变化如下
①表中 x= ___________ mol/L;前 2min 内 CH4 的平均反应速率为 ___________
②下列不能作为反应达到平衡的判据是___________ 。
A.气体的压强不变 B.v 正(CH4)=v 逆(CO) C.K 不变
D.容器内气体的密度不变 E.断开 1molH-O 键同时断开 3molH-H 键

(1)若反应中生成 2 mol 氨气,则反应
(2)图中曲线
(3)目前合成氨工业广泛采用的反应条件是 500℃、20~50MPa、铁触媒作催化剂,反应转化率不超过 50%。工业上为了进一步提高氨气的产率,你认为下列措施经济可行的是:___________ ;
| A.升高反应温度,让更多的分子变成活化分子 |
| B.降低反应温度,让反应向着有利于氨气生成的方向进行 |
| C.将液氨及时从反应体系中分离出来 |
| D.寻求能在更低的温度下有很强催化活性的新型催化剂 |
(4)合成氨所需的氢气可由甲烷与水反应制得,发生反应
 ;在一定温度下,在体积为 1L 的容器中发生上述反应,各物质的物质的量浓度变化如下
;在一定温度下,在体积为 1L 的容器中发生上述反应,各物质的物质的量浓度变化如下| t/min | CH4(mol/L) | H2O(mol/L) | CO(mol/L) | H2(mol/L) |
| 0 | 0.2 | 0.3 | 0 | 0 |
| 2 | n1 | n2 | n3 | 0.3 |
| 3 | n1 | n2 | n3 | 0.3 |
| 4 | 0.09 | 0.19 | x | 0.33 |
②下列不能作为反应达到平衡的判据是
A.气体的压强不变 B.v 正(CH4)=v 逆(CO) C.K 不变
D.容器内气体的密度不变 E.断开 1molH-O 键同时断开 3molH-H 键
您最近一年使用:0次
名校
4 . 在 中,表示该反应速率最快的是
中,表示该反应速率最快的是
 中,表示该反应速率最快的是
中,表示该反应速率最快的是| A.v(A)=0.5mol•L-1•min-1 | B.v(B)=1.2mol•L-1•min-1 |
| C.v(C)=0.9mol•L-1•min-1 | D.v(D)=1mol•L-1•min-1 |
您最近一年使用:0次
2023-10-07更新
|
42次组卷
|
2卷引用:浙江省杭州市精诚联盟2023-2024学年高二上学期10月月考化学试题
解题方法
5 . 请根据要求回答相关问题:
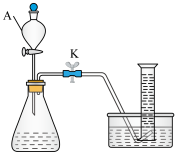
I.某小组用下图装置探究H2C2O₄溶液与酸性KMnO4溶液的反应(夹持装置略去)。
(1)仪器A的名称为___________ 。
(2)H2C2O4溶液与酸性KMnO4溶液反应的离子方程式为___________ 。
(3)若以单位时间内生成的气体体积作为反应速率的观测指标,则量筒中最佳试剂为___________。
Ⅱ.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
(4)①T1=___________ ;V2=___________ 。
②若t1<8,则由此实验可以得出的结论是___________ 。
③忽略溶液体积的变化,利用实验②中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v=___________ 。(保留3个有效数字)
④H2C2O4溶液与酸性KMnO4溶液生成的Mn2+对该反应有催化作用。请以实验1为对照组,设计实验方案证明Mn2+的催化作用___________ 。

I.某小组用下图装置探究H2C2O₄溶液与酸性KMnO4溶液的反应(夹持装置略去)。
(1)仪器A的名称为
(2)H2C2O4溶液与酸性KMnO4溶液反应的离子方程式为
(3)若以单位时间内生成的气体体积作为反应速率的观测指标,则量筒中最佳试剂为___________。
| A.饱和NaHCO3溶液 | B.饱和NaCl溶液 |
| C.水 | D.饱和Na2CO3溶液 |
Ⅱ.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
| 实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
| 酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol/L | V/mL | c/mol/L | V/mL | |||
| ① | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
| ② | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| ③ | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(4)①T1=
②若t1<8,则由此实验可以得出的结论是
③忽略溶液体积的变化,利用实验②中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v=
④H2C2O4溶液与酸性KMnO4溶液生成的Mn2+对该反应有催化作用。请以实验1为对照组,设计实验方案证明Mn2+的催化作用
您最近一年使用:0次
名校
6 . 对利用甲烷消除 污染进行研究,
污染进行研究,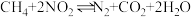 。在
。在 密闭容器中,控制不同温度,分别加入
密闭容器中,控制不同温度,分别加入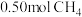 和
和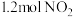 ,测得
,测得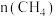 随时间变化的有关实验数据见下表。下列说法正确的是
随时间变化的有关实验数据见下表。下列说法正确的是
 污染进行研究,
污染进行研究,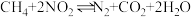 。在
。在 密闭容器中,控制不同温度,分别加入
密闭容器中,控制不同温度,分别加入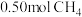 和
和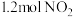 ,测得
,测得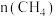 随时间变化的有关实验数据见下表。下列说法正确的是
随时间变化的有关实验数据见下表。下列说法正确的是| 组别 | 温度 | 时间  | 0 | 10 | 20 | 40 | 50 |
| ① |  | 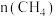 | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| ② |  | 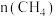 | 0.50 | 0.30 | 0.18 | 0.15 |
A.组别1中,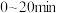 内, 内, 的降解速率为 的降解速率为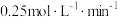 |
B.由实验数据可知实验控制的温度 |
C.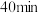 时,表格中 时,表格中 对应反应已经达到平衡状态 对应反应已经达到平衡状态 |
D.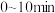 内, 内, 的降解速率①>② 的降解速率①>② |
您最近一年使用:0次
2023-10-02更新
|
141次组卷
|
24卷引用:浙江省丽水市四校2018-2019学年高一下学期期中化学试题
浙江省丽水市四校2018-2019学年高一下学期期中化学试题高一必修第二册(人教2019版)全书综合训练河北省安平中学2020-2021学年高二上学期第一次月考化学试题黑龙江省鹤岗市第一中学2021届高三上学期第二次月考化学试题江苏省海安市2020-2021学年高二上学期期中考试化学试题江西省景德镇市昌江区景德镇一中2020-2021学年高二上学期期中考试化学试题(1班)山东师范大学附属中学2020-2021学年高一下学期期中学分认定考试化学(等级考)试题河北省任丘一中2021-2022学年高二上学期开学考试化学试题江苏省盐城市阜宁中学等四校2021-2022学年高一下学期期中考试化学试题江苏省南京市六校联合体2021-2022高一下学期期中考试化学试题山东省泰安市2021-2022学年高一下学期期末考试化学试题黑龙江省齐齐哈尔市恒昌中学校2021-2022学年高二上学期期中考试化学试题四川省成都市东部新区养马高级中学2022-2023学年高二上学期期中考试化学试题江苏省南通市海安高级中学2022-2023学年高一下学期第一次月考化学试题福建省福州格致中学2022-2023学年高一下学期期中考试化学试题河北省正定中学2022-2023学年高一下学期第二次月考化学试题黑龙江省牡丹江市第一高级中学2022-2023学年高一下学期5月期中考试化学试题安徽省亳州市第二完全中学2022-2023学年高一下学期期中考试化学试题(特培班)江西省九江市德安县第一中学2022-2023学年高一下学期5月期中考试化学试题江苏省南通市通州区金沙中学2021-2022学年高二上学期第一次调研考试化学试题云南省下关第一中学2023-2024学年高二上学期9月月考化学试题江苏省常州高级中学2023~2024 学年高二上学期10月阶段检测化学试题湖北省黄州中学(黄冈市外国语学校)2023-2024学年高二上学期9月月考化学试题阶段重点练(四)
名校
解题方法
7 . 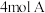 气体和
气体和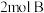 气体在
气体在 的容器中混合并在一定条件下发生如下反应:
的容器中混合并在一定条件下发生如下反应: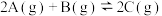 。若经
。若经 后测得C的浓度为
后测得C的浓度为 ,现有下列几种说法:
,现有下列几种说法:
①用物质A表示的反应平均速率为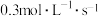
②用物质B表示的反应的平均速率为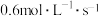
③ 时物质A的转化率为70%
时物质A的转化率为70%
④ 时物质B的浓度为
时物质B的浓度为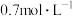
其中正确的是
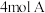 气体和
气体和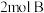 气体在
气体在 的容器中混合并在一定条件下发生如下反应:
的容器中混合并在一定条件下发生如下反应: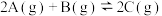 。若经
。若经 后测得C的浓度为
后测得C的浓度为 ,现有下列几种说法:
,现有下列几种说法:①用物质A表示的反应平均速率为
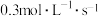
②用物质B表示的反应的平均速率为
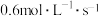
③
 时物质A的转化率为70%
时物质A的转化率为70%④
 时物质B的浓度为
时物质B的浓度为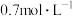
其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
您最近一年使用:0次
2023-09-17更新
|
439次组卷
|
10卷引用:浙江省舟山中学2021-2022学年高一下学期学考考前质量检测化学试题
浙江省舟山中学2021-2022学年高一下学期学考考前质量检测化学试题北京市顺义区牛栏山第一中学2021-2022学年高一下学期阶段性检测化学试题(已下线)第12练 用“三段式”模型突破化学平衡的计算-2022年【暑假分层作业】高二化学(2023届一轮复习通用) 河南大学附属中学2022-2023学年高一下学期期中考试 化学试题广东省佛山市三水中学2022-2023学年高二上学期10月第一次统测化学试题北京市育才学校2023-2024学年高二上学期10月月考化学试题广东省松湖莞中、深大附中两校2023-2024学年高二上学期10月联考化学试题陕西省西安市鄠邑区2023-2024学年高二上学期期中质量检测化学试题海南省海口市第一中学2023-2024学年高三上学期期末考试化学试题(非重点班)河南省濮阳市南乐县第一高级中学2023-2024学年高一下学期模拟预测化学试题
8 . 在某恒容的密闭容器中发生反应: ,在200℃和T℃时,X的浓度(mol/L)随时间变化的有关实验数据见下表,下列有关叙述正确的是
,在200℃和T℃时,X的浓度(mol/L)随时间变化的有关实验数据见下表,下列有关叙述正确的是
 ,在200℃和T℃时,X的浓度(mol/L)随时间变化的有关实验数据见下表,下列有关叙述正确的是
,在200℃和T℃时,X的浓度(mol/L)随时间变化的有关实验数据见下表,下列有关叙述正确的是| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 200℃ | 0.80 | 0.55 | 0.35 | 0.20 | 0.15 | 0.15 |
| T℃ | 1.00 | 0.65 | 0.35 | 0.18 | 0.18 | 0.18 |
| A.在200℃下,0~4min内用Y表示的化学反应速率为0.1125 mol•L﹣1•min﹣1 |
| B.根据上表内数据可得出结论,其它条件相同,反应物浓度越大,反应速率越大 |
| C.在T℃下,6min时反应刚好达到平衡状态 |
| D.从表中可知:T<200℃ |
您最近一年使用:0次
2023-09-17更新
|
62次组卷
|
2卷引用:浙江省海宁市高级中学2022-2023学年高二上学期10月月考化学试题
名校
9 . T℃时,在2L恒容密闭容器中进行反应:X(g)+Y(g)→Z(g)(未配平)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是
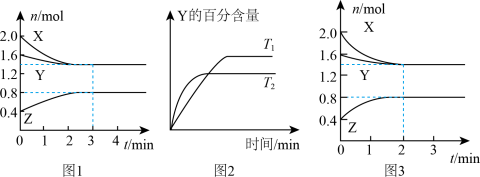

A.反应方程式为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.0~3min,反应速率v(Z)=0.067mol∙L-1∙min-1 |
| C.其他条件不变,升高温度,化学平衡正向移动 |
| D.如图3所示的反应进程,改变的条件可能是增大压强 |
您最近一年使用:0次
2023-09-17更新
|
174次组卷
|
2卷引用:浙江省海宁市高级中学2022-2023学年高二上学期10月月考化学试题
名校
解题方法
10 . 下列说法不正确的是
A.汽车尾气净化反应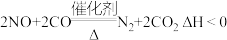 ,常温下不能自发进行 ,常温下不能自发进行 |
| B.“冰,水为之而寒于水”说明相同质量的水和冰,水的焓更高 |
| C.酸碱中和的反应热与焓变几乎无差异,而黑火药爆炸的反应热与焓变差异较大 |
| D.利用溶液的颜色变化与浓度的定量关系可以测量化学反应速率 |
您最近一年使用:0次
2023-09-17更新
|
121次组卷
|
2卷引用:浙江省海宁市高级中学2022-2023学年高二上学期10月月考化学试题