名校
解题方法
1 . 在恒温恒容条件下,发生反应2A(g)+xB(g) 2C(g),反应体系中某物质的浓度c随时间的变化如图中曲线甲、乙所示,已知x为整数。下列说法不正确的是
2C(g),反应体系中某物质的浓度c随时间的变化如图中曲线甲、乙所示,已知x为整数。下列说法不正确的是
 2C(g),反应体系中某物质的浓度c随时间的变化如图中曲线甲、乙所示,已知x为整数。下列说法不正确的是
2C(g),反应体系中某物质的浓度c随时间的变化如图中曲线甲、乙所示,已知x为整数。下列说法不正确的是
| A.x=3 |
| B.曲线甲表示的是物质B在反应进程中的浓度变化 |
| C.10~30min内v(C)=0.05mol·L-1·min-1 |
| D.当混合气体的密度不再随时间的变化而变化,不能说明该反应达到平衡 |
您最近一年使用:0次
名校
解题方法
2 . 反应 ,经2min,B的浓度减少
,经2min,B的浓度减少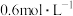 。对该反应速率的表示,下列说法正确的是
。对该反应速率的表示,下列说法正确的是
 ,经2min,B的浓度减少
,经2min,B的浓度减少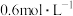 。对该反应速率的表示,下列说法正确的是
。对该反应速率的表示,下列说法正确的是A.用固体A表示的反应速率是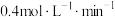 |
| B.用B、C、D表示的反应速率之比为3∶2∶1 |
C.在2min末,用B表示的反应速率是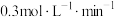 |
| D.用B、C表示该反应的反应速率大小不同,意义也不同 |
您最近一年使用:0次
3 . 某小组利用不同膜反应器(可选择性地让某些气体通过而离开体系)研究HI的分解率,工作原理如图所示。图a、b和c反应区温度维持恒定且相等,仅发生反应 且在反应区内进行。投料均为1mol的
且在反应区内进行。投料均为1mol的 ,反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数
,反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数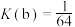 。
。
下列说法正确的是
 且在反应区内进行。投料均为1mol的
且在反应区内进行。投料均为1mol的 ,反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数
,反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数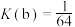 。
。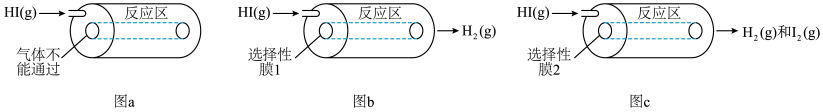
| 图a装置 | 图b装置 | 图c装置 | |
80s时反应区 的物质的量/mol 的物质的量/mol | 0.10 | 0.30 | x |
A.图a装置的化学平衡常数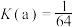 |
B.图a装置中,80s时 分解率为10% 分解率为10% |
| C.图c装置中,x一定大于0.3 |
D.图b装置中,前80s内 的平均渗透速率约为 的平均渗透速率约为 mol·s mol·s |
您最近一年使用:0次
4 . 乙醇水蒸气重整制氢是生物质制氢的重要方法,有关反应如下:
ⅰ.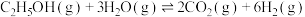
 (主反应)
(主反应)
ⅱ.

ⅲ.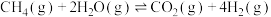

ⅳ.

(1)反应ⅳ的
_________  。
。
(2)A.Akande等研究了以Ni/ 为催化剂的乙醇水蒸气重整反应。下列说法正确的是
为催化剂的乙醇水蒸气重整反应。下列说法正确的是_________ (填标号)。
A.Ni/ 能改变重整反应的历程,增大活化分子百分数
能改变重整反应的历程,增大活化分子百分数
B.使用适宜的催化剂提高 的选择性,从而提高
的选择性,从而提高 的平衡产率
的平衡产率
C.Ni/ 能降低重整反应的活化能,大幅增大反应的速率常数
能降低重整反应的活化能,大幅增大反应的速率常数
(3)在2L刚性容器中,充入1mol (g)和若干
(g)和若干 (g),平衡时产生
(g),平衡时产生 物质的量与温度、水-乙醇比(水与乙醇物质的量比)的关系如图1所示(曲线上标注的数字为
物质的量与温度、水-乙醇比(水与乙醇物质的量比)的关系如图1所示(曲线上标注的数字为 物质的量/mol)。900K时,
物质的量/mol)。900K时,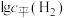 与
与 的关系如图2所示。
的关系如图2所示。_________________ 。水-乙醇比=7:1时,产生氢气的量随温度升高的变化趋势是_______________ 。
②降低温度,图2中Q点不可能变为点_________ (填“A”或“B”)。
③900K,在2L刚性容器中,充入1mo (g)和7mol
(g)和7mol  (g),以Ni/
(g),以Ni/ 为催化剂,40min达到平衡,测得
为催化剂,40min达到平衡,测得 ,且在含碳产物中的体积分数为b%,则反应ⅱ平衡常数=
,且在含碳产物中的体积分数为b%,则反应ⅱ平衡常数=__________ ,0~40min用 (g)表示的反应速率为
(g)表示的反应速率为_________  (用含a、b的式子表示,下同),
(用含a、b的式子表示,下同),
_________  。
。
ⅰ.
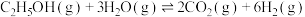
 (主反应)
(主反应)ⅱ.


ⅲ.
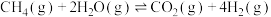

ⅳ.


(1)反应ⅳ的

 。
。(2)A.Akande等研究了以Ni/
 为催化剂的乙醇水蒸气重整反应。下列说法正确的是
为催化剂的乙醇水蒸气重整反应。下列说法正确的是A.Ni/
 能改变重整反应的历程,增大活化分子百分数
能改变重整反应的历程,增大活化分子百分数B.使用适宜的催化剂提高
 的选择性,从而提高
的选择性,从而提高 的平衡产率
的平衡产率C.Ni/
 能降低重整反应的活化能,大幅增大反应的速率常数
能降低重整反应的活化能,大幅增大反应的速率常数(3)在2L刚性容器中,充入1mol
 (g)和若干
(g)和若干 (g),平衡时产生
(g),平衡时产生 物质的量与温度、水-乙醇比(水与乙醇物质的量比)的关系如图1所示(曲线上标注的数字为
物质的量与温度、水-乙醇比(水与乙醇物质的量比)的关系如图1所示(曲线上标注的数字为 物质的量/mol)。900K时,
物质的量/mol)。900K时,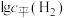 与
与 的关系如图2所示。
的关系如图2所示。
②降低温度,图2中Q点不可能变为点
③900K,在2L刚性容器中,充入1mo
 (g)和7mol
(g)和7mol  (g),以Ni/
(g),以Ni/ 为催化剂,40min达到平衡,测得
为催化剂,40min达到平衡,测得 ,且在含碳产物中的体积分数为b%,则反应ⅱ平衡常数=
,且在含碳产物中的体积分数为b%,则反应ⅱ平衡常数= (g)表示的反应速率为
(g)表示的反应速率为 (用含a、b的式子表示,下同),
(用含a、b的式子表示,下同),
 。
。
您最近一年使用:0次
解题方法
5 . 室温下,在P和Q浓度相等的混合溶液中,同时发生反应①P+Q=X+Z和反应②P+Q=Y+Z,反应①和②的速率方程分别是v1=k1c2(P)、v2=k2c2(P)(k1、k2为速率常数)。反应过程中,Q、X的浓度随时间变化情况如图所示。下列说法错误的是
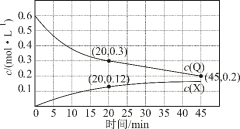
| A.反应开始后,体系中X和Y的浓度之比保持不变 |
| B.45min时Z的浓度为0.4mol·L-1 |
| C.反应①的活化能比反应②的活化能大 |
| D.如果反应能进行到底,反应结束时,有40%的P转化为Y |
您最近一年使用:0次
名校
解题方法
6 . 党的二十大报告中强调“实现碳达峰碳中和是一场广泛而深刻的经济社会系统性变革”。
 的转化和利用是实现碳中和的有效途径。回答下列问题:
的转化和利用是实现碳中和的有效途径。回答下列问题:
Ⅰ.利用 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
①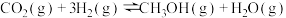
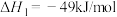
②
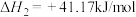
③

(1)反应③中活化能
__________ (填“>”或“<”)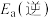 。
。
(2)在催化剂作用下,按 的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时
的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示: 。
。
①从图中曲线的变化趋势分析a点之后温度升高,甲醇选择性降低的原因__________ ,在实际工业生产中压强不能过高也不能过低的原因是____________ 。
② 时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则
时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则 的分压=
的分压=__________ MPa,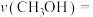
__________ MPa/min,反应②的
__________ ( 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。
Ⅱ.近年来,有研究人员用 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示:
的回收利用,其工作原理如图所示: ,则该电极反应式为
,则该电极反应式为____________________ 。

 的转化和利用是实现碳中和的有效途径。回答下列问题:
的转化和利用是实现碳中和的有效途径。回答下列问题:Ⅰ.利用
 合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:①
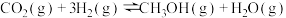
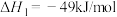
②

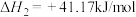
③


(1)反应③中活化能

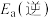 。
。(2)在催化剂作用下,按
 的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时
的比例向某密闭容器中通入一定量的原料气,只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时 的转化率、甲醇的选择性如图所示:
的转化率、甲醇的选择性如图所示:
 。
。①从图中曲线的变化趋势分析a点之后温度升高,甲醇选择性降低的原因
②
 时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则
时,若反应在催化剂的活性范围内,反应从开始到达到a点所用时间为10min,则 的分压=
的分压=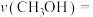

 指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。
指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×p总,最终结果用分数表示)。Ⅱ.近年来,有研究人员用
 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示:
的回收利用,其工作原理如图所示: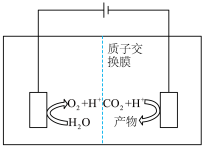
 ,则该电极反应式为
,则该电极反应式为
您最近一年使用:0次
7 . 化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①哪一时间段反应速率最大___________ min(填“0~1”、“1~2”、“2~3”、“3~4”或“4~5”),原因是___________ 。
②2~3min内,以盐酸的浓度变化表示的平均反应速率为___________ mol/(L·min) (设溶液体积不变)。
(2)某温度下在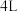 恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:___________ mol/L,该反应的化学方程式是___________ 。
②5min时,Z的生成速率___________ (填“大于”、“小于”或“等于”)6min时Z的生成速率。
③若升高温度,则逆反应速率___________ (填“增大”、“减小”或“不变”)。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在
 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL(标准状况) | 109 | 220 | 332 | 412 | 480 |
②2~3min内,以盐酸的浓度变化表示的平均反应速率为
(2)某温度下在
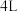 恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示: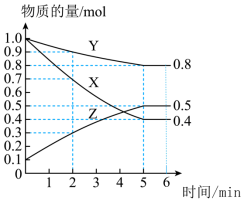
②5min时,Z的生成速率
③若升高温度,则逆反应速率
您最近一年使用:0次
名校
8 . 电子工业上常用氯化铁溶液作印刷电路板的腐蚀液,使用过的腐蚀废液中的金属阳离子主要有Fe3+、Fe2+和Cu2+。化学兴趣小组设计如下流程对废液进行处理并回收氯化铁溶液。___________ (填“氧化”或“还原”)成Fe3+;取少量溶液A于试管中,滴入1~2滴KSCN溶液,溶液显___________ (填“红色”或“蓝色”)。
(2)实验室常用H2O2溶液制取氧气。在一定温度下,10 mL 0.40 mol·L-1的H2O2溶液发生催化分解,5 min时测得生成O2的体积为22.4 mL(已折算为标准状况)。
①用H2O2表示该反应的速率为___________ mol·(L·min)-1;
②其他条件不变时,升高反应的温度,该反应的速率将___________ (填“加快”或“减慢”)。

(2)实验室常用H2O2溶液制取氧气。在一定温度下,10 mL 0.40 mol·L-1的H2O2溶液发生催化分解,5 min时测得生成O2的体积为22.4 mL(已折算为标准状况)。
①用H2O2表示该反应的速率为
②其他条件不变时,升高反应的温度,该反应的速率将
您最近一年使用:0次
名校
9 . 一定温度下,在容积为2L的恒容密闭容器中进行某一反应,容器内M、N两种气体的物质的量随时间的变化曲线如图所示。下列说法正确的是
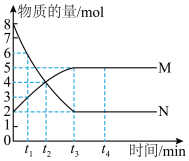
A.该反应的化学方程式为N(g) 2M(g) 2M(g) |
| B.t2min时,正、逆反应速率相等,反应达到平衡状态 |
| C.t4min时,容器容积不变,充入惰性气体Ar,正反应速率增大 |
D.t1~t2min内,用N的浓度变化表示的平均反应速率为 mol·L-1·min-1 mol·L-1·min-1 |
您最近一年使用:0次
名校
10 . CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
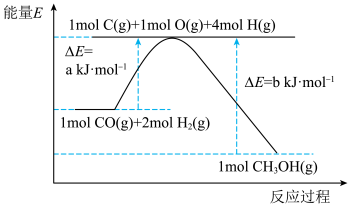
(1)已知利用合成气(主要成分CO和H2)在催化剂的作用下合成甲醇,发生反应为:CO(g)+2H2 (g) CH3OH(g)。反应过程中的能量变化如图所示,该反应为
CH3OH(g)。反应过程中的能量变化如图所示,该反应为___________ (填“放热”或“吸热”)反应。
(2)现在实验室中用CO和H2反应模拟甲醇合成反应,在2L恒容密闭容器内,400℃时发生反应:CO(g)+2H2 (g) CH3OH (g),体系中n(CO)随时间的变化如表:
CH3OH (g),体系中n(CO)随时间的变化如表:
①0~2min内,以H2表示的该反应速率v(H2)=___________  ;
;
②下列措施不能提高反应速率的有___________ (请用相应字母填空);
a.升高温度 b.恒T、恒V下充入H2
c.及时分离出CH3OH d.恒T、恒P下充入N2
e.加入高效催化剂
③下列叙述能说明反应达到平衡状态的是___________ (请用相应字母填空);
a.CO和H2的浓度保持不变 b. 2v正(H2)=v逆(CO)
c.容器内气体密度保持不变 d.容器内质量保持不变
e.每生成1mol CH3OH的同时有2mol H-H键形成
(3)化学能与其他能量间的转换在生活中处处可见,比如某种氢氧燃料电池已经成功应用在城市公交汽车上,该电池用30%H2SO4溶液作电解质溶液,其简易装置如图所示。
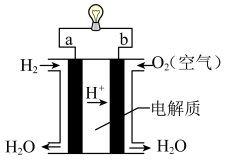
在这个燃料电池中,正极的电极反应式为_______________________ 。若在标况下,消耗了33.6L的氢气,此时电路中转移的电子数目为______________ (用阿伏加德罗常数表示)。
(1)已知利用合成气(主要成分CO和H2)在催化剂的作用下合成甲醇,发生反应为:CO(g)+2H2 (g)
 CH3OH(g)。反应过程中的能量变化如图所示,该反应为
CH3OH(g)。反应过程中的能量变化如图所示,该反应为
(2)现在实验室中用CO和H2反应模拟甲醇合成反应,在2L恒容密闭容器内,400℃时发生反应:CO(g)+2H2 (g)
 CH3OH (g),体系中n(CO)随时间的变化如表:
CH3OH (g),体系中n(CO)随时间的变化如表:时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CO) (mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
 ;
;②下列措施不能提高反应速率的有
a.升高温度 b.恒T、恒V下充入H2
c.及时分离出CH3OH d.恒T、恒P下充入N2
e.加入高效催化剂
③下列叙述能说明反应达到平衡状态的是
a.CO和H2的浓度保持不变 b. 2v正(H2)=v逆(CO)
c.容器内气体密度保持不变 d.容器内质量保持不变
e.每生成1mol CH3OH的同时有2mol H-H键形成
(3)化学能与其他能量间的转换在生活中处处可见,比如某种氢氧燃料电池已经成功应用在城市公交汽车上,该电池用30%H2SO4溶液作电解质溶液,其简易装置如图所示。

在这个燃料电池中,正极的电极反应式为
您最近一年使用:0次



