1 . 氨是合成硝酸、铵盐和氮肥的基本原料,在科学技术和生产中有重要的应用。请回答下列问题:
(1)以N2和H2为原料,合成氨气的反应为N2(g)+3H2(g) 2NH3(g) ΔH<0,下列措施可以提高v(正)的是
2NH3(g) ΔH<0,下列措施可以提高v(正)的是___________ (填序号)。
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.降低温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个体积可变的恒压密闭容器中,p = 5MPa,原气体体积为2L。5分钟后反应达到平衡时,n(N2)=1.0mol,n(H2)=3.0mol,n(NH3)=1.0mol,则反应速率v (N2)=___________ mol/min (用单位时间物质的量变量表示化学反应速率),平衡常数Kp =___________ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是
2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是___________ (填序号)。
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时的值最大
(4)氨和联氨(N2H4)是氨的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式:___________ 。标况下,每消耗1.12L氨气,转移___________ mol电子。
(1)以N2和H2为原料,合成氨气的反应为N2(g)+3H2(g)
 2NH3(g) ΔH<0,下列措施可以提高v(正)的是
2NH3(g) ΔH<0,下列措施可以提高v(正)的是a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.降低温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个体积可变的恒压密闭容器中,p = 5MPa,原气体体积为2L。5分钟后反应达到平衡时,n(N2)=1.0mol,n(H2)=3.0mol,n(NH3)=1.0mol,则反应速率v (N2)=
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)
 2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是
2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是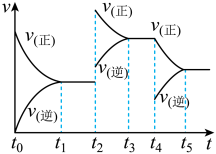
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时的值最大
(4)氨和联氨(N2H4)是氨的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式:
您最近一年使用:0次
2 . 由 -羟基丁酸
-羟基丁酸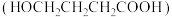 生成
生成 -丁内酯(
-丁内酯( )的反应为:HOCH2CH2CH2COOH
)的反应为:HOCH2CH2CH2COOH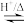
 +H2O
+H2O 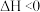 ,在
,在 时,溶液中
时,溶液中 -羟基丁酸的初始浓度为
-羟基丁酸的初始浓度为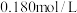 ,随着反应的进行,测得
,随着反应的进行,测得 丁内酯浓度随时间的变化如表所示。
丁内酯浓度随时间的变化如表所示。
(1)在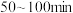 内,以
内,以 -丁内酯的浓度变化表示的反应速率为
-丁内酯的浓度变化表示的反应速率为___________ mol∙L-1∙min-1。
(2)在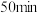 时,
时, -羟基丁酸的转化率为
-羟基丁酸的转化率为___________ (结果保留一位小数)。
(3)该反应达到平衡后,升高温度,平衡___________ 移动(填“正向”“不”或“逆向”)。
(4)保持其它条件不变,增大溶液中 -羟基丁酸的初始浓度,其平衡转化率将
-羟基丁酸的初始浓度,其平衡转化率将___________ (填“增大”“减小”或“不变”)。
(5)关于该反应的下列说法正确的是___________(填序号)。
(6) 时,该反应的平衡常数
时,该反应的平衡常数
___________ 。相同温度下,某溶液中发生上述反应,当 -丁内酯的浓度为
-丁内酯的浓度为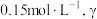 -羟基丁酸的浓度为
-羟基丁酸的浓度为 时,反应
时,反应___________ (填“正向进行”“逆向进行”或“已平衡”)。
 -羟基丁酸
-羟基丁酸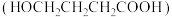 生成
生成 -丁内酯(
-丁内酯( )的反应为:HOCH2CH2CH2COOH
)的反应为:HOCH2CH2CH2COOH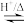
 +H2O
+H2O 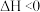 ,在
,在 时,溶液中
时,溶液中 -羟基丁酸的初始浓度为
-羟基丁酸的初始浓度为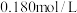 ,随着反应的进行,测得
,随着反应的进行,测得 丁内酯浓度随时间的变化如表所示。
丁内酯浓度随时间的变化如表所示。 | 21 | 50 | 80 | 100 | 120 | 160 | 220 |  |
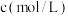 | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
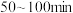 内,以
内,以 -丁内酯的浓度变化表示的反应速率为
-丁内酯的浓度变化表示的反应速率为(2)在
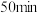 时,
时, -羟基丁酸的转化率为
-羟基丁酸的转化率为(3)该反应达到平衡后,升高温度,平衡
(4)保持其它条件不变,增大溶液中
 -羟基丁酸的初始浓度,其平衡转化率将
-羟基丁酸的初始浓度,其平衡转化率将(5)关于该反应的下列说法正确的是___________(填序号)。
| A.达到平衡后,升高温度正反应速率减小,逆反应速率增大 |
B.当 -羟基丁酸的正反应速率与 -羟基丁酸的正反应速率与 -丁内酯的逆反应速率相等时,说明达到了平衡 -丁内酯的逆反应速率相等时,说明达到了平衡 |
C.当 -羟基丁酸和 -羟基丁酸和 -丁内酯的浓度相等时,说明达到了平衡 -丁内酯的浓度相等时,说明达到了平衡 |
D.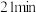 时的逆反应速率小于 时的逆反应速率小于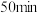 时的正反应速率 时的正反应速率 |
 时,该反应的平衡常数
时,该反应的平衡常数
 -丁内酯的浓度为
-丁内酯的浓度为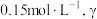 -羟基丁酸的浓度为
-羟基丁酸的浓度为 时,反应
时,反应
您最近一年使用:0次
解题方法
3 . 汽车尾气中的 是空气污染源之一,利用CO催化还原
是空气污染源之一,利用CO催化还原 生成
生成 和
和 的反应是减少汽车尾气污染的有效方法。
的反应是减少汽车尾气污染的有效方法。
回答下列问题:
(1)用CO还原 的能量变化如图甲所示,则该反应的热化学方程式为
的能量变化如图甲所示,则该反应的热化学方程式为__________ 。
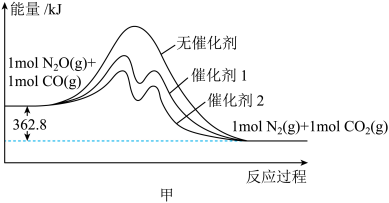
(2)不同温度和催化剂下,分别向容积为1L的密闭容器中充入 和1molCO进行实验,经过t秒测得实验数据如下,实验Ⅰ中,使用催化剂1时,
和1molCO进行实验,经过t秒测得实验数据如下,实验Ⅰ中,使用催化剂1时,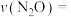
__________  ;在相同温度时,催化剂2催化下
;在相同温度时,催化剂2催化下 的转化率更大的原因是
的转化率更大的原因是__________ 。
(3)在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入 、4molCO和相同催化剂,发生
、4molCO和相同催化剂,发生 反应。实验测得A、B容器中
反应。实验测得A、B容器中 的转化率随时间的变化关系如图乙所示。
的转化率随时间的变化关系如图乙所示。
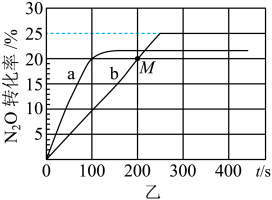
①B容器中 的转化率随时间的变化关系是图乙中的
的转化率随时间的变化关系是图乙中的__________ 曲线(填“a”或“b”)。
②要缩短b曲线对应容器达到平衡的时间,但不改变 的平衡转化率,在催化剂一定的情况下可调节的条件是
的平衡转化率,在催化剂一定的情况下可调节的条件是__________ (填序号)。
A.向体系内充入He气 B.升高温度 C.减小容器体积
③500℃时,该反应的化学平衡常数
__________ (用分数表示)。
④实验测定该反应的反应速率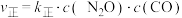 ,
, ,
, 、
、 分别是正、逆反应速率常数,c为物质的量浓度。计算M点处的
分别是正、逆反应速率常数,c为物质的量浓度。计算M点处的
__________ (保留到小数点后一位)。
 是空气污染源之一,利用CO催化还原
是空气污染源之一,利用CO催化还原 生成
生成 和
和 的反应是减少汽车尾气污染的有效方法。
的反应是减少汽车尾气污染的有效方法。回答下列问题:
(1)用CO还原
 的能量变化如图甲所示,则该反应的热化学方程式为
的能量变化如图甲所示,则该反应的热化学方程式为
(2)不同温度和催化剂下,分别向容积为1L的密闭容器中充入
 和1molCO进行实验,经过t秒测得实验数据如下,实验Ⅰ中,使用催化剂1时,
和1molCO进行实验,经过t秒测得实验数据如下,实验Ⅰ中,使用催化剂1时,
 ;在相同温度时,催化剂2催化下
;在相同温度时,催化剂2催化下 的转化率更大的原因是
的转化率更大的原因是实验 | 温度/℃ | 催化剂 |
|
实验Ⅰ | 400 | 催化剂1 | 9.5 |
400 | 催化剂2 | 10.6 | |
实验Ⅱ | 500 | 催化剂3 | 12.3 |
500 | 催化剂4 | 13.5 |
(3)在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入
 、4molCO和相同催化剂,发生
、4molCO和相同催化剂,发生 反应。实验测得A、B容器中
反应。实验测得A、B容器中 的转化率随时间的变化关系如图乙所示。
的转化率随时间的变化关系如图乙所示。
①B容器中
 的转化率随时间的变化关系是图乙中的
的转化率随时间的变化关系是图乙中的②要缩短b曲线对应容器达到平衡的时间,但不改变
 的平衡转化率,在催化剂一定的情况下可调节的条件是
的平衡转化率,在催化剂一定的情况下可调节的条件是A.向体系内充入He气 B.升高温度 C.减小容器体积
③500℃时,该反应的化学平衡常数

④实验测定该反应的反应速率
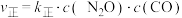 ,
, ,
, 、
、 分别是正、逆反应速率常数,c为物质的量浓度。计算M点处的
分别是正、逆反应速率常数,c为物质的量浓度。计算M点处的
您最近一年使用:0次
2024-01-13更新
|
109次组卷
|
2卷引用:湖南省益阳博雅高级中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
4 . 在水溶液中进行的反应: ,已知该反应速率方程为
,已知该反应速率方程为 (k为常数),为探究反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
(k为常数),为探究反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
下列结论正确的是
 ,已知该反应速率方程为
,已知该反应速率方程为 (k为常数),为探究反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
(k为常数),为探究反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表: | ① | ② | ③ | ④ | ⑤ |
 | 0.008 | 0.008 | 0.004 | 0.008 | 0.008 |
 | 0.001 | 0.001 | 0.001 | 0.002 | 0.001 |
 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
 |  |  | 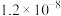 |  | v1 |
| A.反应体系的三种物质中,H+(aq)的浓度对反应速率影响最大 |
B.速率常数 的数值为0.03 的数值为0.03 |
| C.a、b、c的值分别为1、5、6 |
D.实验⑤中, |
您最近一年使用:0次
2023-12-31更新
|
801次组卷
|
6卷引用:湖南省益阳博雅高级中学2023-2024学年高二上学期期末考试化学试题
湖南省益阳博雅高级中学2023-2024学年高二上学期期末考试化学试题河北省2024届高三上学期大数据应用调研联合测评Ⅲ化学试卷(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)热点13 化学反应速率与化学平衡湖南省常德市第一中学2023-2024学年高二上学期期末考试化学试题河北省石家庄市部分重点高中2023-2024学年高三上学期12月期末化学试题
名校
解题方法
5 . 将等物质的量的A、B混合于 的密闭容器中发生反应:
的密闭容器中发生反应: ,经
,经 后测得D的浓度为
后测得D的浓度为 ,
, ,以C表示的平均速率
,以C表示的平均速率 ,下列说法正确的是
,下列说法正确的是
 的密闭容器中发生反应:
的密闭容器中发生反应: ,经
,经 后测得D的浓度为
后测得D的浓度为 ,
, ,以C表示的平均速率
,以C表示的平均速率 ,下列说法正确的是
,下列说法正确的是A.反应速率 |
| B.该反应方程式中,x=1 |
C. 时,A的转化率为60% 时,A的转化率为60% |
D. 时,A的物质的量为 时,A的物质的量为 |
您最近一年使用:0次
2023-12-23更新
|
328次组卷
|
3卷引用:湖南省益阳博雅高级中学2023-2024学年高二上学期期末考试化学试题
名校
6 . “绿水青山就是金山银山”,运用化学反应原理研究NO的反应对缓解环境污染具有重要意义。回答下列问题:
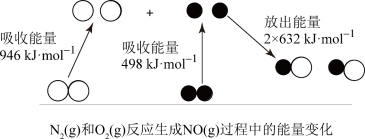
(1)汽车尾气中NO生成过程的能量变化如图所示,该反应的热化学方程式为___________ 。
(2)通过NO传感器可检测汽车尾气中NO的含量,其工作原理如图所示。已知 可在固体电解质中自由移动。
可在固体电解质中自由移动。
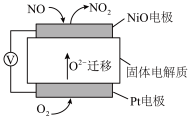
① 电极为
电极为___________ (填“正极”或“负极”)。
②Pt电极的电极反应式为___________ 。
(3)工业上可利用甲烷还原NO减少氮氧化物的排放。向2L恒容密闭容器中通入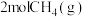 、
、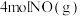 ,一定条件下发生反应:
,一定条件下发生反应: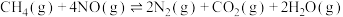 ,测得
,测得 的物质的量随时间变化的关系如表。
的物质的量随时间变化的关系如表。
①下列措施能够加快该反应速率的是___________ (填标号)。
A.使用催化剂 B.升高温度 C.及时分离水 D.充入He增大体系压强
②0~20min内,用NO表示该反应的平均速率为___________ mol∙L-1∙min-1。
③平衡时, 的体积分数为
的体积分数为___________ 。
④若反应体系中 的初始压强为
的初始压强为 ,则该反应的压强平衡常数
,则该反应的压强平衡常数
___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4) 溶液在碱性条件下可将烟气中的NO转化成
溶液在碱性条件下可将烟气中的NO转化成 ,反应的离子方程式为
,反应的离子方程式为______ 。
(1)汽车尾气中NO生成过程的能量变化如图所示,该反应的热化学方程式为

(2)通过NO传感器可检测汽车尾气中NO的含量,其工作原理如图所示。已知
 可在固体电解质中自由移动。
可在固体电解质中自由移动。
①
 电极为
电极为②Pt电极的电极反应式为
(3)工业上可利用甲烷还原NO减少氮氧化物的排放。向2L恒容密闭容器中通入
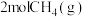 、
、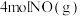 ,一定条件下发生反应:
,一定条件下发生反应: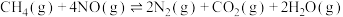 ,测得
,测得 的物质的量随时间变化的关系如表。
的物质的量随时间变化的关系如表。| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
 | 0 | 0.6 | 1.0 | 1.3 | 1.5 | 1.5 |
A.使用催化剂 B.升高温度 C.及时分离水 D.充入He增大体系压强
②0~20min内,用NO表示该反应的平均速率为
③平衡时,
 的体积分数为
的体积分数为④若反应体系中
 的初始压强为
的初始压强为 ,则该反应的压强平衡常数
,则该反应的压强平衡常数
(4)
 溶液在碱性条件下可将烟气中的NO转化成
溶液在碱性条件下可将烟气中的NO转化成 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
2023-12-21更新
|
192次组卷
|
3卷引用:湖南省益阳博雅高级中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
7 . 已知: ,若反应速率分别用
,若反应速率分别用 、
、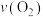 、
、 、
、 表示,则正确的关系式是
表示,则正确的关系式是
 ,若反应速率分别用
,若反应速率分别用 、
、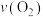 、
、 、
、 表示,则正确的关系式是
表示,则正确的关系式是A.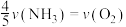 | B.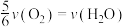 |
C.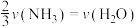 | D.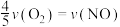 |
您最近一年使用:0次
2023-10-18更新
|
548次组卷
|
261卷引用:湖南省益阳市箴言中学2019-2020学年高二上学期期末学业水平考试化学试题
湖南省益阳市箴言中学2019-2020学年高二上学期期末学业水平考试化学试题湖南省益阳市安化县第二中学2022-2023学年高一下学期4月月考化学试题(已下线)湖南师大附中高二化学选修4结业考试理科试题(已下线)2010年海南省嘉积中学高二上学期第二次月考化学试卷(已下线)2010-2011学年广东省龙山中学高一下学期期中考试化学试卷(已下线)2011-2012年江苏宿迁泗洪县洪翔中学高二下学期期中考试化学试卷(已下线)2011-2012学年河北省唐山一中高二第二次调研考试化学试卷(已下线)2012-2013学年天津市武清区杨村一中高二第一次月考化学试卷(已下线)2013届天津市新华中学高三第三次月考化学试卷(已下线)2012-2013学年浙江省宁海县正学中学高二下学期第一次阶段性测试化学试卷(已下线)2012-2013学年山东省临沂市高二上学期期中考试化学试卷(已下线)2013-2014学年河南省漯河市高二上学期期中考试化学试卷(已下线)2014届高考化学二轮复习 专题6化学反应速率和化学平衡练习卷(已下线)2014年高中化学二轮创新训练上 专题6化学反应速率和化学平衡练习卷(已下线)2014年化学高考总复习课时演练 7-1化学反应速率及影响因素练习卷(已下线)2014届四川省雅安中学高二下学期4月月考化学试卷(已下线)2013-2014学年浙江省温州市十校联合体高一下学期期中联考化学试卷(已下线)2013-2014四川省成都市五校高二下学期期中联考化学试卷(已下线)2013-2014四川省雅安中学高二4月月考化学试卷(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(B)卷2014-2015辽宁省大连市高二上学期期末考试化学(理)试卷2014-2015湖南省娄底市湘中名校高二上学期期末化学(理)试卷2014-2015学年山东省微山一中高二下学期期末考试化学试卷2015-2016学年黑龙江大庆铁人中学高二上9月考化学试卷2015-2016学年陕西省西安第七十中学高二上学期期中测试化学试卷2015-2016学年贵州省凯里一中高二上学期期末化学试卷2015-2016学年河北省石家庄市高二上学期期末考试化学试卷2015-2016学年河北省唐山市开滦一中高一下学期期中理科化学试卷2015-2016学年中国石油天然气管道局中学高一下第二次月考化学试卷2016-2017学年江西省上高二中高二上9月月考化学试卷2017届河北省沧州一中高三上学期9.22周测化学卷2016-2017学年广东省湛江一中高二上第一次大考化学卷2016-2017学年甘肃省天水三中高二上10月学段考理化学卷上海市交通大学附属中学2016-2017学年高一下学期期中考试化学试题内蒙古北京八中乌兰察布分校2016-2017学年高二下学期期中考试化学试题甘肃省武威市第六中学2016-2017学年高一下学期期末考试化学试题(已下线)2.1 化学反应速率山西省大同市第一中学2017-2018学年高二9月阶段测试化学试题江西省南昌市八一中学、洪都中学、麻丘高中等六校2017-2018学年高二10月联考化学试题江西省九江市2017-2018学年高二上学期第一次阶段联考化学试题四川省成都市七中实验学校2017-2018学年高二10月月考化学试题四川省南充高级中学2017-2018学年高二上学期期中考试化学试题高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第一节 化学反应速率 化学反应速率上海市金山中学2016-2017学年高一下学期期中考试化学试题吉林省汪清县第六中学2017-2018学年高二上学期期末考试化学试题陕西省黄陵中学2017-2018学年高二(重点班)上学期期末考试化学试题安徽省马鞍山市第二中学2017-2018学年高二上学期期末教学质量检测化学试题安徽省马鞍山市2017-2018学年高二上学期期末教学质量检测化学理科试题 山东省德州市平原县第一中学2017-2018学年高一4月阶段性检测化学试题北京四中2017-2018学年高一下学期第二次月考化学试题河南省林州一中分校(林虑中学)2018-2019学年高二上学期8月调研考试化学试题江西省南康市南康中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】广东省佛山市第一中学2018-2019学年高二上学期第一次段考化学试题河南省安阳市第二中学2018-2019学年高二上学期期中考试化学试题人教版高二化学选修4 第二章 第一节 化学反应速率练习题【市级联考】湖南省娄底市2018-2019学年高二上学期期中考试化学试题福建省惠安惠南中学2019届高三上学期期中考试化学试题【全国百强校】山东省泰安市第一中学2019届高三上学期12月学情诊断化学试题内蒙古自治区包头市第六中学2018-2019学年高二上学期期中考试化学试题新疆维吾尔自治区沙雅县第二中学2018-2019学年高二上学期期中考试化学试题四川省遂宁市遂宁中学外国语实验学校2018-2019学年高二上学期第二学段考试化学试题吉林省通化市第十四中学2018-2019学年高二上学期期末考试化学试题河南省永城市实验高级中学2018-2019学年高二上学期期中考试化学试题【校级联考】湖北省宜昌市协作体2018-2019学年高二上学期期末考试化学试题(已下线)2012-2013学年湖南省怀化市高二上学期期末考试理科化学试卷(已下线)2019年3月25日 《每日一题》 必修2 化学反应速率的表示与计算山东省新泰二中2018-2019学年高一下学期第一次月考化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高一下学期期中考试化学试题【全国百强校】河北省张家口市第一中学2018-2019学年高一下学期期中考试化学试题2新疆自治区北京大学附属中学新疆分校2018-2019学年高一下学期期中考试化学试题江苏省宿迁市沭阳县修远中学2018-2019学年高二下学期第二次月考化学试题青海省海东市第二中学2018-2019学年高二下学期第一次月考化学试题重庆市万州二中2019-2020学年高二上学期入学考试化学试题重庆市万州第二高级中学2019-2020学年高二入学考试化学试题广东省揭阳市第三中学2019-2020学年高二上学期第一次月考化学试题贵州省凯里市第一中学2019-2020学年高二上学期期中考试化学(理)试题山东省淄博市淄川区般阳中学2019-2020学年高二10月月考化学试题四川省武胜烈面中学2019-2020学年高二10月月考化学试题甘肃省白银市会宁县第四中学2019-2020学年高二上学期期中考试化学试题河南省周口中英文学校2019-2020学年高二上学期期中考试化学试题辽宁省凌源市联合校2019-2020学年高二上学期期中考试化学试题新疆维吾尔自治区昌吉玛纳斯县第一中学2018-2019学年高二上学期期中考试化学试题湖南省永州市双牌县第二中学2019-2020学年高二上学期期中考试化学试题(选考)黑龙江省哈尔滨市阿城区龙涤中学校2019-2020学年高二上学期期中考试化学试题重庆市云阳县2019-2020学年高二上学期期中考试化学试题河北省宣化市第一中学2019-2020学年高一11月月考化学试题贵州省贵阳市清镇北大培文学校2018-2019学年高一下学期期中考试化学试题安徽省砀山县第二中学2020届高三上学期第四次月考化学试题新疆沙雅县第二中学2019-2020学年高二上学期期中考试化学试题重庆市朝阳中学2019-2020学年高一12月月考化学试题贵州省金沙中学2019年普通高中学生学业基础水平测试化学试题天津市第二南开学校2019-2020学年高一下学期阶段性检测化学试题江苏省东海县第二中学2019-2020学年高二下学期第一次学分认定测试化学试题宁夏银川市长庆高级中学2019-2020学年高一下学期期中考试化学试题黑龙江桦南二中2019-2020学年高二上学期期中考试化学试题江苏省苏州市苏大附中2019-2020学年高一下学期期中化学试题云南省昆明市第一中学2019-2020学年高一下学期期中考试化学试题内蒙古集宁一中西校区2019-2020学年高一下学期期中考试化学试题四川省攀枝花市第十五中学2019-2020学年高二上学期期中考试化学试题四川省攀枝花市第十五中学2019-2020学年高二上学期第一次月考化学试题辽宁省大连市普兰店区第一中学2019-2020学年高一下学期5月线上教学质量检测化学试题云南省昆明市寻甸县民族中学2019-2020学年高二下学期第一次月考化学试题新疆吐蕃市高昌区第二中学2019-2020学年高一下学期期末考试化学试题新疆吾尔自治区喀什巴楚县第一中学2019-2020学年高一下学期期末考试化学试题山东省济宁市微山县第二中学2019-2020学年高一下学期第三学段考试化学试题(已下线)第06练化学反应的速率与限度-2020年【衔接教材·暑假作业】新高二化学(人教版)湖南省教育联合体2019-2020学年高一6月联考化学试题(已下线)2.1.1 化学反应速率的表示方法(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)江西省南昌市第十中学2019-2020学年高二上学期第一次月考化学试题河南省兰考县第三高级中学卫星试验部2020-2021学年高二上学期第一次月考化学试题安徽省安庆市宜秀区白泽湖中学2020-2021学年高二下学期入学考试化学试题河北省鸡泽县第一中学2020-2021学年高二上学期开学考试化学试题辽宁省联合校2020-2021学年高二上学期第一次月考化学试题四川省广安市北京师范大学广安实验学校2020-2021学年高二上学期9月月考化学试题河北省保定市唐县第一中学2020-2021学年高二9月月考化学试题吉林省辽源市田家炳高级中学校2020-2021学年高二上学期第一次月考化学试题辽宁省葫芦岛市第八高级中学2020-2021学年高二上学期实验班第一次月考化学试题黑龙江省海林市朝鲜族中学2020-2021学年高二上学期第一次月考化学试题江苏省南通市海安县2020-2021学年高二上学期第一次月考化学试题吉林省吉林市第二中学2021届高三上学期9月份考试化学试题陕西省汉中市洋县中学2020-2021学年高二上学期第一次月考化学试题吉林省长春市第一五一中学2020-2021学年高二上学期第一次月考化学试题(普通班)河北省邢台市巨鹿中学2020-2021学年高二上学期第一次月考化学试题广东省揭阳市第三中学2020-2021学年高二上学期第一次阶段考化学试题广东省广州市第一一三中学22020-2021学年高二上学期第一阶段考试化学(选考)试题江西省彭泽县第一中学2020-2021学年高二上学期第一次月考化学试题吉林省长春汽车经济技术开发区第六中学2020-2021学年高二上学期月考化学试题山东省济宁市曲阜市第一中学2020-2021学年高二上学期阶段性检测(9月月考)化学试题吉林省辽源市田家炳高级中学校2020-2021学年高二上学期期中考试化学试题人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 易错疑难集训(一)云南省昆明师范专科学校附属中学2020-2021学年高二上学期期中考试化学试题山东省泰安市新泰中学2019级高二上学期期中考试试题山东省新泰第一中学老校区(新泰中学)2020-2021学年高二上学期期中考试化学试题辽宁省葫芦岛市第八高级中学2020-2021学年高二上学期期中考试化学试题河北省尚义县第一中学2020-2021学年高二上学期期中考试化学试题广东省湛江市雷州市第二中学2020-2021学年高二上学期第一次月考化学试题河南省漯河市临颍县南街高中2020-2021学年高二上学期期中考试化学试题新疆昌吉州教育共同体2020-2021学年高二上学期期中考试化学试题内蒙古巴彦淖尔市临河三中2020-2021学年高二10月考化学试题云南普洱景东彝族自治县第一中学2020-2021学年高二上学期12月月考化学试题重庆市凤鸣山中学2020-2021学年高二上学期10月月考化学试题(已下线)练习5 化学反应速率-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)新疆哈密市第八中学2019-2020学年高二上学期期中考试化学试题人教版2019必修第二册 第六章 第二节 第1课时 化学反应的速率(鲁科版2019)必修第二册 第2章 化学键 化学反应规律 第3节 化学反应的快慢和限度 第1课时 化学反应的快慢(已下线)专题10 化学反应速率与平衡-备战2021届高考化学二轮复习题型专练安徽省安庆市九一六学校2020-2021学年高二下学期开学考试化学试题福建省福州市福清市西山学校2020-2021学年高一下学期3月月考化学试题(已下线)期中检测卷1 -2020-2021学年高一化学必修2章末集训必刷卷(人教版)(已下线)【浙江新东方】双师198高一下河北省巨鹿中学2020-2021学年高二下学期第一次月考化学试题江西省赣州市会昌县第五中学2020-2021学年高二上学期第一次月考化学试题(已下线)【浙江新东方】高中化学20210429—006【2021】【高一下】甘肃省兰州市教育局第四片区2020-2021学年高一下学期期中考试化学试题新疆乌鲁木齐市第二十中学2020-2021学年高二上学期段考(期中)化学试题安徽省淮北市树人高级中学2020-2021学年高一下学期期中考试化学试题黑龙江省绥化市肇东四中2020-2021学年高一下学期期末考试化学试题(已下线)专题2.1.1 化学反应速率(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)广东省清远市凤霞中学2020-2021学年高一下学期期中质量检测化学试题四川省凉山州西昌天立学校高2021-2022学年高二上学期入学考试化学试题吉林省延边第二中学2020-2021学年高一下学期期末考试化学试题湖南省邵阳市文德高级中学2021-2022学年高二上学期第一次月考化学试题云南省曲靖市沾益区第四中学2021-2022学年高二上学期10月月考化学试题甘肃省民勤县第一中学2021-2022学年高二上学期第一次月考化学试题安徽省亳州市第二中学2021-2022学年高二上学期开学摸底考试化学试题陕西省铜川市耀州中学2021-2022学年高二上学期第一次月考化学试题甘肃省舟曲县第一中学2021-2022学年高二上学期第一次月考化学试题吉林省长春市十一高中2022届高三上学期第一学程考试化学试题河北省石家庄实验中学2021-2022学年高二上学期10月月考化学试题山东省济宁市微山县第二中学2021-2022学年高二上学期第一学段考试化学试题北京市大兴区2021-2022学年高二上学期期中考试化学试题贵州省凯里市第一中学2021-2022学年高二上学期期中考试化学(理科)试题(已下线)必考点02 化学反应速率-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版)人教2019版选择性必修一第二章 第一节 化学反应速率 课后习题(已下线)期末综合测试卷01-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)(已下线)必考点02 化学反应速率-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)新疆乌鲁木齐市第八中学2021-2022学年高二上学期第二次月考化学试题云南昆明师范专科学校附属中学2021-2022学年高二上学期期中考试化学试题贵州省毕节市金沙县第一中学2021-2022学年高二上学期期中考试化学试题(已下线)2.1.1 化学反应速率的表示方法(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)安徽省蚌埠市2021-2022学年高二上学期期末学业水平监测化学试题(理科)浙江省宁波市奉化区2021-2022学年高二上学期期末联考化学试题(已下线)6.1.1 化学反应速率(第1课时 化学反应速率的概念和简单计算)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)河北省石家庄市2021-2022学年高二上学期期末考试化学试题安徽省亳州市第一中学2021-2022学年高二上学期第二次月考化学试题四川师范大学附属中学安宁校区2021-2022学年高二上学期期中考试化学试题福建省福州华侨中学2021-2022学年高二上学期期中考试化学试题新疆生产建设兵团第二师八一中学2021-2022学年高二上学期期中考试化学试题吉林省长春汽车经济技术开发区第三中学 2021-2022学年 高一下学期线上月考化学试题广东省清远市2021-2022学年高一下学期期中调研考试化学试题广西三新教学质量测评2021-2022学年高一4月段考化学试题山西省长治市第一中学校2021-2022学年高一下学期第六次练考化学试题吉林省实验中学2021-2022学年高一下学期期中考试(线上教学诊断)化学试题内蒙古赤峰市元宝山区第一中学2021-2022学年高一下学期期中考试化学试题(已下线)6.2.1 化学反应的速率-2021-2022学年高一化学课后培优练(人教版2019必修第二册)(已下线)【期末复习】必刷题(2)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)河南省洛阳市2021-2022学年高二下学期5月质量检测化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题安徽省芜湖市第一中学2021-2022学年高一下学期期中考试化学试题天津市河东区三校2020-2021学年高一下学期期中联考化学试题福建省福州市五校联考2021-2022学年高二上学期期中考试化学试题第一节 化学反应速率 第1课时 化学反应速率(已下线)第05讲 化学反应速率(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)陕西省西安市西航一中2021-2022学年高二下学期第一次月考试题青海省西宁市大通回族土族自治县2021-2022学年高二上学期期末考试化学试题陕西师范大学附属中学2021-2022学年高一下学期期中考试化学试题浙江省金华市江南中学2021-2022学年高二上学期期中考试化学试题西藏拉萨市第二高级中学2021-2022学年高二上学期期中考试化学试题云南省昆明光华学校2021-2022学年高一3月月考化学试题河南省确山县第二高级中学2021-2022学年高三上学期期中考试化学试题海南省儋州川绵中学2021-2022学年高一下学期期中考试(等级考)化学试题广东省汕头市潮阳区河溪中学2021-2022学年高一下学期期中考试化学试题江苏省徐州市沛县树恩高级中学2021-2022学年高二下学期期中测试化学试题湖北省随州市洛平许济四市联盟2022-2023学年高三上学期第一次质量检测化学试题甘肃省金昌市永昌县第一高级中学2022-2023学年高二上学期第一次月考化学试题湖南省长沙市长郡中学2022-2023学年高二上学期期中考试化学试题湖北省部分高中联考协作体2022-2023学年高二上学期期中考试化学试题陕西宝鸡市眉县槐芽中学2022-2023学年高二上学期期中考试化学试题广东省江门市新会华侨中学2022-2023学年高二上学期期中考试化学试题吉林省洮南市第一中学2022-2023学年高二上学期第一次(10月)月考化学试题浙江省玉环市玉城中学2022-2023学年高二上学期第一次月考化学试题 四川省凉山宁南中学2021-2022学年高二上学期第一次月考化学试题山东省滨州市沾化区实验高级中学2022-2023学年高二10月月考化学试题四川省广安第二中学2020-2021学年高二上学期第一次月考化学试题河北省唐山市滦南县第一中学2021-2022学年高二上学期期中考试化学试题甘肃省民勤县第四中学2021-2022学年高二上学期期中考试(实验班)化学试题云南省大理市下关第一中学2022-2023学年高二上学期段考(二)化学(B卷)试题贵州省贵阳市花溪第六中学2021-2022学年高二上学期月考化学试题陕西省渭南市尚德中学2021-2022学年高二上学期第二次质量检测化学试题辽宁省恒仁满族自治县第二高级中学2021-2022学年高二上学期期中考试化学试题江苏省南通市海安李堡中学2021-2022学年高二上学期期中考试化学试题陕西省安康市汉滨区江北高级中学2021-2022学年高二上学期第一次阶段性检测化学试题河南省鹤壁市第一中学2022-2023学年高二上学期期末检测化学试题天津市崇化中学2022-2023学年高二 上学期阶段性质量监测化学试卷天津市南开大学附属中学2022-2023学年高二上学期期末考试化学试卷湖北省荆州市沙市中学2022-2023学年高二上学期期末化学试题广东省汕尾华大实验学校2022-2023学年高二上学期12月月考化学试题云南省文山州砚山县第三高级中学2022-2023学年高一下学期3月月考化学试题四川省巴中市恩阳区2022-2023学年高二上学期1月期末化学试题(已下线)天津市第九十五中学益中学校2022-2023学年高一下学期期中考试化学试题广东省广州科学城中学2022-2023学年高一下学期期中考试化学试题广东省梅州市大埔县虎山中学2022-2023学年高二上学期12月月考化学试题陕西省西安市鄠邑区2022-2023学年高一下学期6月期末考试化学试题湖北省沙市中学2022-2023学年高二上学期1月期末考试化学试题云南省开远市第一中学校2022-2023学年高一下学期期中考试化学试题新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高二10月月考化学试题广东省深圳外国语学校2023-2024学年高二上学期10月月考化学试题【精品卷】2.1.1 化学反应速率课堂例题-人教版2023-2024学年选择性必修1陕西省西安市鄠邑区2023-2024学年高二上学期期中质量检测化学试题重庆市荣昌中学校2023-2024学年高二上学期期中考试化学试题广东省茂名市化州市第一中学2023-2024学年高二上学期期中测评化学试题上海市回民中学2023-2024学年高二上学期期中考试化学试题新疆喀什地区巴楚县第一中学2023-2024学年高二上学期1月期末化学试题新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高二上学期第三次月考化学试卷北京市石景山区2023-2024学年高二上学期期末考试化学试卷 吉林省普通高中友好学校联合体2023-2024学年高二上学期第三十七届基础年段期末联考化学试题山西省运城市2023-2024学年高二上学期10月月考化学试题-B卷河南省驻马店市环际大联考2023-2024学年高二上学期11月期中考试化学试题安徽省蚌埠市怀远禹泽、固镇县汉兴学校2023-2024学年高二上学期12月期末联考化学试题新疆维吾尔自治区皮山县高级中学2023-2024学年高二上学期1月期末化学试题江苏省淮安市涟水县第一中学2023-2024学年高二上学期第一次月考化学(选修)试卷
名校
8 .  的资源化利用能有效助力“碳中和”和“碳达峰”,工业上用
的资源化利用能有效助力“碳中和”和“碳达峰”,工业上用 与
与 催化合成甲醇,相关反应如下:
催化合成甲醇,相关反应如下:
请回答下列问题:
(1)
___________ (用含 、
、 的代数式表示)。
的代数式表示)。
(2)已知平衡常数 、
、 、
、 随温度变化的曲线如图所示:
随温度变化的曲线如图所示:
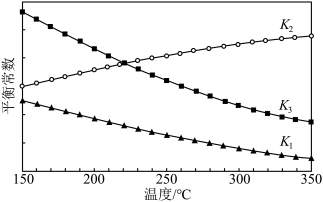
①
___________ 0(填“>”或“<”),判断依据为___________ 。
②
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)一定温度下,向2 L的恒容密闭容器中充入3 mol 和1 mol
和1 mol  ,只发生反应ⅰ和ⅱ,经过10 min后达到平衡状态,测得平衡时气体的压强是开始时的0.7倍,
,只发生反应ⅰ和ⅱ,经过10 min后达到平衡状态,测得平衡时气体的压强是开始时的0.7倍, 的平衡转化率为80%。
的平衡转化率为80%。
①0~10min内用 表示的平均反应速率
表示的平均反应速率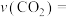
___________  。
。
②平衡时
___________  。该温度下反应ⅱ的化学平衡常数
。该温度下反应ⅱ的化学平衡常数
___________ 。
(4)在催化剂作用下,向某密闭容器中按 投料,发生反应ⅰ、ⅱ和ⅲ,研究发现,在180~250℃温度区域,随温度升高,平衡时混合气体的平均摩尔质量持续减小,在250℃以上区域,平衡时混合气体的平均摩尔质量几乎不变。试分析,250℃以上区域,随温度升高,平衡时混合气体的平均摩尔质量几乎不变的原因可能是
投料,发生反应ⅰ、ⅱ和ⅲ,研究发现,在180~250℃温度区域,随温度升高,平衡时混合气体的平均摩尔质量持续减小,在250℃以上区域,平衡时混合气体的平均摩尔质量几乎不变。试分析,250℃以上区域,随温度升高,平衡时混合气体的平均摩尔质量几乎不变的原因可能是___________ 。
 的资源化利用能有效助力“碳中和”和“碳达峰”,工业上用
的资源化利用能有效助力“碳中和”和“碳达峰”,工业上用 与
与 催化合成甲醇,相关反应如下:
催化合成甲醇,相关反应如下:| 相关反应 |  | 化学平衡常数(K) | |
| ⅰ |  |  |  |
| ⅱ | 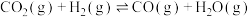 |  |  |
| ⅲ |  |  |  |
(1)

 、
、 的代数式表示)。
的代数式表示)。(2)已知平衡常数
 、
、 、
、 随温度变化的曲线如图所示:
随温度变化的曲线如图所示:
①

②

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)一定温度下,向2 L的恒容密闭容器中充入3 mol
 和1 mol
和1 mol  ,只发生反应ⅰ和ⅱ,经过10 min后达到平衡状态,测得平衡时气体的压强是开始时的0.7倍,
,只发生反应ⅰ和ⅱ,经过10 min后达到平衡状态,测得平衡时气体的压强是开始时的0.7倍, 的平衡转化率为80%。
的平衡转化率为80%。①0~10min内用
 表示的平均反应速率
表示的平均反应速率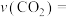
 。
。②平衡时

 。该温度下反应ⅱ的化学平衡常数
。该温度下反应ⅱ的化学平衡常数
(4)在催化剂作用下,向某密闭容器中按
 投料,发生反应ⅰ、ⅱ和ⅲ,研究发现,在180~250℃温度区域,随温度升高,平衡时混合气体的平均摩尔质量持续减小,在250℃以上区域,平衡时混合气体的平均摩尔质量几乎不变。试分析,250℃以上区域,随温度升高,平衡时混合气体的平均摩尔质量几乎不变的原因可能是
投料,发生反应ⅰ、ⅱ和ⅲ,研究发现,在180~250℃温度区域,随温度升高,平衡时混合气体的平均摩尔质量持续减小,在250℃以上区域,平衡时混合气体的平均摩尔质量几乎不变。试分析,250℃以上区域,随温度升高,平衡时混合气体的平均摩尔质量几乎不变的原因可能是
您最近一年使用:0次
2023-10-12更新
|
113次组卷
|
3卷引用:湖南省桃江县第一中学等校联考2023-2024学年高二上学期10月月考化学试题
名校
解题方法
9 . 对于反应 ,表示该反应速率最快的是
,表示该反应速率最快的是
 ,表示该反应速率最快的是
,表示该反应速率最快的是A. | B. |
C. | D. |
您最近一年使用:0次
2023-08-20更新
|
604次组卷
|
3卷引用:湖南省益阳市桃江县第四中学2023-2024学年高二上学期第一次月考化学试卷
名校
解题方法
10 . T0温度下,向2L真空密闭容器中加入N2O3固体,发生反应:N2O3(s) NO2(g)+X(g) (未配平),反应过程如图,下列说法正确的是
NO2(g)+X(g) (未配平),反应过程如图,下列说法正确的是
 NO2(g)+X(g) (未配平),反应过程如图,下列说法正确的是
NO2(g)+X(g) (未配平),反应过程如图,下列说法正确的是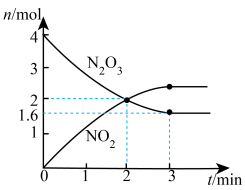
| A.X可能为N2 |
| B.0~2 min用N2O3表示的反应速率为1mol·min-1 |
| C.第2min时逆反应速率大于第4min时逆反应速率 |
| D.第4min时,保持温度和容积不变,向容器中再加入N2O3,混合气体颜色加深 |
您最近一年使用:0次
2023-08-19更新
|
1064次组卷
|
5卷引用:湖南省益阳市桃江县第四中学2023-2024学年高二上学期第一次月考化学试卷
湖南省益阳市桃江县第四中学2023-2024学年高二上学期第一次月考化学试卷(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河北省唐县第一中学2023-2024学年高二上学期9月月考化学试题安徽省安庆市岳西中学2023-2024学年高二上学期9月月考化学试题(已下线)选择题6-10



