1 . 甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可以用CO来生产燃料甲醇,反应原理为 。
。
(1)一定温度下,在容积为2L的恒容密闭容器中充入4.4mol 、2mol CO,进行上述反应,反应过程中
、2mol CO,进行上述反应,反应过程中 (g)的物质的量随时间的变化如图所示。
(g)的物质的量随时间的变化如图所示。
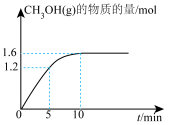
①0~5min内,
__________  。
。
②平衡时, (g)的体积分数为
(g)的体积分数为__________ %。
(2) 与
与 互为
互为_______________ (填“同素异形体”、“同分异构体”或“同系物”);写出 与乙酸发生反应的化学方程式:
与乙酸发生反应的化学方程式:_________________________________ ,该反应的反应类型为_____________ 。
(3) 可以直接燃烧提供能量,还可以设计成
可以直接燃烧提供能量,还可以设计成 -
- 燃料电池,提供电能。
燃料电池,提供电能。
① 应该从燃料电池的
应该从燃料电池的__________ (填“正”或“负”)极输入。
②写出电池工作时, 在电极上发生的电极反应:
在电极上发生的电极反应:___________________________________ (以KOH为电解质)。
③外电路中每通过2mol ,理论上消耗
,理论上消耗 的体积为
的体积为__________ L(标准状况下)。
 。
。(1)一定温度下,在容积为2L的恒容密闭容器中充入4.4mol
 、2mol CO,进行上述反应,反应过程中
、2mol CO,进行上述反应,反应过程中 (g)的物质的量随时间的变化如图所示。
(g)的物质的量随时间的变化如图所示。
①0~5min内,

 。
。②平衡时,
 (g)的体积分数为
(g)的体积分数为(2)
 与
与 互为
互为 与乙酸发生反应的化学方程式:
与乙酸发生反应的化学方程式:(3)
 可以直接燃烧提供能量,还可以设计成
可以直接燃烧提供能量,还可以设计成 -
- 燃料电池,提供电能。
燃料电池,提供电能。①
 应该从燃料电池的
应该从燃料电池的②写出电池工作时,
 在电极上发生的电极反应:
在电极上发生的电极反应:③外电路中每通过2mol
 ,理论上消耗
,理论上消耗 的体积为
的体积为
您最近一年使用:0次
名校
2 . 将气体 置于固定容积为2L的密闭容器中,发生如下反应:
置于固定容积为2L的密闭容器中,发生如下反应: ,反应进行到10s末,达到平衡,测得
,反应进行到10s末,达到平衡,测得 的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为
的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为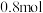 。
。
(1)用 表示
表示 内反应的平均反应速率为
内反应的平均反应速率为___________ 。
(2)反应前B的物质的量浓度是___________ 。
(3)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①增大压强___________ ;
②降低温度___________ 。
(4)下列叙述能说明该反应已达到化学平衡状态的是___________ (填标号)。
A.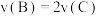
B. 的体积分数不再变化
的体积分数不再变化
C.容器内气体密度不再发生变化
D.容器内压强不再发生变化
E.相同时间内生成 的B的同时生成
的B的同时生成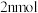 的D
的D
(5)向平衡后的容器中继续充入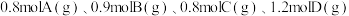 ,此时,v(正)
,此时,v(正)___________ v(逆)。(填“>”、“=”或“<”)
 置于固定容积为2L的密闭容器中,发生如下反应:
置于固定容积为2L的密闭容器中,发生如下反应: ,反应进行到10s末,达到平衡,测得
,反应进行到10s末,达到平衡,测得 的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为
的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为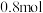 。
。(1)用
 表示
表示 内反应的平均反应速率为
内反应的平均反应速率为(2)反应前B的物质的量浓度是
(3)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①增大压强
②降低温度
(4)下列叙述能说明该反应已达到化学平衡状态的是
A.
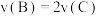
B.
 的体积分数不再变化
的体积分数不再变化C.容器内气体密度不再发生变化
D.容器内压强不再发生变化
E.相同时间内生成
 的B的同时生成
的B的同时生成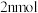 的D
的D(5)向平衡后的容器中继续充入
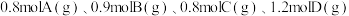 ,此时,v(正)
,此时,v(正)
您最近一年使用:0次
3 . 研究化学反应与能量变化,能使其更好地为生产和生活服务,如 的资源化利用能有效助力碳达峰、碳中和。
的资源化利用能有效助力碳达峰、碳中和。
已知 催化加氢可合成甲醇,反应方程式为:
催化加氢可合成甲醇,反应方程式为: 。
。
回答下列问题:
(1)由图1可知每生成
 放出的热量为
放出的热量为___________ 。(用含 、
、 的代数式表示)
的代数式表示)

(2)一定条件下,向体积为 的密闭容器中充入
的密闭容器中充入
 和
和
 ,发生上述反应,测得
,发生上述反应,测得 和
和 的浓度随时间变化如图2所示。
的浓度随时间变化如图2所示。

①平衡时 的转化率为
的转化率为___________ 。
②下列说法正确的是___________ 。
a.增大压强能加快该反应速率
b. 的浓度大小会影响该反应速率的快慢
的浓度大小会影响该反应速率的快慢
c.降低温度将减慢该反应速率
d.加入过量的 ,可使
,可使 的转化率达100%
的转化率达100%
(3)贵阳市目前拥有近两万辆甲醇汽年。甲醇即可以直接作为燃料提供动力,也可以设计成甲醇燃料电池,具有理论能量效率高的优点。某甲醇燃料电池工作原理如图3所示:

①电解质溶液中 向
向___________ 极移动(填“a”或“b”)。
②b极的电极反应式为___________ 。
③每消耗标准状况下
 ,电路中转移
,电路中转移___________  电子。
电子。
 的资源化利用能有效助力碳达峰、碳中和。
的资源化利用能有效助力碳达峰、碳中和。已知
 催化加氢可合成甲醇,反应方程式为:
催化加氢可合成甲醇,反应方程式为: 。
。回答下列问题:
(1)由图1可知每生成

 放出的热量为
放出的热量为 、
、 的代数式表示)
的代数式表示)
(2)一定条件下,向体积为
 的密闭容器中充入
的密闭容器中充入
 和
和
 ,发生上述反应,测得
,发生上述反应,测得 和
和 的浓度随时间变化如图2所示。
的浓度随时间变化如图2所示。
①平衡时
 的转化率为
的转化率为②下列说法正确的是
a.增大压强能加快该反应速率
b.
 的浓度大小会影响该反应速率的快慢
的浓度大小会影响该反应速率的快慢c.降低温度将减慢该反应速率
d.加入过量的
 ,可使
,可使 的转化率达100%
的转化率达100%(3)贵阳市目前拥有近两万辆甲醇汽年。甲醇即可以直接作为燃料提供动力,也可以设计成甲醇燃料电池,具有理论能量效率高的优点。某甲醇燃料电池工作原理如图3所示:

①电解质溶液中
 向
向②b极的电极反应式为
③每消耗标准状况下

 ,电路中转移
,电路中转移 电子。
电子。
您最近一年使用:0次
名校
4 . 把在空气中久置的铝片5.0g投入盛有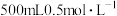 盐酸溶液的烧杯中,该铝片与盐酸反应产生氢气的速率与反应时间的关系可用下图所示的坐标曲线来表示,回答下列问题:
盐酸溶液的烧杯中,该铝片与盐酸反应产生氢气的速率与反应时间的关系可用下图所示的坐标曲线来表示,回答下列问题:
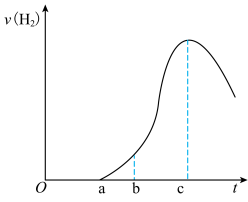
(1)曲线 段不产生氢气的原因是因为表面形成致密的氧化膜,写出离子方程式为
段不产生氢气的原因是因为表面形成致密的氧化膜,写出离子方程式为___________ ;
(2)曲线b→c段产生氢气的速率增加较快的主要原因是___________ ;
(3)曲线C以后的速率下降的主要原因___________ 。
(4)若反应进行了10s,收集标况下的氢气的体积为1.12L,用盐酸表示该反应的速率为___________ 。
(5)向溶液中加入少量的Cu,也能加快上述化学反应速率的原因___________ 。
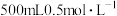 盐酸溶液的烧杯中,该铝片与盐酸反应产生氢气的速率与反应时间的关系可用下图所示的坐标曲线来表示,回答下列问题:
盐酸溶液的烧杯中,该铝片与盐酸反应产生氢气的速率与反应时间的关系可用下图所示的坐标曲线来表示,回答下列问题:
(1)曲线
 段不产生氢气的原因是因为表面形成致密的氧化膜,写出离子方程式为
段不产生氢气的原因是因为表面形成致密的氧化膜,写出离子方程式为(2)曲线b→c段产生氢气的速率增加较快的主要原因是
(3)曲线C以后的速率下降的主要原因
(4)若反应进行了10s,收集标况下的氢气的体积为1.12L,用盐酸表示该反应的速率为
(5)向溶液中加入少量的Cu,也能加快上述化学反应速率的原因
您最近一年使用:0次
名校
5 . I.SO2在工农业生产中有着重要的应用,请回答下列问题:
(1)工业上用软锰矿(主要成分为MnO2)制备Mn(H2PO4)2•2H2O。常用稀硫酸酸浸软锰矿,同时通入SO2,此时发生反应的离子方程式为_____ ,SO2作_____ (填“氧化剂”或“还原剂”)。
Ⅱ.一定温度下,向容积为2L的恒容密闭容器中通入2molSO2和1molO2,在一定条件下发生反应2SO2(g)+O2(g) 2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:
2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:
(2)下列说法能够判断上述反应达到化学平衡状态的是_____ (填标号)。
(3)上述反应体系的正反应速率和逆反应速率相等的时间段是_____ (填“0~4”、“4~8”、“8~12”“12~18”或“18~25”)min。
(4)0~8min内,用SO3表示该反应的平均速率为_____ mol•L-1•min-1,12min时,SO2的转化率为_____ 。
(5)若起始时容器内压强为p0MPa,则平衡时,容器内压强约为_____ (用含p0的代数式表示,保留2位有效数字)MPa。
(1)工业上用软锰矿(主要成分为MnO2)制备Mn(H2PO4)2•2H2O。常用稀硫酸酸浸软锰矿,同时通入SO2,此时发生反应的离子方程式为
Ⅱ.一定温度下,向容积为2L的恒容密闭容器中通入2molSO2和1molO2,在一定条件下发生反应2SO2(g)+O2(g)
 2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:
2SO3(g)。O2的物质的量随时间变化的实验数据如表所示:| 时间/min | 4 | 8 | 12 | 18 | 25 |
| n(O2)/mol | 0.70 | 0.50 | 0.40 | 0.32 | 0.32 |
| A.v(SO2)=2v(O2) | B.容器内气体的平均摩尔质量不再发生变化 |
| C.SO2和O2的浓度之比为2:1 | D.SO3的百分含量不再发生变化 |
(4)0~8min内,用SO3表示该反应的平均速率为
(5)若起始时容器内压强为p0MPa,则平衡时,容器内压强约为
您最近一年使用:0次
2023-05-03更新
|
281次组卷
|
3卷引用:贵州省遵义市红花岗区2022-2023学年高一下学期4月期中联考化学试题
6 . 常温下,在1L的密闭恒容容器中,A(s)、B(g)、C(g)、D (g) 4种物质的物质的量随时间的变化情况如下图所示,其中B(g)为黄色气体,C(g)、D(g)为无色气体。根据要求回答下列问题:
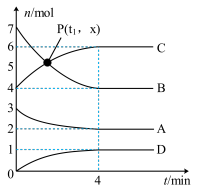
(1)在0 - 4min内,用C表示的化学反应速率v(C)=__________ 。
(2)写出所发生反应的化学方程式:___________ 物质后注明物质状态)。
(3)下列措施能提高上述化学反应速率的是___________ 。
a.升高反应温度 b.冲入氩气来增大压强 c. 加入2mol A d.加入1molB
(4)下列描述中能表明该反应达到平衡的有__________ 。
a.气体的总物质的量不再变化 b.混合气体的颜色不在变化
c. 混合气体的平均摩尔质量不再变化 d. 2v(B)=3v(C)
(5)提高B(g)的转化率的措施有____________________ (任写1条)。
(6)p点对应的物质的量的数值x =__________ ,该反应的平衡常数K=__________ 。

(1)在0 - 4min内,用C表示的化学反应速率v(C)=
(2)写出所发生反应的化学方程式:
(3)下列措施能提高上述化学反应速率的是
a.升高反应温度 b.冲入氩气来增大压强 c. 加入2mol A d.加入1molB
(4)下列描述中能表明该反应达到平衡的有
a.气体的总物质的量不再变化 b.混合气体的颜色不在变化
c. 混合气体的平均摩尔质量不再变化 d. 2v(B)=3v(C)
(5)提高B(g)的转化率的措施有
(6)p点对应的物质的量的数值x =
您最近一年使用:0次
7 . 回答下列问题
(1)在400℃时,将一定量的AB2和14molB2压入一个盛有催化剂的10L密闭容器中进行反应:2AB2+B2 2AB3,已知2min后,容器中剩余2molAB2和12molB2,则:
2AB3,已知2min后,容器中剩余2molAB2和12molB2,则:
①反应中消耗了_______ molAB2,2min后AB3的物质的量浓度是_______ 。
②2min内平均反应速率:v(B2)=_______ 。
③发生反应前容器内压强与发生反应后容器中压强比值为:_______ 。
(2)某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
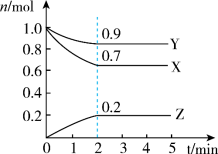
①Z的产率是_______ 。
②由图中所给数据进行分析,该反应的化学方程式为_______ 。
③若三种物质都是气体,则平衡时X所占体积的百分比为_______ 。
(1)在400℃时,将一定量的AB2和14molB2压入一个盛有催化剂的10L密闭容器中进行反应:2AB2+B2
 2AB3,已知2min后,容器中剩余2molAB2和12molB2,则:
2AB3,已知2min后,容器中剩余2molAB2和12molB2,则:①反应中消耗了
②2min内平均反应速率:v(B2)=
③发生反应前容器内压强与发生反应后容器中压强比值为:
(2)某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。

①Z的产率是
②由图中所给数据进行分析,该反应的化学方程式为
③若三种物质都是气体,则平衡时X所占体积的百分比为
您最近一年使用:0次
2022-10-25更新
|
402次组卷
|
2卷引用:贵州省黔西南州金成实验学校2022-2023学年高二上学期9月月考化学试题
8 . 一定条件下铁可以和CO2发生反应Fe2O3+3CO 2Fe+3CO2。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
2Fe+3CO2。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
(1)t1min时,正、逆反应速率的大小关系为v正_______ v逆(填“>”“<”或“=”)。
(2)0~4min内,CO2的转化率为_______ ,CO的平均反应速率,v(CO)=_______ 。
(3)下列条件的改变能减慢上述反应的反应速率的是_______ (填序号,下同)。

①降低温度 ②减少铁粉的质量 ③保持压强不变,充入He使容器的体积增大 ④保持体积不变,充入He使体系压强增大
(4)下列选项能说明上述反应已达平衡状态的是_______ 。
①v正(CO2)=v逆(CO)
②单位时间内生成nmolCO2的同时生成nmolCO
③容器中气体压强不随时间的变化而变化
④容器中气体的平均相对分子质量不随时间的变化而变化
 2Fe+3CO2。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
2Fe+3CO2。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。(1)t1min时,正、逆反应速率的大小关系为v正
(2)0~4min内,CO2的转化率为
(3)下列条件的改变能减慢上述反应的反应速率的是

①降低温度 ②减少铁粉的质量 ③保持压强不变,充入He使容器的体积增大 ④保持体积不变,充入He使体系压强增大
(4)下列选项能说明上述反应已达平衡状态的是
①v正(CO2)=v逆(CO)
②单位时间内生成nmolCO2的同时生成nmolCO
③容器中气体压强不随时间的变化而变化
④容器中气体的平均相对分子质量不随时间的变化而变化
您最近一年使用:0次
9 . 按要求作答
(1)在容积为5 L的密闭容器中,加入0.2 mol CO和0.2 mol H2O(g),在催化剂存在的条件下高温加热,发生反应CO(g)+H2O(g)⇌CO2(g)+H2(g),并放出热量。反应中CO2的浓度随时间变化的曲线如图所示。

根据图中数据,从反应开始至达到平衡时,CO的化学反应速率为_______ ;反应达到平衡时c(H2)=_______ ;判断该反应达到平衡状态的依据是_______ (填字母)。
A.单位时间内CO消耗的物质的量和CO2消耗的物质的量相等
B.CO、H2O、CO2、H2的浓度都相等
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.正、逆反应速率都为0
(2)在容积固定的绝热容器中发生反应2NO(g)+2CO(g) ⇌2CO2(g)+N2(g),不能说明该反应已达到平衡状态的是_______(填字母)。
(3)一定温度下,往2 L密闭容器中充入1 mol N2和3 mol H2,在一定条件下发生合成氨反应,2 min时达到平衡。测得平衡时混合气体中NH3的体积分数为25%。
则:0~2 min内,v(NH3)=_______ ;H2在平衡混合气中的体积分数=_______ ;平衡时容器的压强与起始时的压强之比为_______ ;能说明该反应进行到最大限度的是_______ (填字母)。
a.N2的转化率达到最大值
b.N2、H2和NH3的体积分数之比为1∶3∶2
c.体系内气体的密度保持不变
d.体系内物质的平均相对分子质量保持不变
(1)在容积为5 L的密闭容器中,加入0.2 mol CO和0.2 mol H2O(g),在催化剂存在的条件下高温加热,发生反应CO(g)+H2O(g)⇌CO2(g)+H2(g),并放出热量。反应中CO2的浓度随时间变化的曲线如图所示。

根据图中数据,从反应开始至达到平衡时,CO的化学反应速率为
A.单位时间内CO消耗的物质的量和CO2消耗的物质的量相等
B.CO、H2O、CO2、H2的浓度都相等
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.正、逆反应速率都为0
(2)在容积固定的绝热容器中发生反应2NO(g)+2CO(g) ⇌2CO2(g)+N2(g),不能说明该反应已达到平衡状态的是_______(填字母)。
| A.容器内温度不再变化 |
| B.1molN≡N断裂的同时,有2molCO消耗 |
| C.2v逆(NO)=v正(N2) |
| D.容器内混合气体的密度保持不变 |
则:0~2 min内,v(NH3)=
a.N2的转化率达到最大值
b.N2、H2和NH3的体积分数之比为1∶3∶2
c.体系内气体的密度保持不变
d.体系内物质的平均相对分子质量保持不变
您最近一年使用:0次
解题方法
10 . 一定温度下,向一体积为10L的恒容密闭容器中充入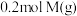 和
和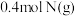 ,发生反应:
,发生反应: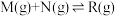 。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。回答下列问题:
。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。回答下列问题:

(1)实验a从反应开始至达到平衡时:
①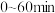 内,
内,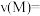
_______  。
。
②R的物质的量浓度为_______  。
。
③该反应的平衡常数
_______ 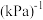 (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。
④反应达到平衡后,保持其他条件不变,向该容器中再充入0.05molM和0.15molR,此时v(正)_______ (填“>”、“<”或“=”)v(逆),判断的理由是_______ (写出计算过程)。
(2)若起始时只发生某一条件的改变,实验b改变的条件可能是_______ 。
(3)图中a、b、c三组实验从开始反应至达到平衡时的反应速率v(R)由大到小的顺序为_______ (填实验标号)。
(4)对于反应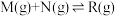 ,下列叙述能表明该反应已达到平衡状态的是_______(填标号)。
,下列叙述能表明该反应已达到平衡状态的是_______(填标号)。
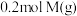 和
和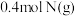 ,发生反应:
,发生反应: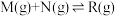 。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。回答下列问题:
。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。回答下列问题:
(1)实验a从反应开始至达到平衡时:
①
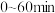 内,
内,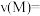
 。
。②R的物质的量浓度为
 。
。③该反应的平衡常数

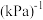 (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。④反应达到平衡后,保持其他条件不变,向该容器中再充入0.05molM和0.15molR,此时v(正)
(2)若起始时只发生某一条件的改变,实验b改变的条件可能是
(3)图中a、b、c三组实验从开始反应至达到平衡时的反应速率v(R)由大到小的顺序为
(4)对于反应
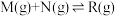 ,下列叙述能表明该反应已达到平衡状态的是_______(填标号)。
,下列叙述能表明该反应已达到平衡状态的是_______(填标号)。| A.混合气体的密度不随时间改变 |
| B.N的物质的量分数不随时间改变 |
| C.单位时间内生成1molN的同时消耗1molR |
| D.混合气体的平均相对分子质量不随时间改变 |
您最近一年使用:0次



