名校
解题方法
1 . 用Na2FeO4 溶液氧化废水中的还原性污染物 M,为研究降解效果。设计如下对比实验探究温度、浓度、pH 对降解速率和效果的影响,实验测得 M 的浓度与时间关系如图所示,下列说法错误的是
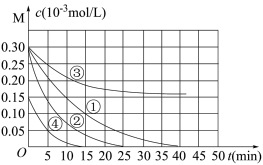

| 实验编号 | 温度℃ | pH |
| ① | 25 | 1 |
| ② | 45 | 1 |
| ③ | 25 | 7 |
| ④ | 25 | 1 |
| A.实验①在 15min 内 M 的降解速率为 1.33×10-5mol/(L·min) |
| B.实验①②说明升高温度,M 降解速率增大 |
| C.实验①③证明 pH 越高,越不利于 M 的降解 |
| D.实验②④说明 M 的浓度越小,降解的速率越慢 |
您最近一年使用:0次
2021-11-07更新
|
236次组卷
|
5卷引用:河南省郑州市第十九高级中学2022-2023学年高二上学期开学文理分科考试化学试题
河南省郑州市第十九高级中学2022-2023学年高二上学期开学文理分科考试化学试题(已下线)必考点02 化学反应速率-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)北京理工大学附属中学2021-2022学年高二上学期期中练习化学试题四川省成都市天府新区2021-2022学年高一下学期期末考试化学试题山西省晋中市平遥县第二中学校2021-2022学年高二上学期期中考试化学试题
名校
解题方法
2 . 对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。下列说法不正确的是


| A.图甲可通过观察气泡产生快慢来比较反应速率的大小 |
| B.图甲所示实验中,若左边试管里的反应速率大于右边的,则证明Fe3+对H2O2分解的催化效果比Cu2+的好 |
| C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间 |
| D.为检查乙装置的气密性,可关闭a处旋塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
您最近一年使用:0次
2021-10-10更新
|
281次组卷
|
7卷引用:河南省焦作市博爱县第一中学2023-2024学年高二上学期10月月考化学试题
解题方法
3 . 用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果。设计如下对比实验探究温度、浓度、pH对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法错误 的是


| A.实验①在15min内M的降解速率为1.33×10-5mol/(L·min) |
| B.实验①②说明升高温度,M降解速率增大 |
| C.实验①③证明pH越高,越不利于M的降解 |
| D.实验②④说明M的浓度越小,降解的速率越慢 |
您最近一年使用:0次
2021-08-16更新
|
579次组卷
|
3卷引用:河南省信阳市重点高中六校2020-2021学年高一下学期期末联合调研化学试题
河南省信阳市重点高中六校2020-2021学年高一下学期期末联合调研化学试题湖北省襄阳市、宜昌市、荆州市、荆门市等七市2020-2021学年高一下学期期末联考化学试题(已下线)2.1.2 影响化学反应速率的因素-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)
4 . 用煤炭制得的焦炭在工业上是重要的还原剂和燃料,用于许多物质的例备,如工业上用焦炭与硫酸钠反应制备硫化钠。反应方程式如下:Na2SO4+2C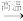 Na2S+CO2↑
Na2S+CO2↑
完成下列填空:
(1)上述反应的元素中,原子半径最小的元素的原子的核外电子排布式为___________ ,其最外层电子有 ___________ 种不同的能量,有 ___________ 种不同的运动状态。
(2)下列可以证明二氧化碳是非极性分子的事实是___________ (填编号)。
a.二氧化碳密度比空气大
b.二氧化碳能溶于水
c.液态二氧化碳在电场中通过不偏向
d.二氧化碳常温常压下为气态
(3)判断C、S两种元素非金属性的强弱,并写出一个能支持你的结论的实验事实___________ ,
(4)工业上利用焦炭与高温水蒸气反应制备水煤气,下面是水煤气反应的方程式:C(s)+H2O(g) CO(g)+H2(g)-Q(Q<0),写出上述反应的平衡常数表达式
CO(g)+H2(g)-Q(Q<0),写出上述反应的平衡常数表达式 ___________ ,增大该反应平衡常数的措施有 ___________ (填编号)
A.升温 B.增加水蒸气的浓度 C.减压 D.增加焦炭的量
(5)在一个2L的容器中进行该反应的实验,若混合气体的密度不变,(填“能”或“不能”)___________ 判断该反应已经达到平衡状态。若初始加入的C为16.8g,10min后为7.2g,则v(H2)=___________ 。
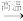 Na2S+CO2↑
Na2S+CO2↑完成下列填空:
(1)上述反应的元素中,原子半径最小的元素的原子的核外电子排布式为
(2)下列可以证明二氧化碳是非极性分子的事实是
a.二氧化碳密度比空气大
b.二氧化碳能溶于水
c.液态二氧化碳在电场中通过不偏向
d.二氧化碳常温常压下为气态
(3)判断C、S两种元素非金属性的强弱,并写出一个能支持你的结论的实验事实
(4)工业上利用焦炭与高温水蒸气反应制备水煤气,下面是水煤气反应的方程式:C(s)+H2O(g)
 CO(g)+H2(g)-Q(Q<0),写出上述反应的平衡常数表达式
CO(g)+H2(g)-Q(Q<0),写出上述反应的平衡常数表达式 A.升温 B.增加水蒸气的浓度 C.减压 D.增加焦炭的量
(5)在一个2L的容器中进行该反应的实验,若混合气体的密度不变,(填“能”或“不能”)
您最近一年使用:0次
解题方法
5 . 用 溶液氧化废水中的还原性污染物M,为研究降解效果。设计如下对比实验,探究温度、浓度、pH对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示:
溶液氧化废水中的还原性污染物M,为研究降解效果。设计如下对比实验,探究温度、浓度、pH对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示:

下列说法正确的是
 溶液氧化废水中的还原性污染物M,为研究降解效果。设计如下对比实验,探究温度、浓度、pH对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示:
溶液氧化废水中的还原性污染物M,为研究降解效果。设计如下对比实验,探究温度、浓度、pH对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示:| 实验编号 | 温度/℃ | pH |
| ① | 25 | 1 |
| ② | 45 | 1 |
| ③ | 25 | 7 |
| ④ | 25 | 1 |

下列说法正确的是
A.实验①在15min内M的降解速率为 |
| B.若其他条件相同,实验①②说明升高温度,M降解速率增大 |
| C.若其他条件相同,实验①③证明pH越小,越有利于M的降解 |
| D.实验②④说明M的浓度越小,降解的速率越慢 |
您最近一年使用:0次
6 . 氨作为一种重要的化工原料,应用广泛。请回答下列有关问题:
(1)实验室中采用铵盐制备氨气的化学方程式为___________ ,常用___________ 检验氨气的存在。下列尾气处理装置可用于吸收氨气的是___________ (填字母)。
A. B.
B.  C.
C.
(2)某温度下,在一个2L的恒容密闭容器中进行氨的合成,氨气、氮气和氢气三种物质的物质的量随时间的变化曲线如图所示。

①0~2min内,用氢气表示的平均反应速率为___________ 。
②下列能证明某恒温恒容密闭容器中的合成氨反应已达到平衡状态的是___________ (填字母)。
A.容器中混合气体的总压强保持不变
B.容器中 的体积分数保持不变
的体积分数保持不变
C.容器中 、
、 和
和 的物质的量之比为1∶3∶2
的物质的量之比为1∶3∶2
D.容器中 的正反应速率和
的正反应速率和 的逆反应速率相等
的逆反应速率相等
(3)在催化剂和加热的条件下,将氨气氧化为一氧化氮是工业制硝酸的重要反应,该反应的化学方程式是___________ 。在催化剂和加热条件下,氨气与一氧化氮也会发生反应生成无污染氮气,其化学方程式为___________ 。
(1)实验室中采用铵盐制备氨气的化学方程式为
A.
 B.
B.  C.
C.
(2)某温度下,在一个2L的恒容密闭容器中进行氨的合成,氨气、氮气和氢气三种物质的物质的量随时间的变化曲线如图所示。

①0~2min内,用氢气表示的平均反应速率为
②下列能证明某恒温恒容密闭容器中的合成氨反应已达到平衡状态的是
A.容器中混合气体的总压强保持不变
B.容器中
 的体积分数保持不变
的体积分数保持不变C.容器中
 、
、 和
和 的物质的量之比为1∶3∶2
的物质的量之比为1∶3∶2D.容器中
 的正反应速率和
的正反应速率和 的逆反应速率相等
的逆反应速率相等(3)在催化剂和加热的条件下,将氨气氧化为一氧化氮是工业制硝酸的重要反应,该反应的化学方程式是
您最近一年使用:0次
7 . 利用下列装置进行实验,不能达到实验目的的是
| 选项 | A | B | C | D |
| 装置 |  | 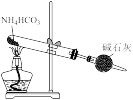 | 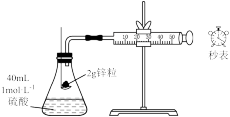 |  |
| 目的 | 测定葡萄酒中SO2的含量 | 制取少量干燥NH3 | 测定Zn与硫酸的化学反应速率 | 证明非金属性氯大于溴 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-06-12更新
|
1023次组卷
|
2卷引用:河南省豫北名校大联考2022届高三下学期阶段性测试(六)理科综合化学试题
解题方法
8 . 化学是一门以实验为基础的科学,某课外兴趣小组用实验进行探究影响化学反应速率的因素。
实验一:利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol·L-1、2mol·L-1、18.4 mol·L-1),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
该同学的实验目的是研究___________ 对反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持___________ 条件相同。
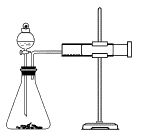
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。完成该实验应选用的实验药品是___________ ;应该测定的实验数据是___________ 。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(3)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是___________ 的影响。
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是___________。
实验三:丙同学为了研究硫酸铜的量对氢气生成速率的影响,设计了如下实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
(5)请完成此实验设计,其中:V1=___________ ,V6=___________ ,V9=___________ 。
实验一:利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol·L-1、2mol·L-1、18.4 mol·L-1),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
①分别取等体积的 硫酸于三支试管中; 硫酸于三支试管中;②分别投入大小、形状相同的Cu、Fe、Mg | 反应快慢:Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快 |
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。完成该实验应选用的实验药品是

实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(3)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是___________。
| A.硫酸钾 | B.硫酸锰 | C.水 | D.氯化锰 |
实验三:丙同学为了研究硫酸铜的量对氢气生成速率的影响,设计了如下实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
| 实验混合溶液 | A | B | C | D | E | F |
| V(4mol·L-1H2SO4)/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| V(饱和CuSO4溶液)/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| V(H2O) /mL | V7 | V8 | V9 | V10 | 10 | 0 |
您最近一年使用:0次
名校
解题方法
9 . 实验一:已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。
设计如下(所取溶液体积均为10mL):
(1)其他条件不变时:探究温度对化学反应速率的影响,应选择实验____________ (填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________ 对化学反应速率的影响。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响。
【实验内容及记录】
请回答:
(2)表中V1=___________ ,V2=___________ 。
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=________________________ 。
(4)在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是______________________ 的影响。
(5)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入______________ (填字母序号)。
A.硫酸钾B.硫酸锰C.氯化锰D.水
设计如下(所取溶液体积均为10mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol·L-1) | c(H2SO4)/(mol·L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响。
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 3mol/L稀硫酸 | 0.05mol/LKMnO4溶液 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | V1 | 2.7 |
| 3 | 1.0 | V2 | 2.0 | 3.0 | 3.9 |
(2)表中V1=
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=
(4)在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是
(5)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入
A.硫酸钾B.硫酸锰C.氯化锰D.水
您最近一年使用:0次
2020-11-26更新
|
304次组卷
|
5卷引用:河南省濮阳市2023-2024学年高二上学期9月月考化学试题
名校
解题方法
10 . 下列实验装置正确且能达到实验目的的是
A.测定一定时间内生成H2的反应速率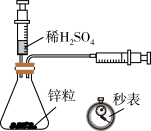 |
B.探究乙醇的还原性 |
C.吸收氨气制取氢氧化铝 |
D.证明非金属性:Cl>C>Si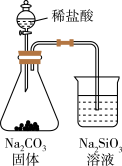 |
您最近一年使用:0次
2020-09-25更新
|
187次组卷
|
2卷引用:河南省周口恒大中学2023-2024学年高三上学期12月月考化学试题



