1 . 二甲醚是一种清洁能源,用水煤气制取二甲醚的原理如下:
I.CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
II.2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
500 K时,在2 L恒容密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则下列说法不正确的是
I.CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)II.2CH3OH(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)500 K时,在2 L恒容密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则下列说法不正确的是
| A.0~4 min,反应I的v(H2)=0.8 mol·L-1·min-1 |
| B.反应II中CH3OH的转化率为80% |
| C.反应I的平衡常数K=6.25 |
| D.容器总压强保持不变,可证明反应体系到达平衡状态 |
您最近一年使用:0次
名校
解题方法
2 . 某反应A(g)+B(g)→C(g)+D(g) 的速率方程为v=kcm(A) ·cn(B), 其中k是反应速率常数,受温度、催化剂的影响。其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为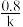 。改变反应物浓度时,反应的瞬时速率如表所示;
。改变反应物浓度时,反应的瞬时速率如表所示;
下列说法不正确的是
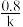 。改变反应物浓度时,反应的瞬时速率如表所示;
。改变反应物浓度时,反应的瞬时速率如表所示;| c(A)/(mol/L) | 0.25 | 0.50 | 1.00 | 0.50 | 1.00 | c1 |
| c(B)/(mol/L) | 0.050 | 0.050 | 0.100 | 0.100 | 0.200 | c2 |
| v/10-3mol/(L·min) | 1.6 | 3.2 | v1 | 3.2 | v2 | 4.8 |
| A.上述表格中的c1=0.75、v1=6.4 |
| B.该反应的速率常数k=6.4×10-4min-1 |
| C.在过量的B 存在时,反应掉75%的A所需的时间是250 min |
| D.升温、加入催化剂,均可使k增大导致反应的瞬时速率加快 |
您最近一年使用:0次
解题方法
3 . C、CO、 是常见还原剂。不同的反应,选择合理的还原剂以达到不同的工艺意图。工业上常见几种还原反应如下:
是常见还原剂。不同的反应,选择合理的还原剂以达到不同的工艺意图。工业上常见几种还原反应如下:
反应I:

反应Ⅱ:

反应Ⅲ:

反应Ⅳ:

反应V:
回答下列问题。
(1)从 的角度,说明反应I自发进行的可能性:
的角度,说明反应I自发进行的可能性:_______ 。
(2)①其他条件不变,分别测定CO还原FeO、 还原FeO反应体系中,平衡时
还原FeO反应体系中,平衡时 、CO体积分数与温度的关系如图所示。关于该类还原反应,有关说法不正确的是
、CO体积分数与温度的关系如图所示。关于该类还原反应,有关说法不正确的是_______ 。

A.温度越高,FeO被CO还原的程度越大
B.温度越低, 还原生成铁所需的
还原生成铁所需的 的浓度越大
的浓度越大
C.若 还原FeO活化能相对较小,则
还原FeO活化能相对较小,则 混合气体系中的还原FeO速率由
混合气体系中的还原FeO速率由 决定
决定
D. 宜在低温下进行
宜在低温下进行
②结合反应I及图示信息,说明随温度升高,在平衡体系中, 与CO还原FeO的能力发生变化的原因:
与CO还原FeO的能力发生变化的原因:_______ 。
③计算576℃反应Ⅲ的平衡常数K=_______ 。
(3)根据反应Ⅳ,在如图中分别画出 、
、 的能量变化,并进行必要的标注
的能量变化,并进行必要的标注_______ 。

(4)已知基元反应 的速率方程可表示为:
的速率方程可表示为: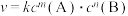 (k为速率常数,下同)。碰撞理论研究发现,大多数化学反应并不是经过简单的碰撞就能完成,往往需经过多个反应步骤才反应过程能实现。用
(k为速率常数,下同)。碰撞理论研究发现,大多数化学反应并不是经过简单的碰撞就能完成,往往需经过多个反应步骤才反应过程能实现。用 还原
还原 合成HI的反应
合成HI的反应 实际上经过两步基元反应完成的:
实际上经过两步基元反应完成的:


已知快反应近似平衡态。若在温度为T℃下, ,
, 。写出T℃下
。写出T℃下 反应的速率方程:v=
反应的速率方程:v=_______ (用含 、
、 、
、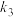 、a、b的代数式表示)
、a、b的代数式表示)
 是常见还原剂。不同的反应,选择合理的还原剂以达到不同的工艺意图。工业上常见几种还原反应如下:
是常见还原剂。不同的反应,选择合理的还原剂以达到不同的工艺意图。工业上常见几种还原反应如下:反应I:


反应Ⅱ:


反应Ⅲ:


反应Ⅳ:


反应V:

回答下列问题。
(1)从
 的角度,说明反应I自发进行的可能性:
的角度,说明反应I自发进行的可能性:(2)①其他条件不变,分别测定CO还原FeO、
 还原FeO反应体系中,平衡时
还原FeO反应体系中,平衡时 、CO体积分数与温度的关系如图所示。关于该类还原反应,有关说法不正确的是
、CO体积分数与温度的关系如图所示。关于该类还原反应,有关说法不正确的是
A.温度越高,FeO被CO还原的程度越大
B.温度越低,
 还原生成铁所需的
还原生成铁所需的 的浓度越大
的浓度越大C.若
 还原FeO活化能相对较小,则
还原FeO活化能相对较小,则 混合气体系中的还原FeO速率由
混合气体系中的还原FeO速率由 决定
决定D.
 宜在低温下进行
宜在低温下进行②结合反应I及图示信息,说明随温度升高,在平衡体系中,
 与CO还原FeO的能力发生变化的原因:
与CO还原FeO的能力发生变化的原因:③计算576℃反应Ⅲ的平衡常数K=
(3)根据反应Ⅳ,在如图中分别画出
 、
、 的能量变化,并进行必要的标注
的能量变化,并进行必要的标注
(4)已知基元反应
 的速率方程可表示为:
的速率方程可表示为: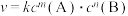 (k为速率常数,下同)。碰撞理论研究发现,大多数化学反应并不是经过简单的碰撞就能完成,往往需经过多个反应步骤才反应过程能实现。用
(k为速率常数,下同)。碰撞理论研究发现,大多数化学反应并不是经过简单的碰撞就能完成,往往需经过多个反应步骤才反应过程能实现。用 还原
还原 合成HI的反应
合成HI的反应 实际上经过两步基元反应完成的:
实际上经过两步基元反应完成的:

已知快反应近似平衡态。若在温度为T℃下,
 ,
, 。写出T℃下
。写出T℃下 反应的速率方程:v=
反应的速率方程:v= 、
、 、
、 、a、b的代数式表示)
、a、b的代数式表示)
您最近一年使用:0次
名校
解题方法
4 . 已知在溶液中可发生反应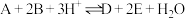 。在一定温度下,某实验小组用A、B的混合酸性溶液进行了三组实验,三组实验中
。在一定温度下,某实验小组用A、B的混合酸性溶液进行了三组实验,三组实验中 和
和 的浓度相等,
的浓度相等, 的起始浓度为
的起始浓度为 、
、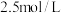 、
、 。测得
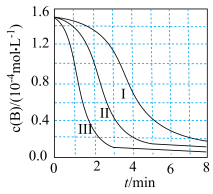
。测得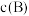 随时间t的变化曲线如下图,下列说法不正确的是
随时间t的变化曲线如下图,下列说法不正确的是
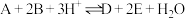 。在一定温度下,某实验小组用A、B的混合酸性溶液进行了三组实验,三组实验中
。在一定温度下,某实验小组用A、B的混合酸性溶液进行了三组实验,三组实验中 和
和 的浓度相等,
的浓度相等, 的起始浓度为
的起始浓度为 、
、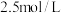 、
、 。测得
。测得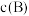 随时间t的变化曲线如下图,下列说法不正确的是
随时间t的变化曲线如下图,下列说法不正确的是
A.曲线Ⅲ起始时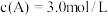 |
| B.该条件下三组实验的反应速率均随反应进程先增后减 |
C.起始时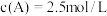 时, 时,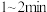 内, 内, 的平均反应速率为 的平均反应速率为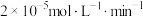 |
D.若曲线Ⅰ平衡时的 ,则该温度下该反应的平衡常数为 ,则该温度下该反应的平衡常数为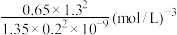 |
您最近一年使用:0次
名校
解题方法
5 . T℃,2NO2(g) N2O4(g) △H<0,该反应正、逆反应速率与浓度的关系为v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆为速率常数)。结合图像,下列说法错误的是
N2O4(g) △H<0,该反应正、逆反应速率与浓度的关系为v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆为速率常数)。结合图像,下列说法错误的是
 N2O4(g) △H<0,该反应正、逆反应速率与浓度的关系为v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆为速率常数)。结合图像,下列说法错误的是
N2O4(g) △H<0,该反应正、逆反应速率与浓度的关系为v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆为速率常数)。结合图像,下列说法错误的是
| A.图中表示lgv逆~lgc(N2O4)的线是n |
| B.当2v正(N2O4)=v逆(NO2)时,说明反应达到平衡状态 |
| C.T℃时,向2L的容器中充入5molN2O4气体和1molNO2气体,此时v正<v逆 |
| D.T℃时,向刚性容器中充入一定量NO2气体,平衡后测得c(N2O4)为1.0mol•L-1,则平衡时,v正的数值为10a |
您最近一年使用:0次
2023-04-25更新
|
613次组卷
|
2卷引用:湖南省永州市2023届高三第三次适应性考试(三模)化学试题
6 . 我国提出争取在2030年前实现碳峰值、2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。将CO2 转化为清洁能源是促进碳中和最直接有效的方法。
(1)H2还原CO2制取CH4的部分反应如下:
①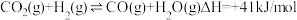
②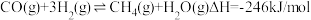
③
反应2C(s)+2H2O(g)=CH4(g)+CO2(g)的∆H=___________ kJ/mol。
(2)恒温条件下,向2L恒容密闭容器中充入1molCO和2molH2,只发生如下反应:CO(g)+3H2 (g)=CH4(g)+H2O(g),反应4min后,测得CO的物质的量为0.8mol,下列有关说法正确的是___________ (填字母。)
A. 利用合适的催化剂可增大该反应的平衡常数
B. 容器内气体的平均相对分子质量保持不变,说明该反应达到平衡状态
C. 用 H2表示该反应4min内的平均速率为0.075mol·L-1·s-1
D. 其它条件不变,升高温度,CO的平衡转化率降低
(3)在一定条件下,向某0.5L恒容密闭容器中充入xmolCO2和ymolH2,发生反应:
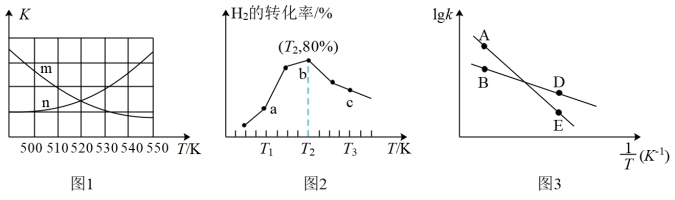
①图1中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线___________ (填“m” 或“n”),判断依据是___________ 。
②若x=2、y=3,测得在相同时间内,不同温度下H 2的转化率如图2所示,v(a) 逆___________ v(c) 逆(填“>”、<”或“=”);T2时,起始压强为2.5MPa,则Kp=___________ MPa-2(保留二位小数;K p为以分压表示的平衡常数,分压=总压×物质的量分数)。
③已知速率方程 v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度影响。图3表示速率常数的对数lgk与温度的倒数 之间的关系,A、B、D、E分别代表图2中a点、c点的lgk,其中表示c点的lgk逆的是
之间的关系,A、B、D、E分别代表图2中a点、c点的lgk,其中表示c点的lgk逆的是___________ (填“A”、“B”、“D”或“E”)。
(1)H2还原CO2制取CH4的部分反应如下:
①
②
③

反应2C(s)+2H2O(g)=CH4(g)+CO2(g)的∆H=
(2)恒温条件下,向2L恒容密闭容器中充入1molCO和2molH2,只发生如下反应:CO(g)+3H2 (g)=CH4(g)+H2O(g),反应4min后,测得CO的物质的量为0.8mol,下列有关说法正确的是
A. 利用合适的催化剂可增大该反应的平衡常数
B. 容器内气体的平均相对分子质量保持不变,说明该反应达到平衡状态
C. 用 H2表示该反应4min内的平均速率为0.075mol·L-1·s-1
D. 其它条件不变,升高温度,CO的平衡转化率降低
(3)在一定条件下,向某0.5L恒容密闭容器中充入xmolCO2和ymolH2,发生反应:


①图1中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线
②若x=2、y=3,测得在相同时间内,不同温度下H 2的转化率如图2所示,v(a) 逆
③已知速率方程 v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度影响。图3表示速率常数的对数lgk与温度的倒数
 之间的关系,A、B、D、E分别代表图2中a点、c点的lgk,其中表示c点的lgk逆的是
之间的关系,A、B、D、E分别代表图2中a点、c点的lgk,其中表示c点的lgk逆的是
您最近一年使用:0次
2022-04-09更新
|
1113次组卷
|
6卷引用:吉林省长春市2022届高三质量监测线上考试(三)理综化学试题
吉林省长春市2022届高三质量监测线上考试(三)理综化学试题(已下线)【奋进985】05-备战2022年高考化学名校进阶模拟卷(通用版)湖北省襄阳市第五中学2022届高三适应性考试(一)化学试题湖南省浏阳市第一中学2022届高三下学期期中考试化学试题江西省重点校2022-2023学年高三上学期第三次联考化学试题.(已下线)化学反应速率和化学平衡
7 . 利用 和CO反应生成
和CO反应生成 的过程中主要涉及的反应如下:
的过程中主要涉及的反应如下:
反应Ⅰ
 kJ⋅mol-1
kJ⋅mol-1
反应Ⅱ
 kJ⋅mol-1
kJ⋅mol-1
[ 的产率
的产率 ,
, 的选择性
的选择性 ]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时
]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时 和
和 的产率及CO和
的产率及CO和 的转化率随
的转化率随 的变化情况如图所示。下列说法不正确的是
的变化情况如图所示。下列说法不正确的是
 和CO反应生成
和CO反应生成 的过程中主要涉及的反应如下:
的过程中主要涉及的反应如下:反应Ⅰ

 kJ⋅mol-1
kJ⋅mol-1反应Ⅱ

 kJ⋅mol-1
kJ⋅mol-1[
 的产率
的产率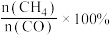 ,
, 的选择性
的选择性 ]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时
]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时 和
和 的产率及CO和
的产率及CO和 的转化率随
的转化率随 的变化情况如图所示。下列说法不正确的是
的变化情况如图所示。下列说法不正确的是
| A.当容器内气体总压不变时,反应Ⅱ达到平衡状态 |
B.曲线c表示 的产率随 的产率随 的变化 的变化 |
C.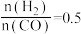 ,反应达平衡时, ,反应达平衡时, 的选择性为50% 的选择性为50% |
D.随着 增大, 增大, 的选择性先增大后减小 的选择性先增大后减小 |
您最近一年使用:0次
2023-05-27更新
|
1740次组卷
|
6卷引用:江苏省南通市2023届高三下学期第四次模拟考试化学试题
名校
解题方法
8 . 一定条件下向某密闭容器中加入 、
、 和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,
和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,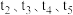 时刻各改变一种条件,且改变的条件均不同。若
时刻各改变一种条件,且改变的条件均不同。若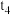 时刻改变的条件是压强,则下列说法错误的是
时刻改变的条件是压强,则下列说法错误的是
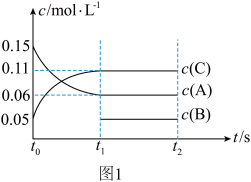
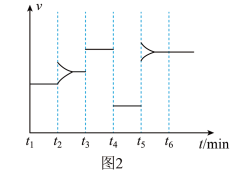
 、
、 和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,
和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系, 时刻各改变一种条件,且改变的条件均不同。若
时刻各改变一种条件,且改变的条件均不同。若 时刻改变的条件是压强,则下列说法错误的是
时刻改变的条件是压强,则下列说法错误的是

A.若 ,则前 ,则前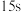 的平均反应速率 的平均反应速率 |
B.该反应的化学方程式为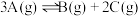 |
C.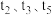 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度 |
D.B的起始物质的量为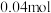 |
您最近一年使用:0次
2023-01-17更新
|
816次组卷
|
21卷引用:山西省实验中学2018届高三上学期学业质量监测化学试题
山西省实验中学2018届高三上学期学业质量监测化学试题黑龙江省大庆市铁人中学2018-2019学年高一下学期期末化学试题江西省吉安市遂川中学2019—2020学年高二上学期第一次月考化学试题(A)黑龙江省大庆实验中学2019-2020学年高二上学期第一次月考化学试题甘肃省天水市天水一中2019-2020学年高二(普通班)上学期第一次月考化学(理)试题天津市六校(静海一中,杨村中学,宝坻一中,大港一中等)2019-2020学年高二上学期期中联考化学试题天津市七校2019-2020学年高二上学期期中联考化学试题广东省揭阳市惠来县第一中学2019-2020学年高二上学期期中考试化学试题2020届高三化学二轮冲刺新题专练——化学反应速率的图像分析(提升练)黑龙江省鹤岗市第一中学2019-2020学年高一下学期期末考试化学试题(已下线)第17讲 化学平衡计算与图像-2021年高考化学一轮复习名师精讲练鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时2 反应条件对化学平衡的影响高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素(已下线)第二章 化学反应速率与化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)山西省运城市景胜中学2020-2021学年高二10月月考化学试题河南省许昌市第三中学2020-2021学年高二3月月考化学试题选择性必修1 专题2 第三单元 课时1 影响化学平衡的因素(已下线)6.2.2 化学平衡(第2课时 化学平衡移动)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)河南省商丘市回民中学2022-2023学年高三上学期期末考试(线上)化学试题黑龙江省牡丹江市第三高级中学2023-2024学年高二上学期期中考试化学试题四川省广安市华蓥中学2023-2024学年高二上学期12月月考化学试题
2022高三·全国·专题练习
解题方法
9 . 通过计算机分析,我们可从势能图(峰值数据是峰谷和峰值物质能量的差值)认识 加氢制甲醇在不同催化条件下存在的两种反应路径,如图1所示。
加氢制甲醇在不同催化条件下存在的两种反应路径,如图1所示。

(1)①写出甲酸盐路径决速步的化学方程式___________ 。
②下列说法正确的有___________ 。
A.增大催化剂表面积可提高 在催化剂表面的吸附速率
在催化剂表面的吸附速率
B.不考虑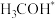 ,两种路径中产生的含碳中间体种类均有5种
,两种路径中产生的含碳中间体种类均有5种
C.中间体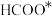 比
比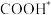 更稳定
更稳定
D.使用高活性催化剂可降低反应焓变,加快反应速率
(2)向恒压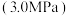 密闭装置中通入反应物混合气[混合比例
密闭装置中通入反应物混合气[混合比例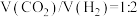 ],测定甲醇的平均生成速率随温度的变化曲线,如图2所示。
],测定甲醇的平均生成速率随温度的变化曲线,如图2所示。
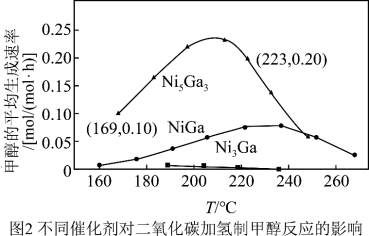
①甲醇的平均生成速率呈“抛物线”形状的原因___________ ,最佳催化剂及最佳反应温度是___________ 。
②二氧化碳加氢制甲醇的速率方程可表示为: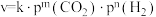 ,其中k为速率常数,各物质起始分压的指数为各物质的反应级数。实验结果表明,速率常数与反应级数均受反应温度的影响。使用
,其中k为速率常数,各物质起始分压的指数为各物质的反应级数。实验结果表明,速率常数与反应级数均受反应温度的影响。使用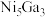 催化剂时,反应温度由
催化剂时,反应温度由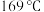 升高到
升高到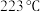 ,若
,若 反应级数
反应级数 ,
, 反应级数不变,则速率常数之比
反应级数不变,则速率常数之比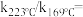
___________ 。
(3)在 催化加氢制甲醇过程中也存在竞争性的反应:
催化加氢制甲醇过程中也存在竞争性的反应: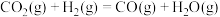
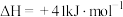 。在恒温密闭容器中,维持压强和投料不变,将
。在恒温密闭容器中,维持压强和投料不变,将 和
和 按一定流速通过反应器,二氧化碳转化率和甲醇选择性
按一定流速通过反应器,二氧化碳转化率和甲醇选择性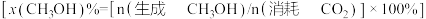 随温度变化关系如图3所示。
随温度变化关系如图3所示。
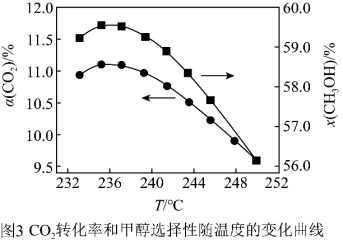
①若 时催化剂活性受温度影响不大,则
时催化剂活性受温度影响不大,则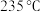 后图中曲线下降的原因
后图中曲线下降的原因___________ 。
②某温度时,向压强为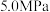 的恒压装置中加入
的恒压装置中加入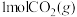 和
和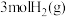 反应并达到平衡状态,
反应并达到平衡状态, 平衡转化率为
平衡转化率为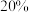 ,甲醇选择性为
,甲醇选择性为 ,则甲醇的平衡分压为
,则甲醇的平衡分压为___________ (结果保留2位有效数字) 。
 加氢制甲醇在不同催化条件下存在的两种反应路径,如图1所示。
加氢制甲醇在不同催化条件下存在的两种反应路径,如图1所示。
(1)①写出甲酸盐路径决速步的化学方程式
②下列说法正确的有
A.增大催化剂表面积可提高
 在催化剂表面的吸附速率
在催化剂表面的吸附速率B.不考虑
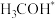 ,两种路径中产生的含碳中间体种类均有5种
,两种路径中产生的含碳中间体种类均有5种C.中间体
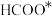 比
比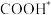 更稳定
更稳定D.使用高活性催化剂可降低反应焓变,加快反应速率
(2)向恒压
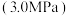 密闭装置中通入反应物混合气[混合比例
密闭装置中通入反应物混合气[混合比例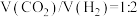 ],测定甲醇的平均生成速率随温度的变化曲线,如图2所示。
],测定甲醇的平均生成速率随温度的变化曲线,如图2所示。
①甲醇的平均生成速率呈“抛物线”形状的原因
②二氧化碳加氢制甲醇的速率方程可表示为:
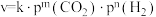 ,其中k为速率常数,各物质起始分压的指数为各物质的反应级数。实验结果表明,速率常数与反应级数均受反应温度的影响。使用
,其中k为速率常数,各物质起始分压的指数为各物质的反应级数。实验结果表明,速率常数与反应级数均受反应温度的影响。使用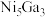 催化剂时,反应温度由
催化剂时,反应温度由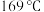 升高到
升高到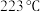 ,若
,若 反应级数
反应级数 ,
, 反应级数不变,则速率常数之比
反应级数不变,则速率常数之比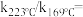
(3)在
 催化加氢制甲醇过程中也存在竞争性的反应:
催化加氢制甲醇过程中也存在竞争性的反应: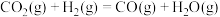
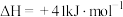 。在恒温密闭容器中,维持压强和投料不变,将
。在恒温密闭容器中,维持压强和投料不变,将 和
和 按一定流速通过反应器,二氧化碳转化率和甲醇选择性
按一定流速通过反应器,二氧化碳转化率和甲醇选择性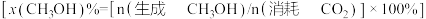 随温度变化关系如图3所示。
随温度变化关系如图3所示。
①若
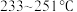 时催化剂活性受温度影响不大,则
时催化剂活性受温度影响不大,则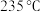 后图中曲线下降的原因
后图中曲线下降的原因②某温度时,向压强为
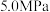 的恒压装置中加入
的恒压装置中加入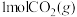 和
和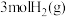 反应并达到平衡状态,
反应并达到平衡状态, 平衡转化率为
平衡转化率为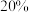 ,甲醇选择性为
,甲醇选择性为 ,则甲醇的平衡分压为
,则甲醇的平衡分压为
您最近一年使用:0次
名校
10 . 向2l恒温恒容容器中加入2molMgSO4并充入2molCO,发生反应:MgSO4(s)+ CO(g) MgO(s)+ CO2(g)+SO2(g)△H>0。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
MgO(s)+ CO2(g)+SO2(g)△H>0。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是

 MgO(s)+ CO2(g)+SO2(g)△H>0。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
MgO(s)+ CO2(g)+SO2(g)△H>0。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
| A.0 ~2min内平均反应速率v(SO2)= 0.3 mol·l-1·min-1 |
| B.2 ~4min内容器内气体的密度没有变化 |
| C.该温度下,反应的平衡常数为1.8 |
| D.保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 molCO,反应达到平衡时,n(CO2)>0.60 mol |
您最近一年使用:0次
2017-11-11更新
|
445次组卷
|
6卷引用:甘肃省会宁县第一中学2017-2018学年高二上学期期中考试(理)化学试题



