1 . KMnO4在生产和生活中有着广泛用途,某化学小组在实验室制备KMnO4并探究其性质。
(一) KMnO4的制备,分步骤Ⅰ、Ⅱ两步进行。
步聚Ⅰ.先利用如图所示装置制备K2MnO4。称取7.0gKOH(s)和5.0gKClO3(s)放入容器A中,加热,待混合物熔融后,加入5.0gMnO2(s),待反应物干涸后,加大火焰强热4~8min,得墨绿色的锰酸钾。
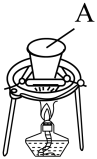
(1)A可选用_______ (填标号)。
①石英坩埚 ②瓷坩埚 ③铁坩埚
(2)实验中发生反应生成K2MnO4的化学方程式为_______ 。
Ⅱ.由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①待A处物料冷却后,用20mL4%KOH溶液重复浸取,合并浸取液便得墨绿色的锰酸钾溶液。
②向滤液中通入足量CO2,使K2MnO4歧化为KMnO4和MnO2,过滤出生成的MnO2。
③再将滤液进行一系列处理,得KMnO4晶体。
(3)过程②向滤液中通入足量CO2,可观察到的现象为_______ ;检验K2MnO4歧化完全的实验方法是_______ 。
(二) KMnO4的性质。已知:KMnO4具有强氧化性,可与草酸(H2C2O4)反应: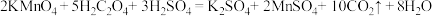 。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
[实验内容及记录的数据]
(4)配制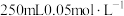 的高锰酸钾溶液肯定不需要的仪器是
的高锰酸钾溶液肯定不需要的仪器是_______ (填标号)。
a.蒸发皿 b.容量瓶 c.玻璃棒 d.烧杯 e.坩埚 f.胶头滳管
(5)为达到实验目的,H2C2O4溶液的物质的量浓度不低于_______ 。
(6)利用实验1中数据计算,0~4min内,用KMnO4的浓度变化表示的反应速率:
_______ 。
(一) KMnO4的制备,分步骤Ⅰ、Ⅱ两步进行。
步聚Ⅰ.先利用如图所示装置制备K2MnO4。称取7.0gKOH(s)和5.0gKClO3(s)放入容器A中,加热,待混合物熔融后,加入5.0gMnO2(s),待反应物干涸后,加大火焰强热4~8min,得墨绿色的锰酸钾。

(1)A可选用
①石英坩埚 ②瓷坩埚 ③铁坩埚
(2)实验中发生反应生成K2MnO4的化学方程式为
Ⅱ.由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①待A处物料冷却后,用20mL4%KOH溶液重复浸取,合并浸取液便得墨绿色的锰酸钾溶液。
②向滤液中通入足量CO2,使K2MnO4歧化为KMnO4和MnO2,过滤出生成的MnO2。
③再将滤液进行一系列处理,得KMnO4晶体。
(3)过程②向滤液中通入足量CO2,可观察到的现象为
(二) KMnO4的性质。已知:KMnO4具有强氧化性,可与草酸(H2C2O4)反应:
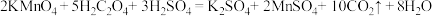 。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:[实验内容及记录的数据]
| 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
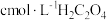 溶液 溶液 |  | 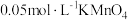 溶液 溶液 | 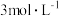 稀硫酸 稀硫酸 | ||
| 1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
| 2 | 2.0 | 2.0 | 4.0 | 2.0 | 5.2 |
| 3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
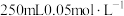 的高锰酸钾溶液肯定不需要的仪器是
的高锰酸钾溶液肯定不需要的仪器是a.蒸发皿 b.容量瓶 c.玻璃棒 d.烧杯 e.坩埚 f.胶头滳管
(5)为达到实验目的,H2C2O4溶液的物质的量浓度不低于
(6)利用实验1中数据计算,0~4min内,用KMnO4的浓度变化表示的反应速率:

您最近半年使用:0次
2023-05-11更新
|
320次组卷
|
3卷引用:辽宁省抚顺市重点高中六校协作体2023届高三下学期二模联考化学试题
名校
2 . KMnO4在生产和生活中有着广泛用途,某化学小组在实验室制备KMnO4并探究其性质。
(一)KMnO4的制备,分步骤I、II两步进行。
步骤I:先利用如图所示装置制备K2MnO4


(1)装置A应选用______ (填a、b或c)。
(2)装置B中所盛试剂的名称为______ 。
(3)装置C处反应生成K2MnO4的化学方程式为______ 。
步骤II:由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①充分反应后,将装置C处所得固体加水溶解,过滤;
②向滤液中通入足量CO2,过滤出生成的MnO2;
③再将滤液进行一系列处理,得KMnO4晶体。
(4)过程②向滤液中通入足量CO2,可观察到的现象为______ ;
(二) KMnO4的性质。已知:KMnO4具有强氧化性,可与草酸(H2C2O4)反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。某化学小组选用酸性高锰酸钾溶液和草酸溶液,探究外界条件对化学反应速率的影响,进行了如下三组实验:
[实验内容及记录]
(5)为完成实验目的,H2C2O4溶液的物质的量浓度不低于______ 。
(6)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)=______ 。
(一)KMnO4的制备,分步骤I、II两步进行。
步骤I:先利用如图所示装置制备K2MnO4


(1)装置A应选用
(2)装置B中所盛试剂的名称为
(3)装置C处反应生成K2MnO4的化学方程式为
步骤II:由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①充分反应后,将装置C处所得固体加水溶解,过滤;
②向滤液中通入足量CO2,过滤出生成的MnO2;
③再将滤液进行一系列处理,得KMnO4晶体。
(4)过程②向滤液中通入足量CO2,可观察到的现象为
(二) KMnO4的性质。已知:KMnO4具有强氧化性,可与草酸(H2C2O4)反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。某化学小组选用酸性高锰酸钾溶液和草酸溶液,探究外界条件对化学反应速率的影响,进行了如下三组实验:
[实验内容及记录]
| 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 一定浓度mol·L-1 H2C2O4溶液 | H2O | 0.05 mol·L-1 KMnO4溶液 | 3 mol·L-1稀硫酸 | ||
| 1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
| 2 | 2.0 | 2.0 | 4.0 | 2.0 | 5.2 |
| 3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
(6)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)=
您最近半年使用:0次
名校
解题方法
3 . 以下实验目的、方法和相关解释都正确的是
| 选项 | 实验目的 | 实验方法 | 相关解释 |
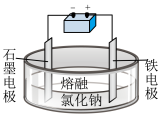
| A | 电解熔融氯化钠 |
| 该装置阳极反应为2Cl--2e-=Cl2 |
| B | 金属防腐 |
| 该图采用的是外加电流法对铁管道进行保护 |
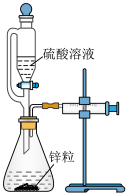
| C | 测量锌粒和不同浓度的硫酸溶液反应速率的快慢 |
| 该实验用到的实验仪器有恒压滴液漏斗、锥形瓶、双孔塞、注射器 |
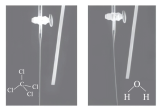
| D | 验证分子极性 |
| 该实验是用毛皮摩擦过的橡胶棒靠近 和 和 ,由图中现象可知 ,由图中现象可知 为非极性分子, 为非极性分子, 为极性分子 为极性分子 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2024-04-05更新
|
215次组卷
|
4卷引用:2024届河北省雄安新区雄安部分高中高三下学期一模化学试题
名校
解题方法
4 . 阅读题目,回答问题:
(1)FeCl3常用于腐蚀印刷电路铜板,若将此反应设计成原电池,请写出该原电池正极电极反应为___________ 。
(2)为探究 在
在 制取
制取 反应中的作用,某兴趣小组进行下列实验:向试管中加入
反应中的作用,某兴趣小组进行下列实验:向试管中加入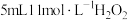 溶液,静置几分钟,无明显现象;滴加2滴
溶液,静置几分钟,无明显现象;滴加2滴 溶液,立即产生大量气泡,加
溶液,立即产生大量气泡,加 溶液反应
溶液反应 后,
后, 的浓度变为
的浓度变为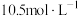 ,则20min内H2O2的平均反应速率为
,则20min内H2O2的平均反应速率为___________ 。
(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。填写表中空白内容:
(4)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。
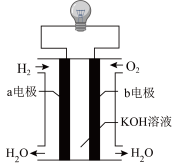
①该电池的正极是电极___________ (填“a”或“b”),负极发生反应的方程式为___________ 。
②电池工作时,当外电路中转移 电子时,消耗的
电子时,消耗的 在标准状况下体积为
在标准状况下体积为___________ 。
(1)FeCl3常用于腐蚀印刷电路铜板,若将此反应设计成原电池,请写出该原电池正极电极反应为
(2)为探究
 在
在 制取
制取 反应中的作用,某兴趣小组进行下列实验:向试管中加入
反应中的作用,某兴趣小组进行下列实验:向试管中加入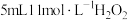 溶液,静置几分钟,无明显现象;滴加2滴
溶液,静置几分钟,无明显现象;滴加2滴 溶液,立即产生大量气泡,加
溶液,立即产生大量气泡,加 溶液反应
溶液反应 后,
后, 的浓度变为
的浓度变为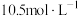 ,则20min内H2O2的平均反应速率为
,则20min内H2O2的平均反应速率为(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。填写表中空白内容:
| 试管编号 | 实验目的 |  溶液 溶液 | 温度 | 水的体积/mL |  溶液体积/mL 溶液体积/mL | |
| 质量分数 | 体积/mL | |||||
| I | 为编号Ⅱ实验的参照 | 12% | 5.0 | 常温 | 0 | 0 |
| Ⅱ | 温度对反应速率的影响 | 12% | 5.0 | 60℃ | 0 | 0 |
| Ⅲ | 为编号Ⅳ实验的参照 | 4.0% | 5.0 | 常温 | ① | 0 |
| Ⅳ | ② | 4.0% | 5.0 | 常温 | 0 | 1.0 |

①该电池的正极是电极
②电池工作时,当外电路中转移
 电子时,消耗的
电子时,消耗的 在标准状况下体积为
在标准状况下体积为
您最近半年使用:0次
2023-05-16更新
|
229次组卷
|
2卷引用:广东省广州市第六十五中学2022-2023学年高一下学期期中考试化学试题
名校
5 . 阅读题目,回答问题:
(1)FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为____ ,若将此反应设计成原电池,请写出该原电池负极电极反应为____ ,正极电极反应为____ 。
(2)为探究FeCl3在H2O2制取O2反应中的作用,某兴趣小组进行下列实验:向试管中加入5mL11mol·L-1H2O2溶液,静置几分钟,无明显现象;滴加2滴1mol·L-1FeCl3溶液,立即产生大量气泡。(已知H2O2不与Cl-反应)
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5mol·L-1,则20min内H2O2的平均反应速率为_____ 。
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以实验,可推断出:在H2O2制O2反应中,FeCl3作____ 剂。
(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。
填写表中空白内容:II____ ,III____ ,IV____ 。
(4)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。

①该电池的正极是电极____ (填“a”或“b”),负极发生反应的方程式为____ 。
②电池工作时,溶液中的K+会向____ 区移动(填“正极”或“负极”),当外电路中转移1mol电子时,消耗的O2在标准状况下体积为____ 。
(1)FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为
(2)为探究FeCl3在H2O2制取O2反应中的作用,某兴趣小组进行下列实验:向试管中加入5mL11mol·L-1H2O2溶液,静置几分钟,无明显现象;滴加2滴1mol·L-1FeCl3溶液,立即产生大量气泡。(已知H2O2不与Cl-反应)
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5mol·L-1,则20min内H2O2的平均反应速率为
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以实验,可推断出:在H2O2制O2反应中,FeCl3作
(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。
| 试管编号 | 实验目的 | H2O2溶液 | 温度 | 水的体积/mL | FeCl3溶液体积/mL | |
| 质量分数 | 体积/mL | |||||
| I | 为编号II实验的参照 | 12% | 5.0 | 常温 | 0 | 0 |
| II | 温度对反应速率的影响 | —— | 5.0 | 60℃ | 0 | 0 |
| III | 为编号IV实验的参照 | 4.0% | 5.0 | 常温 | —— | 0 |
| IV | —— | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中空白内容:II
(4)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。

①该电池的正极是电极
②电池工作时,溶液中的K+会向
您最近半年使用:0次
解题方法
6 . 化学是一门以实验为基础的科学,某课外兴趣小组用实验进行探究影响化学反应速率的因素。
实验一:利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol·L-1、2mol·L-1、18.4 mol·L-1),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
该同学的实验目的是研究___________ 对反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持___________ 条件相同。
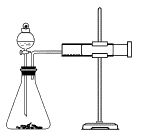
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。完成该实验应选用的实验药品是___________ ;应该测定的实验数据是___________ 。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(3)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是___________ 的影响。
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是___________。
实验三:丙同学为了研究硫酸铜的量对氢气生成速率的影响,设计了如下实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
(5)请完成此实验设计,其中:V1=___________ ,V6=___________ ,V9=___________ 。
实验一:利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol·L-1、2mol·L-1、18.4 mol·L-1),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
①分别取等体积的 硫酸于三支试管中; 硫酸于三支试管中;②分别投入大小、形状相同的Cu、Fe、Mg | 反应快慢:Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快 |
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。完成该实验应选用的实验药品是

实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(3)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是___________。
| A.硫酸钾 | B.硫酸锰 | C.水 | D.氯化锰 |
实验三:丙同学为了研究硫酸铜的量对氢气生成速率的影响,设计了如下实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
| 实验混合溶液 | A | B | C | D | E | F |
| V(4mol·L-1H2SO4)/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| V(饱和CuSO4溶液)/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| V(H2O) /mL | V7 | V8 | V9 | V10 | 10 | 0 |
您最近半年使用:0次
名校
解题方法
7 . 下列实验装置,能达到实验目的的是
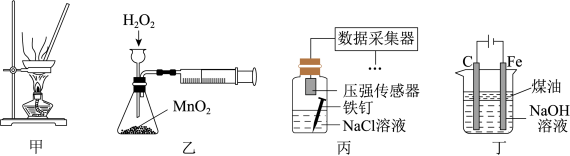

A.用装置甲蒸干 溶液制备无水 溶液制备无水 固体 固体 |
B.用装置乙定量测定 的分解速率 的分解速率 |
| C.用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 |
D.用装置丁制备 并能较长时间观察其颜色 并能较长时间观察其颜色 |
您最近半年使用:0次
2024-02-18更新
|
83次组卷
|
2卷引用:安徽省六安第一中学2023-2024学年高二上学期期末考试化学试题
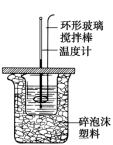
8 . (1)50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:____ 。
②大烧杯上如不盖硬纸板,求得的中和热数值____ (填“偏大”、“偏小”或“无影响”)。
③实验中改用60mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,所放出的热量___ (填“相等”或“不相等”)。
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会____ (填“偏大””、“偏小””或“无影响”)。
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
①催化剂能增大化学反应速率的原因是___ 。
②实验①和②的目的是探究___ 对反应速率的影响。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是___ 。
③实验③④⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论:___ 环境能增大H2O2分解的速率;
b.___ 环境能减小H2O2分解的速率。
②大烧杯上如不盖硬纸板,求得的中和热数值
③实验中改用60mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 分组实验 | 催化剂 | |
| ① | 10mL5%H2O2溶液 | 无 |
| ② | 10mL2%H2O2溶液 | 无 |
| ③ | 10mL5%H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5%H2O2溶液+少量稀盐酸 | 1mL0.1mol·L-1FeCl3溶液 |
| ⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
②实验①和②的目的是探究
③实验③④⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论:
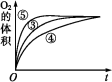
b.
您最近半年使用:0次
2021-05-24更新
|
176次组卷
|
2卷引用:海南省北京师范大学万宁附中2020-2021学年高一下学期期中考试化学试题
9 . 下列实验装置正确并能达到实验目的的是
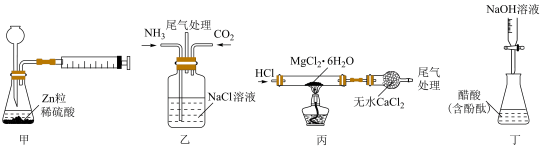

| A.装置甲用于测定生成氢气的速率 |
| B.装置乙制取碳酸氢钠 |
| C.装置丙制备无水氯化镁 |
| D.装置丁测定未知醋酸的浓度 |
您最近半年使用:0次
名校
解题方法
10 . 某化学兴趣小组进行以下实验探究。
Ⅰ.设计实验探究反应速率的测定和比较实验步骤:
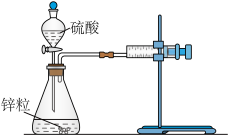
(1)用如图所示装置,加入 的稀硫酸溶液,测量收集
的稀硫酸溶液,测量收集 所需的时间。
所需的时间。
(2)另取一套相同的装置,加入40 mL 4 mol·L-1的稀硫酸溶液,测量收集 (相同条件下)
(相同条件下) 所需的时间。
所需的时间。
实验现象:锌跟稀硫酸反应产生气泡,收集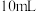 气体,(2)所用时间比(1)所用时间
气体,(2)所用时间比(1)所用时间__________ (填“长”或“短”)
实验结论: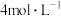 的稀硫酸与锌反应比
的稀硫酸与锌反应比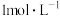 的稀硫酸与锌反应速率
的稀硫酸与锌反应速率___________ (填“大”或“小”):
注意事项:①锌粒的质量、颗粒(即表面积)大小___________ ;
②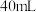 的硫酸要迅速加入;
的硫酸要迅速加入;
③装置____________ ,且计时要迅速准确;
④气体收集可以用排水量气装置代替。
实验讨论:除本实验测定反应速率的方法外,可行的方案还有_________________________ (任写一种)。
Ⅱ.利用 与大理石反应来研究影响反应速率的因素,所用
与大理石反应来研究影响反应速率的因素,所用 浓度为
浓度为 、
、 ,大理石有细颗粒与粗颗粒两种规格,实验温度为
,大理石有细颗粒与粗颗粒两种规格,实验温度为 、
、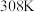 。
。
请完成以下实验设计表。
Ⅰ.设计实验探究反应速率的测定和比较实验步骤:

(1)用如图所示装置,加入
 的稀硫酸溶液,测量收集
的稀硫酸溶液,测量收集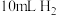 所需的时间。
所需的时间。(2)另取一套相同的装置,加入40 mL 4 mol·L-1的稀硫酸溶液,测量收集
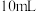 (相同条件下)
(相同条件下) 所需的时间。
所需的时间。实验现象:锌跟稀硫酸反应产生气泡,收集
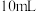 气体,(2)所用时间比(1)所用时间
气体,(2)所用时间比(1)所用时间实验结论:
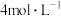 的稀硫酸与锌反应比
的稀硫酸与锌反应比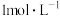 的稀硫酸与锌反应速率
的稀硫酸与锌反应速率注意事项:①锌粒的质量、颗粒(即表面积)大小
②
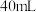 的硫酸要迅速加入;
的硫酸要迅速加入;③装置
④气体收集可以用排水量气装置代替。
实验讨论:除本实验测定反应速率的方法外,可行的方案还有
Ⅱ.利用
 与大理石反应来研究影响反应速率的因素,所用
与大理石反应来研究影响反应速率的因素,所用 浓度为
浓度为 、
、 ,大理石有细颗粒与粗颗粒两种规格,实验温度为
,大理石有细颗粒与粗颗粒两种规格,实验温度为 、
、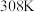 。
。请完成以下实验设计表。
| 实验编号 | T/K | 大理石规格 | 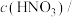 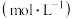 | 实验目的 |
| ① | 298 | 粗颗粒 |  | (1)实验①和②探究 浓度对该反应速率的影响; 浓度对该反应速率的影响;(2)实验①和 (3)实验①和 |
| ② | ||||
| ③ | 粗颗粒 | |||
| ④ |
您最近半年使用:0次
2020-10-11更新
|
145次组卷
|
3卷引用:陕西省西安市远东第一中学2018-2019学年高二上学期10月月考化学试题