名校
1 . I. 科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出)。

(1)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
用H2表示前2 h平均反应速率v(H2) =__________ mol·(L·h)-1。
(2)在300 ℃、8 MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(1)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp=________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:

①该反应的ΔH______ 0 (填“>”、“=”或“<”)。
②曲线c表示的物质为____________________ 。
II. 砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。某小组欲探究可逆反应AsO33-+I2+2OH- ⇌ AsO43- + 2I- + H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L的盐酸,发现又产生电流,实验中电流与时间的关系如图II所示。

(1)图II中AsO43-的逆反应速率:a____ b( 填“>”、“<”或“=” )。
(2)写出图II中c点对应图I装置的正极反应式__________________________ 。
(3)能判断该反应达到平衡状态的是________ 。
a.2v(I-)正=v(AsO33-)逆b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化

(1)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
| 时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
| P后/P前 | 0.9 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
(2)在300 ℃、8 MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(1)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp=
(3)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
①该反应的ΔH
②曲线c表示的物质为
II. 砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。某小组欲探究可逆反应AsO33-+I2+2OH- ⇌ AsO43- + 2I- + H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L的盐酸,发现又产生电流,实验中电流与时间的关系如图II所示。

(1)图II中AsO43-的逆反应速率:a
(2)写出图II中c点对应图I装置的正极反应式
(3)能判断该反应达到平衡状态的是
a.2v(I-)正=v(AsO33-)逆b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化
您最近一年使用:0次
名校
2 . 氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以H2O2分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验。
(1)实验①和②的目的是___________ 。同学甲在进行实验①和②时并没有观察到明显现象。资料显示,通常条件下过氧化氢稳定,不易分解。为了达到实验目的,可采取的改进方法是___________ (写出一种即可)。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图所示。分析该图能得出的结论是___________ 。

(3)同学乙设计了如图所示的实验装置对过氧化氢的分解速率进行定量分析,以生成20mL气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是___________ 。
(4)向某体积固定的密闭容器中加入0.6molA、0.2molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
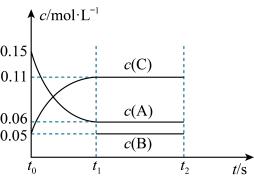
①写出反应的化学方程式:___________ ;
②B的起始的物质的量是___________ ;平衡时体系内的压强为初始状态的___________ 倍。
| 实验编号 | 温度(℃) | 反应物 | 催化剂 |
| ① | 20 | 25mL3%H2O2溶液 | 无 |
| ② | 20 | 25mL5%H2O2溶液 | 无 |
| ③ | 20 | 25mL5%H2O2溶液 | 0.1gMnO2 |
| ④ | 20 | 25mL5%H2O2溶液 | 1~2滴1mol/LFeCl3溶液 |
| ⑤ | 30 | 25mL5%H2O2溶液 | 0.1gMnO2 |
(1)实验①和②的目的是
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图所示。分析该图能得出的结论是

(3)同学乙设计了如图所示的实验装置对过氧化氢的分解速率进行定量分析,以生成20mL气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是

(4)向某体积固定的密闭容器中加入0.6molA、0.2molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:

①写出反应的化学方程式:
②B的起始的物质的量是
您最近一年使用:0次
2023-10-04更新
|
23次组卷
|
2卷引用:四川省成都市第八中学校2022-2023学年高二上学期11月期中考试化学试题
3 . 已知锌与稀盐酸反应放热,某学生为了探究反应过程中的速率变化,用排水集气法收集反应放出的氢气。所用稀盐酸浓度有 、
、 两种浓度,每次实验稀盐酸的用量为
两种浓度,每次实验稀盐酸的用量为 ,锌有细颗粒与粗颗粒两种规格,用量为
,锌有细颗粒与粗颗粒两种规格,用量为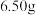 。实验温度为
。实验温度为 、
、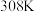 。
。
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
(2)实验①记录如下(换算成标况):
①计算在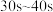 范围内盐酸的平均反应速率
范围内盐酸的平均反应速率
_______ (忽略溶液体积变化)。
②反应速率最大的时间段(如 )为
)为_______ ,可能原因是_______ ;
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率,在不影响产生气体总量的情况下,你认为他选择的溶液可以是_______(填相应字母);
(4)某化学研究小组的同学为比较 和
和 对
对 分解的催化效果,设计了图所示的实验。
分解的催化效果,设计了图所示的实验。
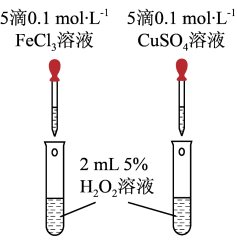
①如图可通过观察_______ 现象,比较得出比较 和
和 对
对 分解的催化效果结论。
分解的催化效果结论。
②该实验存在明显不合理的地方,你认为不合理的地方是_______ 。
 、
、 两种浓度,每次实验稀盐酸的用量为
两种浓度,每次实验稀盐酸的用量为 ,锌有细颗粒与粗颗粒两种规格,用量为
,锌有细颗粒与粗颗粒两种规格,用量为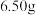 。实验温度为
。实验温度为 、
、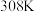 。
。(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
| 编号 |  | 锌规格 | 盐酸浓度/ | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和 (Ⅲ)实验①和实验④探究锌规格(粗、细)对该反应速率的影响。 |
| ② | 298 | 粗颗粒 | 1.00 | |
| ③ | 308 | 粗颗粒 | 2.00 | |
| ④ | 298 | 细颗粒 | 2.00 |
| 时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
氢气体积( ) ) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
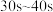 范围内盐酸的平均反应速率
范围内盐酸的平均反应速率
②反应速率最大的时间段(如
 )为
)为(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率,在不影响产生气体总量的情况下,你认为他选择的溶液可以是_______(填相应字母);
A. 溶液 溶液 | B. 溶液 溶液 | C. 溶液 溶液 | D. |
 和
和 对
对 分解的催化效果,设计了图所示的实验。
分解的催化效果,设计了图所示的实验。
①如图可通过观察
 和
和 对
对 分解的催化效果结论。
分解的催化效果结论。②该实验存在明显不合理的地方,你认为不合理的地方是
您最近一年使用:0次
名校
解题方法
4 . 根据下列实验设计,回答问题:
(1)利用实验(Ⅰ)探究锌与0.1mol/L硫酸和2mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):_______ 。

(2)实验(Ⅱ)探究浓度对化学化学平衡影响。已知: (橙色)
(橙色) (黄色)
(黄色) 推测D试管中实验现象为
推测D试管中实验现象为_______ ,用平衡移动原理解释原因:______________ 。

(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中发生反应:
 ,某小组也用酸性
,某小组也用酸性 溶液和草酸(
溶液和草酸( )溶液进行实验,实验操作及现象如下表:
)溶液进行实验,实验操作及现象如下表:

①由实验ⅰ、实验ⅱ可得出的结论是_______ 。
②关于实验ⅱ中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
提供的试剂:0.01mol/L酸性 溶液,0.1mol/L草酸溶液,3mol/L硫酸,
溶液,0.1mol/L草酸溶液,3mol/L硫酸, 溶液,
溶液, 固体,蒸馏水。
固体,蒸馏水。
补全实验ⅲ的操作:向试管中先加入5mL 0.01mol/L酸性 溶液,
溶液,_______ ,最后加入5mL 0.1mol/L草酸溶液。
③基于以上实验与分析,推测实验(Ⅲ)设计_______ (填“能”或“不能”)达到实验目的。
(1)利用实验(Ⅰ)探究锌与0.1mol/L硫酸和2mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):

(2)实验(Ⅱ)探究浓度对化学化学平衡影响。已知:
 (橙色)
(橙色) (黄色)
(黄色) 推测D试管中实验现象为
推测D试管中实验现象为
(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中发生反应:

 ,某小组也用酸性
,某小组也用酸性 溶液和草酸(
溶液和草酸( )溶液进行实验,实验操作及现象如下表:
)溶液进行实验,实验操作及现象如下表:
| 编号 | 实验操作 | 实验现象 |
| ⅰ | 向一支试管中先加入5mL 0.01mol/L酸性 溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入5mL 0.1mol/L草酸溶液 溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入5mL 0.1mol/L草酸溶液 | 前10min内溶液紫色无明显变化,后颜色逐渐变浅,30min后几乎变为无色 |
| ⅱ | 向另一支试管中先加入5mL 0.01mol/L酸性 溶液,再加入10滴3mol/L硫酸,最后加入5mL 0.1mol/L草酸溶液 溶液,再加入10滴3mol/L硫酸,最后加入5mL 0.1mol/L草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
②关于实验ⅱ中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
 对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。提供的试剂:0.01mol/L酸性
 溶液,0.1mol/L草酸溶液,3mol/L硫酸,
溶液,0.1mol/L草酸溶液,3mol/L硫酸, 溶液,
溶液, 固体,蒸馏水。
固体,蒸馏水。补全实验ⅲ的操作:向试管中先加入5mL 0.01mol/L酸性
 溶液,
溶液,③基于以上实验与分析,推测实验(Ⅲ)设计
您最近一年使用:0次
5 . 下列有关实验探究方案设计合理的是
| 选项 | 实验方案 | 实验目的 |
| A | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和FeCl3溶液,观察气体产生的速度 | 比较Cu2+和Fe3+的催化效果 |
| B | 先将注射器充满NO2气体,然后将活塞往里推,压缩体积,观察注射器内气体颜色变化 | 验证压强对平衡的影响 |
| C | 在锥形瓶内各盛有2g锌粒(颗粒大小基本相同),然后通过分液漏斗分别加入40mL1mol/L和40mL18mol/L的硫酸,比较两者收集10mL氢气所用的时间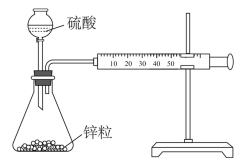 | 探究硫酸浓度对反应速率的影响 |
| D | 在FeCl3+3KSCN Fe(SCN)3+3KCl平衡体系中加入KCl晶体,观察并比较实验现象 Fe(SCN)3+3KCl平衡体系中加入KCl晶体,观察并比较实验现象 | 探究离子浓度对平衡移动的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-12更新
|
161次组卷
|
2卷引用:福建省龙岩市一级校联盟(九校)联考2022-2023学年高二上学期半期考化学试题
名校
6 . 某实验小组以 分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
(1)催化剂能加快化学反应速率的原因是_______ 。
(2)实验①和②的目的是_______ 。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下 不易分解。为了达到实验目的,你对原实验方案的改进是
不易分解。为了达到实验目的,你对原实验方案的改进是_______ 。
(3)写出实验③的化学反应方程式_______ 。若实验③中,反应5分钟内,测得产生氧气体积为 (标准状况下),假设反应前后溶液总体积不变,则该时间段以
(标准状况下),假设反应前后溶液总体积不变,则该时间段以 表示的反应速率为
表示的反应速率为_______ 。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析下图能够得出的实验结论是_______ 。

 分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。| 实验编号 | 反应物 | 催化剂 |
| ① |  2% 2% 溶液 溶液 | 无 |
| ② |  5% 5% 溶液 溶液 | 无 |
| ③ |  5% 5% 溶液 溶液 |  溶液 溶液 |
| ④ |  5% 5% 溶液+少量稀盐酸 溶液+少量稀盐酸 |  溶液 溶液 |
| ⑤ |  5% 5% 溶液+少量 溶液+少量 溶液 溶液 |  溶液 溶液 |
(2)实验①和②的目的是
 不易分解。为了达到实验目的,你对原实验方案的改进是
不易分解。为了达到实验目的,你对原实验方案的改进是(3)写出实验③的化学反应方程式
 (标准状况下),假设反应前后溶液总体积不变,则该时间段以
(标准状况下),假设反应前后溶液总体积不变,则该时间段以 表示的反应速率为
表示的反应速率为(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析下图能够得出的实验结论是

您最近一年使用:0次
2022-10-15更新
|
141次组卷
|
2卷引用:上海市延安中学2022-2023学年高二上学期10月阶段测试化学试题
名校
解题方法
7 . 氧化剂 在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以
在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以 分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验:
分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验:
(1)实验①和②的目的是探究___________ 对反应速率的影响。同学甲在进行实验①和②时并没有观察到明显现象。资料显示,通常条件下过氧化氢稳定,不易分解。为了达到实验目的,可采取的改进方法是___________ (写出一种即可)。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如甲图所示,分析该图能得出的结论是___________ ,___________ ;

(3)同学乙设计了乙图所示的实验装置对过氧化氢的分解速率进行定量分析,以生成20 气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是
气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是______ 。

(4)向某体积固定的密闭容器中加入0.6 A、0.2
A、0.2 C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:

①写出反应的化学方程式:______ ;
②若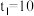 ,则
,则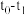 内反应速率
内反应速率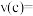
______ ,A的转化率为______ ;
③B的起始的物质的量是______ mol。
 在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以
在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以 分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验:
分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验:| 实验编号 | 温度(℃) | 反应物 | 催化剂 |
| ① | 20 | 25mL3% 溶液 溶液 | 无 |
| ② | 20 | 25 mL 5% 溶液 溶液 | 无 |
| ③ | 20 | 25 mL 5% 溶液 溶液 | 0.1g MnO2 |
| ④ | 20 | 25 mL 5% 溶液 溶液 | 1~2滴1  溶液 溶液 |
| ⑤ | 30 | 25 mL 5% 溶液 溶液 | 0.1g MnO2 |
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如甲图所示,分析该图能得出的结论是

(3)同学乙设计了乙图所示的实验装置对过氧化氢的分解速率进行定量分析,以生成20
 气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是
气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是
(4)向某体积固定的密闭容器中加入0.6
 A、0.2
A、0.2 C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
①写出反应的化学方程式:
②若
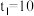 ,则
,则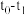 内反应速率
内反应速率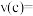
③B的起始的物质的量是
您最近一年使用:0次
名校
8 . (1)在一定条件下,体积为2L的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,3min后达到平衡,生成NH3的物质的量是2.4 mol。试求:
2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,3min后达到平衡,生成NH3的物质的量是2.4 mol。试求:
① 3min内用N2表示的化学反应速率为____________ 。②H2的转化率是____________ 。
(2)某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
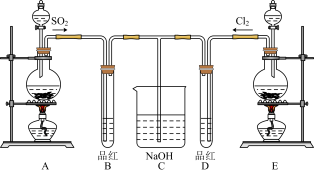
a.实验室用装置E制备Cl2,其反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2+2H2O。若有6 mol 的HCl参加反应,则转移的电子物质的量为
MnCl2+Cl2+2H2O。若有6 mol 的HCl参加反应,则转移的电子物质的量为____________ ;
b.①反应开始一段时间后,观察到D试管中的品红溶液出现的现象是:
D:_____________________________________________________________ 。
②停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:____________________________________ ,D:________________________________ 。
c.另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_______________________________ 。
 2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,3min后达到平衡,生成NH3的物质的量是2.4 mol。试求:
2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,3min后达到平衡,生成NH3的物质的量是2.4 mol。试求:① 3min内用N2表示的化学反应速率为
(2)某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。

a.实验室用装置E制备Cl2,其反应的化学方程式为:MnO2+4HCl(浓)
 MnCl2+Cl2+2H2O。若有6 mol 的HCl参加反应,则转移的电子物质的量为
MnCl2+Cl2+2H2O。若有6 mol 的HCl参加反应,则转移的电子物质的量为b.①反应开始一段时间后,观察到D试管中的品红溶液出现的现象是:
D:
②停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:
c.另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)
您最近一年使用:0次
2017-06-21更新
|
488次组卷
|
2卷引用:贵州省遵义航天高级中学2016-2017学年高一下学期第三次月考理科综合化学试题
名校
解题方法
9 . 调控化学反应速率对化工生产有重要的意义 ,某校实验小组欲通过实验探究浓度、催化剂、温度等条件对反应速率的影响。
I.第一实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
(1)H2O2分解的化学反应方程式为_______ 。
(2)选取①②在探究浓度对速率的影响时,时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_______ 。
(3)选取_______ (填实验序号)实验,可完成催化剂对反应速率影响的探究
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图所示。分析图示能够得出的实验结论是_______ 。

II.第二实验小组欲用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素(离子方程式为2MnO +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。该实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。该实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:
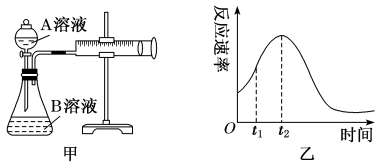
(5)该实验探究的是_______ 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是_______ (填实验序号)。
(6)若实验①在2min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO )=
)=_______ mol·L-1(假设混合溶液的体积为50 mL),2min内H2C2O4的消耗速率为v (H2C2O4) =_______ mol·L-1·min-1
(7)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,②_______ 。
I.第一实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 编号 | 反应物 | 催化剂 |
| ① | 10 mL 2%H2O2溶液 | 无 |
| ② | 10 mL 5%H2O2溶液 | 无 |
| ③ | 10 mL 5%H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ | 10 mL 5%H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ | 10 mL 5%H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑥ | 10 mL 5%H2O2溶液+1 mL H2O | 无 |
(2)选取①②在探究浓度对速率的影响时,时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是
(3)选取
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图所示。分析图示能够得出的实验结论是

II.第二实验小组欲用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素(离子方程式为2MnO
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。该实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。该实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1 mol·L-1 H2C2O4溶液 | 30mL 0.01 mol·L-1 KMnO4溶液 |
| ② | 20mL 0.2 mol·L-1 H2C2O4溶液 | 30mL0.01 mol·L-1 KMnO4溶液 |
(6)若实验①在2min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO
 )=
)=(7)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,②
您最近一年使用:0次
名校
解题方法
10 . 下列实验不能达到相应实验目的的是
| 操作及现象 | 实验目的 | |
| A | 向5 mL 0.005 mol/L FeCl3溶液中加入5 mL 0.1mol/L KSCN溶液,充分反应后,再滴加4滴饱和FeCl3溶液,充分振荡,溶液红色加深 | 探究浓度对平衡移动的影响 |
| B | 分别向装有2 mL 0.1 mol/L H2C2O4溶液和2 mL 0.2 mol/L H2C2O4溶液的两支试管中加入4 mL 0.01mol/L酸性KMnO4溶液,振荡,后者溶液先褪色 | 探究浓度对反应速率的影响 |
| C | 将研细后的20 g Ba(OH)2·8H2O晶体与10 g NH4Cl晶体一起放入烧杯中,用玻璃棒快速搅拌,闻到刺激性气味的气体,烧杯壁温度下降 | 证明Ba(OH)2·8H2O晶体与NH4Cl晶体的反应是吸热反应 |
| D | 将50 mL 0.55 mol/L 的烧碱溶液分多次加入到盛有50 mL 0.5 mol/L 盐酸的量热计中,温度计示数由T1升高至T2 | 测定并计算中和热 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-30更新
|
216次组卷
|
2卷引用:广西南宁市第三中学2020-2021学年高二上学期期末考试化学(理)试题



