1 . KMnO4在生产和生活中有着广泛用途,某化学小组在实验室制备KMnO4并探究其性质。
(一) KMnO4的制备,分步骤Ⅰ、Ⅱ两步进行。
步聚Ⅰ.先利用如图所示装置制备K2MnO4。称取7.0gKOH(s)和5.0gKClO3(s)放入容器A中,加热,待混合物熔融后,加入5.0gMnO2(s),待反应物干涸后,加大火焰强热4~8min,得墨绿色的锰酸钾。
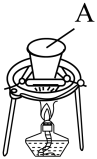
(1)A可选用_______ (填标号)。
①石英坩埚 ②瓷坩埚 ③铁坩埚
(2)实验中发生反应生成K2MnO4的化学方程式为_______ 。
Ⅱ.由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①待A处物料冷却后,用20mL4%KOH溶液重复浸取,合并浸取液便得墨绿色的锰酸钾溶液。
②向滤液中通入足量CO2,使K2MnO4歧化为KMnO4和MnO2,过滤出生成的MnO2。
③再将滤液进行一系列处理,得KMnO4晶体。
(3)过程②向滤液中通入足量CO2,可观察到的现象为_______ ;检验K2MnO4歧化完全的实验方法是_______ 。
(二) KMnO4的性质。已知:KMnO4具有强氧化性,可与草酸(H2C2O4)反应: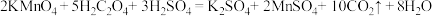 。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
[实验内容及记录的数据]
(4)配制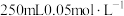 的高锰酸钾溶液肯定不需要的仪器是
的高锰酸钾溶液肯定不需要的仪器是_______ (填标号)。
a.蒸发皿 b.容量瓶 c.玻璃棒 d.烧杯 e.坩埚 f.胶头滳管
(5)为达到实验目的,H2C2O4溶液的物质的量浓度不低于_______ 。
(6)利用实验1中数据计算,0~4min内,用KMnO4的浓度变化表示的反应速率:
_______ 。
(一) KMnO4的制备,分步骤Ⅰ、Ⅱ两步进行。
步聚Ⅰ.先利用如图所示装置制备K2MnO4。称取7.0gKOH(s)和5.0gKClO3(s)放入容器A中,加热,待混合物熔融后,加入5.0gMnO2(s),待反应物干涸后,加大火焰强热4~8min,得墨绿色的锰酸钾。

(1)A可选用
①石英坩埚 ②瓷坩埚 ③铁坩埚
(2)实验中发生反应生成K2MnO4的化学方程式为
Ⅱ.由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①待A处物料冷却后,用20mL4%KOH溶液重复浸取,合并浸取液便得墨绿色的锰酸钾溶液。
②向滤液中通入足量CO2,使K2MnO4歧化为KMnO4和MnO2,过滤出生成的MnO2。
③再将滤液进行一系列处理,得KMnO4晶体。
(3)过程②向滤液中通入足量CO2,可观察到的现象为
(二) KMnO4的性质。已知:KMnO4具有强氧化性,可与草酸(H2C2O4)反应:
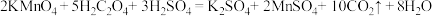 。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:[实验内容及记录的数据]
| 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
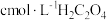 溶液 溶液 |  | 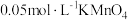 溶液 溶液 | 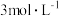 稀硫酸 稀硫酸 | ||
| 1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
| 2 | 2.0 | 2.0 | 4.0 | 2.0 | 5.2 |
| 3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
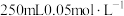 的高锰酸钾溶液肯定不需要的仪器是
的高锰酸钾溶液肯定不需要的仪器是a.蒸发皿 b.容量瓶 c.玻璃棒 d.烧杯 e.坩埚 f.胶头滳管
(5)为达到实验目的,H2C2O4溶液的物质的量浓度不低于
(6)利用实验1中数据计算,0~4min内,用KMnO4的浓度变化表示的反应速率:

您最近一年使用:0次
2023-05-11更新
|
322次组卷
|
3卷引用:辽宁省抚顺市重点高中六校协作体2023届高三下学期二模联考化学试题
解题方法
2 . 双氧水在工业、医药等领域应用广泛。某小组采用如下方法制备 并探究
并探究 的分解反应机理。回答下列问题:
的分解反应机理。回答下列问题:
Ⅰ.电解-水解法制备 制备步骤:
制备步骤:
(1)①电解硫酸氢钾饱和溶液,制取 ;
;
②将电解所得 酸化水解制取
酸化水解制取 。电解时阳极反应式为
。电解时阳极反应式为___________ 。

Ⅱ.探究的分解反应机理
①按图1连接装置,检查装置气密性;
②向a中加入60mL15%H2O2,观察现象,通过pH传感器测pH;
③20s时,打开双通阀,向a中加入1滴管 溶液,搅拌,观察现象。反应部分实验数据结果和反应历程见图2和图3(忽略温度的影响)。
溶液,搅拌,观察现象。反应部分实验数据结果和反应历程见图2和图3(忽略温度的影响)。

回答下列问题:
(2)仪器a的名称是___________ ,已知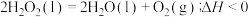 ,据此分析并说明常温常压下
,据此分析并说明常温常压下 能否分解
能否分解___________ ,前20s测得溶液pH为3.47,其原因是___________ (用电离方程式表示)。
(3)步骤③中加入 溶液后的现象为
溶液后的现象为___________ 、溶液颜色由黄色变深,又变回黄色。20~23s pH变化的原因是___________ 。结合图2和图3,23~150s pH变化对应的历程为___________ (用序号表示),150s后pH变化的原因是___________ (用反应式表示)。
(4)加入 溶液后,150s时收集到19.5mL
溶液后,150s时收集到19.5mL ,则用
,则用 的体积变化表示该反应的速率为
的体积变化表示该反应的速率为___________ 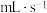 。该实验证明催化剂通过改变反应历程,从而加快反应速率。
。该实验证明催化剂通过改变反应历程,从而加快反应速率。
 并探究
并探究 的分解反应机理。回答下列问题:
的分解反应机理。回答下列问题:Ⅰ.电解-水解法制备
 制备步骤:
制备步骤:(1)①电解硫酸氢钾饱和溶液,制取
 ;
;②将电解所得
 酸化水解制取
酸化水解制取 。电解时阳极反应式为
。电解时阳极反应式为
Ⅱ.探究的分解反应机理
①按图1连接装置,检查装置气密性;
②向a中加入60mL15%H2O2,观察现象,通过pH传感器测pH;
③20s时,打开双通阀,向a中加入1滴管
 溶液,搅拌,观察现象。反应部分实验数据结果和反应历程见图2和图3(忽略温度的影响)。
溶液,搅拌,观察现象。反应部分实验数据结果和反应历程见图2和图3(忽略温度的影响)。
回答下列问题:
(2)仪器a的名称是
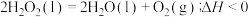 ,据此分析并说明常温常压下
,据此分析并说明常温常压下 能否分解
能否分解(3)步骤③中加入
 溶液后的现象为
溶液后的现象为(4)加入
 溶液后,150s时收集到19.5mL
溶液后,150s时收集到19.5mL ,则用
,则用 的体积变化表示该反应的速率为
的体积变化表示该反应的速率为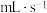 。该实验证明催化剂通过改变反应历程,从而加快反应速率。
。该实验证明催化剂通过改变反应历程,从而加快反应速率。
您最近一年使用:0次
名校
解题方法
3 . 氮元素与人类的生命、生产等活动息息相关。
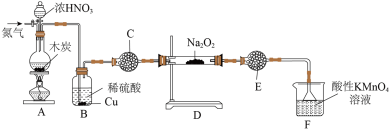
(1)亚硝酸钠( )在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
)在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
已知:① ;
;
②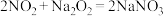
③酸性条件下, 、
、 和
和 都能与
都能与 反应生成
反应生成 和
和
请回答下列问题:
①装置A中发生反应的化学方程式为___________ 。
②装置B中的实验现象为___________ 。
③装置C的作用为___________ 。
④装置F中发生反应的离子方程式为___________ 。
(2)生物脱氮法流程如下:
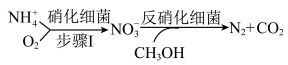
步骤I中若 的消除速率为
的消除速率为 ,则
,则 的消耗速率为
的消耗速率为___________ 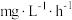 。
。
(3)目前,湿法 和
和 一体化脱除法是解决燃煤烟气领域的途径之一
一体化脱除法是解决燃煤烟气领域的途径之一
已知:两组实验中 溶液浓度均为
溶液浓度均为 ,
, 浓度均为
浓度均为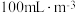
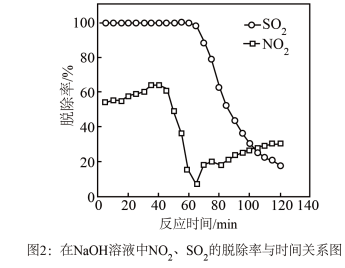
①图1是 、
、 、
、 对
对 的液相吸收。已知
的液相吸收。已知 溶液在脱除
溶液在脱除 时生成一种对空气无污染的气体,请写出该反应化学方程式
时生成一种对空气无污染的气体,请写出该反应化学方程式___________ 。
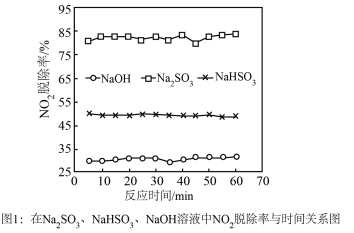
②实验发现,在相同实验条件下利用 溶液同时吸收
溶液同时吸收 和
和 ,
, 脱除率在60%左右;单独吸收
脱除率在60%左右;单独吸收 时,
时, 脱除率在33%左右。结合①信息及图像解释原因
脱除率在33%左右。结合①信息及图像解释原因___________ 。
(1)亚硝酸钠(
 )在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
)在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
已知:①
 ;
;②
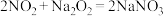
③酸性条件下,
 、
、 和
和 都能与
都能与 反应生成
反应生成 和
和
请回答下列问题:
①装置A中发生反应的化学方程式为
②装置B中的实验现象为
③装置C的作用为
④装置F中发生反应的离子方程式为
(2)生物脱氮法流程如下:

步骤I中若
 的消除速率为
的消除速率为 ,则
,则 的消耗速率为
的消耗速率为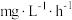 。
。(3)目前,湿法
 和
和 一体化脱除法是解决燃煤烟气领域的途径之一
一体化脱除法是解决燃煤烟气领域的途径之一已知:两组实验中
 溶液浓度均为
溶液浓度均为 ,
, 浓度均为
浓度均为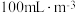
①图1是
 、
、 、
、 对
对 的液相吸收。已知
的液相吸收。已知 溶液在脱除
溶液在脱除 时生成一种对空气无污染的气体,请写出该反应化学方程式
时生成一种对空气无污染的气体,请写出该反应化学方程式
②实验发现,在相同实验条件下利用
 溶液同时吸收
溶液同时吸收 和
和 ,
, 脱除率在60%左右;单独吸收
脱除率在60%左右;单独吸收 时,
时, 脱除率在33%左右。结合①信息及图像解释原因
脱除率在33%左右。结合①信息及图像解释原因
您最近一年使用:0次
2023-07-14更新
|
438次组卷
|
2卷引用:辽宁省辽南协作校2022-2023学年高一下学期期末考试化学试题
名校
4 . 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(2)实验装置如图1所示,如何检验该装置的气密性________________________________

(3)实验①中CO2质量随时间变化的关系见下图2:依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在70-90 s范围内HNO3的平均反应速率________________________
(4)请在答题卡的框图中,画出实验②、③和④中CO2质量随时间变化关系的预期结果示意图。_______
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响; |
| ② | ||||
| ③ | ||||
| ④ |

(3)实验①中CO2质量随时间变化的关系见下图2:依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在70-90 s范围内HNO3的平均反应速率
(4)请在答题卡的框图中,画出实验②、③和④中CO2质量随时间变化关系的预期结果示意图。
您最近一年使用:0次
2018-10-10更新
|
178次组卷
|
2卷引用:【全国百强校】黑龙江省大庆实验中学2018-2019学年高二上学期10月月考化学试题
名校
解题方法
5 . 查阅资料,在酸性溶液中SO2也能发生歧化反应,方程式为3SO2+2H2O=2H2SO4+S↓,已知I-可以作为水溶液中SO2歧化反应的催化剂,催化过程分两个步骤进行。
(1)请写出步骤ⅰ的离子反应方程式:
ⅰ.___________
ⅱ.I2+2H2O+SO2=SO +4H++2I-
+4H++2I-
(2)为探究SO2歧化反应速率的影响因素,在常温下,设计实验如下:
①根据上表分析,V2=___________ mL。
②比较实验Ⅰ、Ⅱ、Ⅲ,可得出H2SO4对该反应速率的影响是:___________ 。
③已知实验Ⅳ是为探究SO2浓度对反应速率的影响,结合浑浊的时间你认为V3、V4分别为___________ 。
A.V3=0、V4=2 B.V3=2、V4=0 C.V3=2、V4=4 D.V3=0、V4=6
④已知刚出现浑浊时硫的质量为0.24g,求实验Ⅰ从开始到刚出现浑浊这段时间,以SO 浓度变化表示的速率v(SO
浓度变化表示的速率v(SO )=
)=___________ 。
⑤实验Ⅱ时,在混合溶液中加入淀粉,发现整个过程没观察到蓝色,请结合步骤i,ii反应速率大小解释其原因___________ 。
(3)将3SO2+2H2O=2H2SO4+S↓,设计成一个电解池用于回收利用废气中的SO2,装置如图所示,电极均为惰性电极。
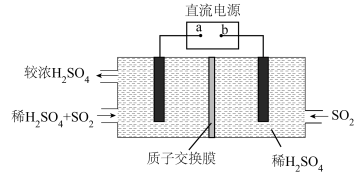
①a为电源的___________ 极;写出阴极的电极反应式___________ ;
②当阴、阳两极共处理0.6molSO2时,通过质子交换膜的离子数目为___________ 。
(1)请写出步骤ⅰ的离子反应方程式:
ⅰ.
ⅱ.I2+2H2O+SO2=SO
 +4H++2I-
+4H++2I-(2)为探究SO2歧化反应速率的影响因素,在常温下,设计实验如下:
| 实验编号 | SO2饱和溶液 | 0.4 mol·L-1 KI | 0.2 mol·L-1 H2SO4 | H2O | 现象 |
| Ⅰ | 10mL | 4mL | 0 | 6mL | 15秒出现浑浊 |
| Ⅱ | 10mL | 4mL | 2ml | V1mL | 10秒出现浑浊 |
| Ⅲ | 10mL | 0 | 2ml | V2mL | 长时间未见浑浊 |
| Ⅳ | 14mL | 4mL | V3ml | V4mL | 12秒出现浑浊 |
②比较实验Ⅰ、Ⅱ、Ⅲ,可得出H2SO4对该反应速率的影响是:
③已知实验Ⅳ是为探究SO2浓度对反应速率的影响,结合浑浊的时间你认为V3、V4分别为
A.V3=0、V4=2 B.V3=2、V4=0 C.V3=2、V4=4 D.V3=0、V4=6
④已知刚出现浑浊时硫的质量为0.24g,求实验Ⅰ从开始到刚出现浑浊这段时间,以SO
 浓度变化表示的速率v(SO
浓度变化表示的速率v(SO )=
)=⑤实验Ⅱ时,在混合溶液中加入淀粉,发现整个过程没观察到蓝色,请结合步骤i,ii反应速率大小解释其原因
(3)将3SO2+2H2O=2H2SO4+S↓,设计成一个电解池用于回收利用废气中的SO2,装置如图所示,电极均为惰性电极。

①a为电源的
②当阴、阳两极共处理0.6molSO2时,通过质子交换膜的离子数目为
您最近一年使用:0次
6 . 某化学兴趣小组利用 氧化
氧化 制备
制备 ,并进行
,并进行 溶液和
溶液和 溶液反应的实验探究。
溶液反应的实验探究。
I.制备
___________ (填仪器名称)代替。
(2)B、E处盛放的试剂分别为___________ 。
(3)反应结束后,在通风橱中打开D的瓶塞通风10min后,将溶液抽滤,滤液经一系列操作可以得到产品。
①“通风”的目的是___________ 。
②“抽滤”是为了除去 在酸性条件下歧化生成的固体,该反应的离子方程式为
在酸性条件下歧化生成的固体,该反应的离子方程式为_________ 。
II.探究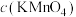 对
对 溶液和溶液反应速率的影响
溶液和溶液反应速率的影响
按下表,将 溶液、
溶液、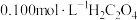 溶液、
溶液、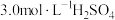 溶液和
溶液和 进行混合,观察现象并记录溶液褪为无色消耗的时间(
进行混合,观察现象并记录溶液褪为无色消耗的时间( )。
)。
(4) 与
与 反应生成
反应生成 和
和 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(5)表中
___________ ;第3组实验,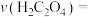
___________  。
。
(6)甲同学根据褪色时间得出“ 溶液浓度越大,该反应速率越小”的结论。你认为是否合理并说明理由
溶液浓度越大,该反应速率越小”的结论。你认为是否合理并说明理由___________ 。
(7)乙同学发现 溶液在褪色过程中经历了“紫红色→橙红色→棕黄色→无色”几个阶段。在老师的指导下,乙同学将
溶液在褪色过程中经历了“紫红色→橙红色→棕黄色→无色”几个阶段。在老师的指导下,乙同学将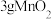 与3mL浓硫酸混合加热,发现有
与3mL浓硫酸混合加热,发现有 生成且上层清液呈橙红色。由此推断
生成且上层清液呈橙红色。由此推断 溶液褪色过程中的橙红色物质为
溶液褪色过程中的橙红色物质为___________ (填离子符号)。
 氧化
氧化 制备
制备 ,并进行
,并进行 溶液和
溶液和 溶液反应的实验探究。
溶液反应的实验探究。I.制备


(2)B、E处盛放的试剂分别为
(3)反应结束后,在通风橱中打开D的瓶塞通风10min后,将溶液抽滤,滤液经一系列操作可以得到产品。
①“通风”的目的是
②“抽滤”是为了除去
 在酸性条件下歧化生成的固体,该反应的离子方程式为
在酸性条件下歧化生成的固体,该反应的离子方程式为II.探究
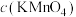 对
对 溶液和溶液反应速率的影响
溶液和溶液反应速率的影响按下表,将
 溶液、
溶液、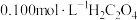 溶液、
溶液、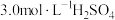 溶液和
溶液和 进行混合,观察现象并记录溶液褪为无色消耗的时间(
进行混合,观察现象并记录溶液褪为无色消耗的时间( )。
)。| 实验分组 | 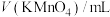 | 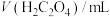 | 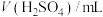 | 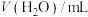 |  |
| 1 | 1 | 1 | 2 |  | 2'55'' |
| 2 | 2 | 1 |  | 1 | 3'20'' |
| 3 | 3 |  | 2 | 0 | 4'10'' |
 与
与 反应生成
反应生成 和
和 ,反应的离子方程式为
,反应的离子方程式为(5)表中

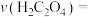
 。
。(6)甲同学根据褪色时间得出“
 溶液浓度越大,该反应速率越小”的结论。你认为是否合理并说明理由
溶液浓度越大,该反应速率越小”的结论。你认为是否合理并说明理由(7)乙同学发现
 溶液在褪色过程中经历了“紫红色→橙红色→棕黄色→无色”几个阶段。在老师的指导下,乙同学将
溶液在褪色过程中经历了“紫红色→橙红色→棕黄色→无色”几个阶段。在老师的指导下,乙同学将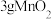 与3mL浓硫酸混合加热,发现有
与3mL浓硫酸混合加热,发现有 生成且上层清液呈橙红色。由此推断
生成且上层清液呈橙红色。由此推断 溶液褪色过程中的橙红色物质为
溶液褪色过程中的橙红色物质为
您最近一年使用:0次
解题方法
7 . 已知在催化剂存在条件下,能发生如下反应:CO+H2O H2 +CO2 +Q
H2 +CO2 +Q
(1)该反应的平衡常数表达式为:___ 。在5L盛有固体催化剂(其体积可忽略不计)的密闭容器中,通入反应物,10s后,生成了氢气0.4g,则此10s内CO的平均反应速率为v(CO)=__ 。
(2)在该密闭容器中,下列叙述可以说明反应已经达到平衡状态的是__ 。
A.若容器体积不变,在一定温度下压强达到恒定
B.CO2的生成速率与H2O蒸气的生成速率之比为1:1
C.CO、H2O、H2、CO在容器中的物质的量浓度保持不变
D.反应体系中混合物的平均摩尔质量保持不变
(3)在上述反应达平衡状态后,分别改变条件,请完成下列两张图:
A.在第20s时将容器体积缩小至原来的一半后压强变化图___
B.在第20s时,向容器中注入少量的CO气体后正逆反应速率变化图___
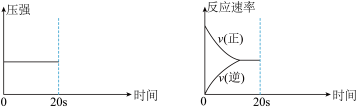
(4)某化学小组在做澄清石灰水导电性实验时,发现石墨两极产生气体,溶液出现白色浑浊,请根据已有知识推测,两极产生的气体可能是__ ,白色浑浊是___ 。为验证白色浑浊物的成分,该同学向白色浑浊液体中加入盐酸,没有观察到气泡产生。他们继续实验,将浑浊的液体倒入密闭容器,通过注射器注入稀盐酸,并用二氧化碳传感器来测定装置中二氧化碳含量的变化,装置和图象如图所示:
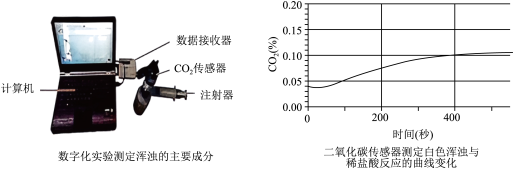
请解释上述现象并分析产生白色浑浊可能的原因___ 。
 H2 +CO2 +Q
H2 +CO2 +Q(1)该反应的平衡常数表达式为:
(2)在该密闭容器中,下列叙述可以说明反应已经达到平衡状态的是
A.若容器体积不变,在一定温度下压强达到恒定
B.CO2的生成速率与H2O蒸气的生成速率之比为1:1
C.CO、H2O、H2、CO在容器中的物质的量浓度保持不变
D.反应体系中混合物的平均摩尔质量保持不变
(3)在上述反应达平衡状态后,分别改变条件,请完成下列两张图:

A.在第20s时将容器体积缩小至原来的一半后压强变化图
B.在第20s时,向容器中注入少量的CO气体后正逆反应速率变化图
(4)某化学小组在做澄清石灰水导电性实验时,发现石墨两极产生气体,溶液出现白色浑浊,请根据已有知识推测,两极产生的气体可能是

请解释上述现象并分析产生白色浑浊可能的原因
您最近一年使用:0次
名校
8 . 过硫酸钠(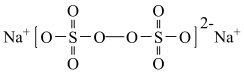 ),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对
),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对 制备和性质及用途进行探究。
制备和性质及用途进行探究。

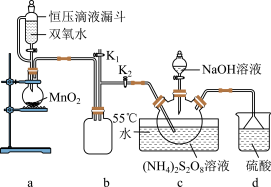
工业制备过硫酸钠的反应原理:
主反应:

副反应:

实验室设计如图实验装置:
(2)装置b的作用是
(3)上述反应过程中,d装置中主要发生的化学反应方程式为
Ⅱ.探究
 的性质与用途
的性质与用途(4)
 用于废水中苯酚的降解
用于废水中苯酚的降解已知:a.
 具有强氧化性,
具有强氧化性, 浓度较高时会导致
浓度较高时会导致 淬灭。
淬灭。b.
 可将苯酚氧化,但反应速率较慢,加入
可将苯酚氧化,但反应速率较慢,加入 可加快反应。
可加快反应。过程为ⅰ.

ⅱ.
 将苯酚氧化为
将苯酚氧化为 气体
气体①
 氧化苯酚的离子方程式是
氧化苯酚的离子方程式是②将含
 的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。
的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。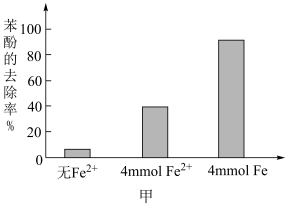
 ,可明显提高苯酚的降解率,主要原因是
,可明显提高苯酚的降解率,主要原因是(5)工业上利用
 能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含
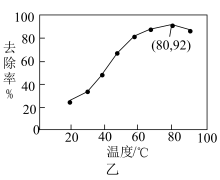
能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含 的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为
的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为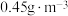 ,
, 达到最大去除率,NO去除的平均反应速率:
达到最大去除率,NO去除的平均反应速率: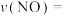
 。
。
您最近一年使用:0次
名校
解题方法
9 . 氟化学在现代无机化学中占有相当重要的地位。请回答下列问题:
(1)1886年法国化学家莫瓦桑首次通过电解熔融的氟氢化钾(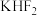 )制备
)制备 ,两极均有气体产生。装置如图所示,钢电极与电源的
,两极均有气体产生。装置如图所示,钢电极与电源的_____ (填“正极”或“负极”)相连,阳极反应式为______ ,两极产生的气体产物必须隔开的原因是________ 。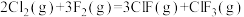
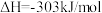 ;F-Cl(ClF中)的键能为248kJ/mol,F-Cl(
;F-Cl(ClF中)的键能为248kJ/mol,F-Cl( 中)的键能为172kJ/mol,F-F的键能为157kJ/mol。计算:Cl-Cl的键能为
中)的键能为172kJ/mol,F-F的键能为157kJ/mol。计算:Cl-Cl的键能为_______ kJ/mol。
(3)氟单质的氧化性很强,可与稀有气体氙(Xe)同时发生如下三个反应。
已知:分压=总压×该组分物质的量分数,对于反应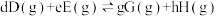 ,
,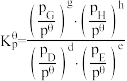 ,其中
,其中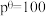 kPa,
kPa, 、
、 、
、 、
、 为各组分的平衡分压。
为各组分的平衡分压。
①在恒温、恒容条件下,向密闭容器中通入一定量的Xe和 ,下列有关说法不正确的是
,下列有关说法不正确的是_______ (填序号)。
A.当混合气体的密度不变时,体系达到平衡
B.当Xe与 的投料比为1∶1时,
的投料比为1∶1时, 的平衡转化率大于Xe
的平衡转化率大于Xe
C.达到平衡后将 从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
D.反应ⅰ、ⅱ、ⅲ均为放热反应
②在600K条件下,向体积为2L的密闭容器中通入30.0mol Xe和60.0mol ,10min时,产物的物质的量(n)如表所示。10min内,Xe的平均反应速率为
,10min时,产物的物质的量(n)如表所示。10min内,Xe的平均反应速率为_____  ,
, 的转化率为
的转化率为______ 。
③523K时,以Xe和 制取
制取 。反应达到平衡时,欲使产物
。反应达到平衡时,欲使产物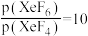 ,
, 的分压为
的分压为______ kPa。
(1)1886年法国化学家莫瓦桑首次通过电解熔融的氟氢化钾(
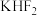 )制备
)制备 ,两极均有气体产生。装置如图所示,钢电极与电源的
,两极均有气体产生。装置如图所示,钢电极与电源的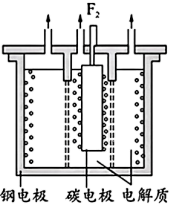
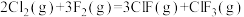
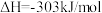 ;F-Cl(ClF中)的键能为248kJ/mol,F-Cl(
;F-Cl(ClF中)的键能为248kJ/mol,F-Cl( 中)的键能为172kJ/mol,F-F的键能为157kJ/mol。计算:Cl-Cl的键能为
中)的键能为172kJ/mol,F-F的键能为157kJ/mol。计算:Cl-Cl的键能为(3)氟单质的氧化性很强,可与稀有气体氙(Xe)同时发生如下三个反应。
| 标准平衡常数 | 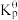 (523K) (523K) | 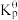 (673K) (673K) |
ⅰ.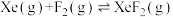 | 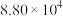 | 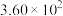 |
ⅱ. | 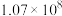 | 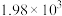 |
ⅲ. | 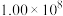 | 36 |
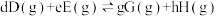 ,
,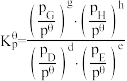 ,其中
,其中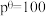 kPa,
kPa, 、
、 、
、 、
、 为各组分的平衡分压。
为各组分的平衡分压。①在恒温、恒容条件下,向密闭容器中通入一定量的Xe和
 ,下列有关说法不正确的是
,下列有关说法不正确的是A.当混合气体的密度不变时,体系达到平衡
B.当Xe与
 的投料比为1∶1时,
的投料比为1∶1时, 的平衡转化率大于Xe
的平衡转化率大于XeC.达到平衡后将
 从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动
从体系中移除,反应ⅰ、ⅱ、ⅲ均正向移动D.反应ⅰ、ⅱ、ⅲ均为放热反应
②在600K条件下,向体积为2L的密闭容器中通入30.0mol Xe和60.0mol
 ,10min时,产物的物质的量(n)如表所示。10min内,Xe的平均反应速率为
,10min时,产物的物质的量(n)如表所示。10min内,Xe的平均反应速率为 ,
, 的转化率为
的转化率为| 物质 |  |  |  |
| n/mol | 3.6 | 17.4 | 0.4 |
 制取
制取 。反应达到平衡时,欲使产物
。反应达到平衡时,欲使产物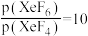 ,
, 的分压为
的分压为
您最近一年使用:0次
名校
解题方法
10 . 航天员呼吸产生的 用下列反应处理,可实现空间站中
用下列反应处理,可实现空间站中 的循环利用。
的循环利用。
Sabatier反应:
水电解反应:
一种新的循环利用方案是用Bosch反应
 代替Sabatier反应,再电解水实现
代替Sabatier反应,再电解水实现 的循环利用。回答下列问题:
的循环利用。回答下列问题:
(1)在Sabatier反应[反应Ⅰ:
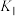 ]体系中,还会发生副反应(反应Ⅱ):
]体系中,还会发生副反应(反应Ⅱ):
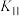 ;一定压强下,向某容积可变的密闭容器中通入
;一定压强下,向某容积可变的密闭容器中通入 和
和 的混合气体(其中
的混合气体(其中 和
和 的物质的量之比为1∶4),在某催化剂的作用下同时发生反应Ⅰ和反应Ⅱ,测得
的物质的量之比为1∶4),在某催化剂的作用下同时发生反应Ⅰ和反应Ⅱ,测得 的转化率、
的转化率、 的选择性、CO的选择性随反应温度的变化情况如图所示。
的选择性、CO的选择性随反应温度的变化情况如图所示。

已知: 或CO的选择性指反应生成
或CO的选择性指反应生成 或CO时所消耗的
或CO时所消耗的 的物质的量占参与反应的
的物质的量占参与反应的 总物质的量的百分比。相同温度下,反应
总物质的量的百分比。相同温度下,反应 的平衡常数为
的平衡常数为___________ (用含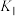 、
、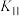 的式子表示);提高
的式子表示);提高 的选择性的措施有
的选择性的措施有___________ 。
(2)对于Bosch反应
 ,下列关于各图像的解释或得出的结论正确的是___________(填标号)。
,下列关于各图像的解释或得出的结论正确的是___________(填标号)。

(3)室温下,向体积为2L的恒容密闭容器中通入4mol 和1mol
和1mol  发生Sabatier反应:
发生Sabatier反应: (不考虑副反应);若反应时保持温度恒定,测得反应过程中压强随时间的变化如下表所示:
(不考虑副反应);若反应时保持温度恒定,测得反应过程中压强随时间的变化如下表所示:
①该温度下Sabatier反应的
___________ ( 为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)。
为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)。
②Sabatier反应的速率方程: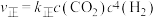 ,
, (k是速率常数,只与温度有关)。20min时,
(k是速率常数,只与温度有关)。20min时,
___________ 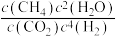 ;反应达平衡时,升高温度,
;反应达平衡时,升高温度, 增大的倍数
增大的倍数___________  增大的倍数。(两个空均填“>”“<”或“=”)
增大的倍数。(两个空均填“>”“<”或“=”)
(4)我国科学家开发Ni—N—C(Cl)催化剂实现高效催化 还原制备CO。装置如图所示(采用阳离子交换膜)。总反应为
还原制备CO。装置如图所示(采用阳离子交换膜)。总反应为 。其正极反应式为
。其正极反应式为___________ 。

 用下列反应处理,可实现空间站中
用下列反应处理,可实现空间站中 的循环利用。
的循环利用。Sabatier反应:

水电解反应:

一种新的循环利用方案是用Bosch反应

 代替Sabatier反应,再电解水实现
代替Sabatier反应,再电解水实现 的循环利用。回答下列问题:
的循环利用。回答下列问题:(1)在Sabatier反应[反应Ⅰ:

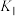 ]体系中,还会发生副反应(反应Ⅱ):
]体系中,还会发生副反应(反应Ⅱ):
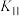 ;一定压强下,向某容积可变的密闭容器中通入
;一定压强下,向某容积可变的密闭容器中通入 和
和 的混合气体(其中
的混合气体(其中 和
和 的物质的量之比为1∶4),在某催化剂的作用下同时发生反应Ⅰ和反应Ⅱ,测得
的物质的量之比为1∶4),在某催化剂的作用下同时发生反应Ⅰ和反应Ⅱ,测得 的转化率、
的转化率、 的选择性、CO的选择性随反应温度的变化情况如图所示。
的选择性、CO的选择性随反应温度的变化情况如图所示。
已知:
 或CO的选择性指反应生成
或CO的选择性指反应生成 或CO时所消耗的
或CO时所消耗的 的物质的量占参与反应的
的物质的量占参与反应的 总物质的量的百分比。相同温度下,反应
总物质的量的百分比。相同温度下,反应 的平衡常数为
的平衡常数为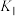 、
、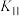 的式子表示);提高
的式子表示);提高 的选择性的措施有
的选择性的措施有(2)对于Bosch反应

 ,下列关于各图像的解释或得出的结论正确的是___________(填标号)。
,下列关于各图像的解释或得出的结论正确的是___________(填标号)。
A.由甲图可知,反应在 时可能改变了压强或使用了催化剂 时可能改变了压强或使用了催化剂 |
| B.由乙图可知,反应在m点可能达到了平衡状态 |
C.由丙图可知,反应过程中 的点是C点 的点是C点 |
| D.由丁图可知,交点A表示的反应一定处于平衡状态 |
(3)室温下,向体积为2L的恒容密闭容器中通入4mol
 和1mol
和1mol  发生Sabatier反应:
发生Sabatier反应: (不考虑副反应);若反应时保持温度恒定,测得反应过程中压强随时间的变化如下表所示:
(不考虑副反应);若反应时保持温度恒定,测得反应过程中压强随时间的变化如下表所示:| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强 | 5.00p | 4.60p | 4.30p | 4.15p | 4.06p | 4.00p | 4.00p |

 为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)。
为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)。②Sabatier反应的速率方程:
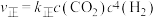 ,
, (k是速率常数,只与温度有关)。20min时,
(k是速率常数,只与温度有关)。20min时,
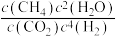 ;反应达平衡时,升高温度,
;反应达平衡时,升高温度, 增大的倍数
增大的倍数 增大的倍数。(两个空均填“>”“<”或“=”)
增大的倍数。(两个空均填“>”“<”或“=”)(4)我国科学家开发Ni—N—C(Cl)催化剂实现高效催化
 还原制备CO。装置如图所示(采用阳离子交换膜)。总反应为
还原制备CO。装置如图所示(采用阳离子交换膜)。总反应为 。其正极反应式为
。其正极反应式为
您最近一年使用:0次



