名校
解题方法
1 . 在一定温度下,将 和2moB两种气体相混合于容积为
和2moB两种气体相混合于容积为 的某密闭容器中,发生如下反应:
的某密闭容器中,发生如下反应: ,
, 末反应达到平衡状态,此时测得D的浓度为
末反应达到平衡状态,此时测得D的浓度为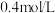 ,用C表示的反应速率为
,用C表示的反应速率为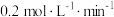 请填写下列空白:
请填写下列空白:
(1)x值等于___________ 。
(2)A的转化率为___________ 。
(3)如果增大反应体系的压强,则平衡体系中C的质量分数___________ (增大、减小或不变)。
(4)在此温度下,该化学反应的平衡常数K=___________ 。
(5)在此条件下,向该容器内加入 、
、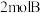 、
、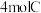 、
、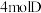 后,
后,
___________ (填“>”“<”或“=”) 。
。
(6)在此条件下, 末再向容器内加入
末再向容器内加入 、
、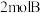 ,则平衡移动的方向
,则平衡移动的方向___________ ,再次达到平衡后A的转化率___________ (增大、减小或不变),C的物质的量分数___________ (增大、减小或不变)。
 和2moB两种气体相混合于容积为
和2moB两种气体相混合于容积为 的某密闭容器中,发生如下反应:
的某密闭容器中,发生如下反应: ,
, 末反应达到平衡状态,此时测得D的浓度为
末反应达到平衡状态,此时测得D的浓度为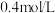 ,用C表示的反应速率为
,用C表示的反应速率为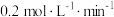 请填写下列空白:
请填写下列空白:(1)x值等于
(2)A的转化率为
(3)如果增大反应体系的压强,则平衡体系中C的质量分数
(4)在此温度下,该化学反应的平衡常数K=
(5)在此条件下,向该容器内加入
 、
、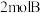 、
、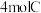 、
、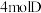 后,
后,
 。
。(6)在此条件下,
 末再向容器内加入
末再向容器内加入 、
、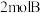 ,则平衡移动的方向
,则平衡移动的方向
您最近一年使用:0次
解题方法
2 . I.研究化学反应中的能量变化可以为提高工业生产效率提供指导性的理论依据。请结合所学化学反应原理相关知识回答下列问题:
(1)计算化学反应中的能量变化有多种途径。通过化学键的键能计算。已知:
计算可得:

_______  。
。
(2)通过盖斯定律计算。已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH=−870.3kJ∙mol−1
②C(s)+O2(g)=CO2(g) ΔH=−393.5kJ∙mol−1
③H2(g)+ O2(g)=H2O(l) ΔH=−285.8kJ∙mol−1。
O2(g)=H2O(l) ΔH=−285.8kJ∙mol−1。
试计算下列反应的反应热:2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH=_______  。
。
Ⅱ.某温度时,在一个容积为 的密闭容器中,
的密闭容器中,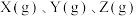 三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白。
三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白。

(3)该反应的化学方程式为_______ 。
(4)反应开始至 ,气体
,气体 的平均反应速率
的平均反应速率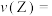
_______ mol∙L-1.min-1。
(5)反应开始至 ,气体X的转化率
,气体X的转化率_______ 。
Ⅲ.现有反应aA(g)+bB(g)⇌pC(g),达到平衡后,当升高温度时,B的浓度减小;当减小压强时,混合体系中C的质量分数也减小,则:
(6)该反应是_______ 热反应,且a+b_______ p(填“>”“<”或“=”)。
(7)减压时,A的质量分数_______ (填“增大”“减小”或“不变”,下同),正反应速率_______ 。
(8)若降低温度,则平衡时,B、C的浓度之比c(B)/c(C)将_______ 。
(9)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色_______ (填“变浅”“变深”或“不变”)。
(1)计算化学反应中的能量变化有多种途径。通过化学键的键能计算。已知:
| 化学键 |  |  |  |
键能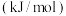 | 436 | 247 | 434 |


 。
。(2)通过盖斯定律计算。已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH=−870.3kJ∙mol−1
②C(s)+O2(g)=CO2(g) ΔH=−393.5kJ∙mol−1
③H2(g)+
 O2(g)=H2O(l) ΔH=−285.8kJ∙mol−1。
O2(g)=H2O(l) ΔH=−285.8kJ∙mol−1。试计算下列反应的反应热:2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH=
 。
。Ⅱ.某温度时,在一个容积为
 的密闭容器中,
的密闭容器中,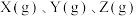 三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白。
三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白。
(3)该反应的化学方程式为
(4)反应开始至
 ,气体
,气体 的平均反应速率
的平均反应速率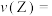
(5)反应开始至
 ,气体X的转化率
,气体X的转化率Ⅲ.现有反应aA(g)+bB(g)⇌pC(g),达到平衡后,当升高温度时,B的浓度减小;当减小压强时,混合体系中C的质量分数也减小,则:
(6)该反应是
(7)减压时,A的质量分数
(8)若降低温度,则平衡时,B、C的浓度之比c(B)/c(C)将
(9)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色
您最近一年使用:0次
名校
解题方法
3 . “绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)汽车是近代重要的交通运输工具,随着汽车量的激增,汽车尾气造成的环境污染也日益严重,汽车尾气中的有害成分主要有 、
、 、
、 、颗粒物和臭氧等。
、颗粒物和臭氧等。
①汽车尾气中 生成过程中的能量变化如图所示,1mol
生成过程中的能量变化如图所示,1mol 和1mol
和1mol 完全反应生成
完全反应生成 会
会___________ (填“吸收”或“放出”)___________ kJ能量。

②一种新型催化剂用于 和
和 的反应:
的反应: ,为测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的
,为测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的 和
和 浓度如下表:
浓度如下表:
前2s内的平均反应速率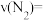
___________ 。
③在容积固定的绝热容器中发生反应 ,下列能说明该反应已达到平衡状态的是
,下列能说明该反应已达到平衡状态的是___________ (填标号)。
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.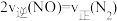 D.容器内混合气体密度保持不变
D.容器内混合气体密度保持不变
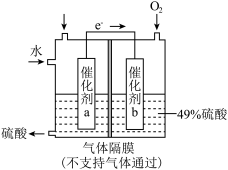
(2)煤燃烧排放的烟气中含有 和
和 ,会污染大气,形成酸雨。将
,会污染大气,形成酸雨。将 转化为重要的化工原料
转化为重要的化工原料 的原理示意图如图。催化剂a表面的电极反应式为
的原理示意图如图。催化剂a表面的电极反应式为___________ 。若得到的硫酸质量分数仍为49%,则理论上参加反应的 与加入的
与加入的 的物质的量之比为
的物质的量之比为___________ 。
(1)汽车是近代重要的交通运输工具,随着汽车量的激增,汽车尾气造成的环境污染也日益严重,汽车尾气中的有害成分主要有
 、
、 、
、 、颗粒物和臭氧等。
、颗粒物和臭氧等。①汽车尾气中
 生成过程中的能量变化如图所示,1mol
生成过程中的能量变化如图所示,1mol 和1mol
和1mol 完全反应生成
完全反应生成 会
会
②一种新型催化剂用于
 和
和 的反应:
的反应: ,为测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的
,为测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的 和
和 浓度如下表:
浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
 | 10 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
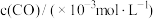 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
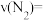
③在容积固定的绝热容器中发生反应
 ,下列能说明该反应已达到平衡状态的是
,下列能说明该反应已达到平衡状态的是A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.
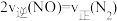 D.容器内混合气体密度保持不变
D.容器内混合气体密度保持不变(2)煤燃烧排放的烟气中含有
 和
和 ,会污染大气,形成酸雨。将
,会污染大气,形成酸雨。将 转化为重要的化工原料
转化为重要的化工原料 的原理示意图如图。催化剂a表面的电极反应式为
的原理示意图如图。催化剂a表面的电极反应式为 与加入的
与加入的 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
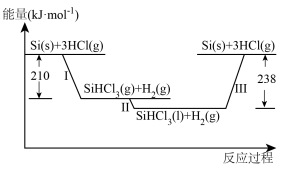
4 . 研究化学反应的原理,对掌握物质的应用有重要的意义。
Ⅰ.硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:
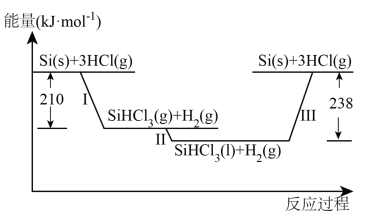
(1)工业上用 ,为原料制备粗硅。反应的化学方程式为
,为原料制备粗硅。反应的化学方程式为_______ 。
(2)反应Ⅲ生成2mol Si(s)时,_______ (填“吸收”或“放出”)_______ 热量。
(3)在2L密闭容器中投入过量Si(s)和3mol HCl(g)发生反应Ⅰ,经过t min反应达到平衡状态,测得容器中HCl的平衡浓度为0.6 。
。
①反应开始到t min,用HCl浓度变化表示的平均反应速率为_______  。
。
②下列叙述不能说明反应Ⅰ一定达到平衡状态的是_______ (填标号)。
A.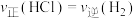 B.硅的质量保持不变
B.硅的质量保持不变
C.HCl的质量分数保持不变 D.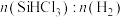 保持不变
保持不变
Ⅱ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。
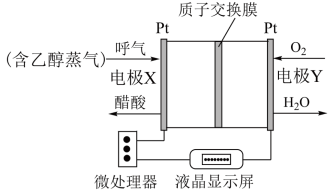
(4)电极X为_______ (填“正极”、“负极”)。
(5)电池工作时,质子通过交换膜_______ (填“从左到右”“从右到左”)迁移。
(6)正极的电极反应式为_______ 。
Ⅰ.硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:

(1)工业上用
 ,为原料制备粗硅。反应的化学方程式为
,为原料制备粗硅。反应的化学方程式为(2)反应Ⅲ生成2mol Si(s)时,
(3)在2L密闭容器中投入过量Si(s)和3mol HCl(g)发生反应Ⅰ,经过t min反应达到平衡状态,测得容器中HCl的平衡浓度为0.6
 。
。①反应开始到t min,用HCl浓度变化表示的平均反应速率为
 。
。②下列叙述不能说明反应Ⅰ一定达到平衡状态的是
A.
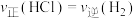 B.硅的质量保持不变
B.硅的质量保持不变C.HCl的质量分数保持不变 D.
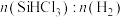 保持不变
保持不变Ⅱ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。

(4)电极X为
(5)电池工作时,质子通过交换膜
(6)正极的电极反应式为
您最近一年使用:0次
名校
解题方法
5 . 含氮化合物在农业、工业、国防等领域都有着广泛的应用。如图是氮元素部分常见物质间的相互转化示意图。

请回答下列问题:
(1)常温常压下,NO2为___________ 色气体;过程II、III、IV的转化中,都存在氮元素___________ (填“被氧化”或“被还原”)的变化。
(2)写出过程II的化学方程式:___________ 。若NO2最终完全转化为HNO3,计算1.7tNH3理论上可以得到质量分数为63%的硝酸溶液___________ t。
(3)过程V是工业生产中吸收尾气NO2的一种方法,该过程中除生成NaNO2外,还产生一种气体和另一种盐,写出该反应的离子方程式:___________ 。
(4)用200mL稀硝酸可以将5.6g铁粉恰好完全溶解(假设还原产物只有NO),并且溶液中的Fe2+与Fe3+的物质的量之比为3:1,该稀硝酸的物质的量浓度为___________ mol∙L-1。
(5)NO2和N2O4(无色)两种气体之间的转化为 。
。
①如果1mol NO2 (g)完全转化成N2O4 (g)时放出的热量为238.5kJ,请从化学键角度描述能量变化的原因:___________ 。
②上述转化是一个典型的可逆反应。在恒温恒容密闭容器中反应,下列状况不能说明该反应达到化学平衡状态的是___________ (填字母)。
A.容器内气体的颜色不再变化 B.生成1mol N2O4的同时消耗1mol N2O4
C. D.容器中混合气体的密度不再变化
D.容器中混合气体的密度不再变化

请回答下列问题:
(1)常温常压下,NO2为
(2)写出过程II的化学方程式:
(3)过程V是工业生产中吸收尾气NO2的一种方法,该过程中除生成NaNO2外,还产生一种气体和另一种盐,写出该反应的离子方程式:
(4)用200mL稀硝酸可以将5.6g铁粉恰好完全溶解(假设还原产物只有NO),并且溶液中的Fe2+与Fe3+的物质的量之比为3:1,该稀硝酸的物质的量浓度为
(5)NO2和N2O4(无色)两种气体之间的转化为
 。
。①如果1mol NO2 (g)完全转化成N2O4 (g)时放出的热量为238.5kJ,请从化学键角度描述能量变化的原因:
②上述转化是一个典型的可逆反应。在恒温恒容密闭容器中反应,下列状况不能说明该反应达到化学平衡状态的是
A.容器内气体的颜色不再变化 B.生成1mol N2O4的同时消耗1mol N2O4
C.
 D.容器中混合气体的密度不再变化
D.容器中混合气体的密度不再变化
您最近一年使用:0次
名校
6 . 完成下列问题。
(1)硫酸在工业生产中有着重要的意义, 是工业制硫酸的重要原料。
是工业制硫酸的重要原料。 时,向
时,向 的恒容密闭容器中充入
的恒容密闭容器中充入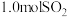 和
和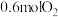 ,发生如下反应:
,发生如下反应:
① 后反应达到平衡,
后反应达到平衡, 和
和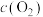 相等,
相等,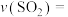
_______  ,平衡后向容器中再充入
,平衡后向容器中再充入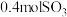 和
和 ,此时,
,此时, (正)
(正)___________  (逆)。(填“>”、“=”或“<”)。
(逆)。(填“>”、“=”或“<”)。
②相同温度下,起始投料变为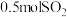 和
和 ,
, 的平衡转化率
的平衡转化率___________ 。(填“增大”、“不变”或“减小”)
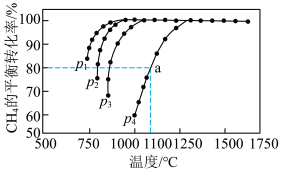
(2)2020年,我国明确提出“碳达峰”与“碳中和”的目标,研究二氧化碳的利用对这一宏伟目标的实现具有现实意义。
已知反应 ,若在一密闭容器中通入
,若在一密闭容器中通入 和
和 ,一定条件下发生该反应,测得
,一定条件下发生该反应,测得 的平衡转化率、温度及压强的关系如图所示:
的平衡转化率、温度及压强的关系如图所示:
①下列描述能说明该反应处于化学平衡状态的是___________ (填字母)。
A. 的质量分数保持不变 B.容器内气体密度保持不变
的质量分数保持不变 B.容器内气体密度保持不变
C.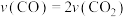 D.容器内混合气体的平均相对分子质量保持不变
D.容器内混合气体的平均相对分子质量保持不变
②图中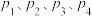 ,压强最大的是
,压强最大的是___________ 。
(1)硫酸在工业生产中有着重要的意义,
 是工业制硫酸的重要原料。
是工业制硫酸的重要原料。 时,向
时,向 的恒容密闭容器中充入
的恒容密闭容器中充入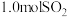 和
和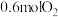 ,发生如下反应:
,发生如下反应:
①
 后反应达到平衡,
后反应达到平衡, 和
和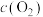 相等,
相等,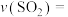
 ,平衡后向容器中再充入
,平衡后向容器中再充入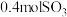 和
和 ,此时,
,此时, (正)
(正) (逆)。(填“>”、“=”或“<”)。
(逆)。(填“>”、“=”或“<”)。②相同温度下,起始投料变为
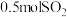 和
和 ,
, 的平衡转化率
的平衡转化率(2)2020年,我国明确提出“碳达峰”与“碳中和”的目标,研究二氧化碳的利用对这一宏伟目标的实现具有现实意义。
已知反应
 ,若在一密闭容器中通入
,若在一密闭容器中通入 和
和 ,一定条件下发生该反应,测得
,一定条件下发生该反应,测得 的平衡转化率、温度及压强的关系如图所示:
的平衡转化率、温度及压强的关系如图所示:
①下列描述能说明该反应处于化学平衡状态的是
A.
 的质量分数保持不变 B.容器内气体密度保持不变
的质量分数保持不变 B.容器内气体密度保持不变C.
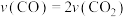 D.容器内混合气体的平均相对分子质量保持不变
D.容器内混合气体的平均相对分子质量保持不变②图中
 ,压强最大的是
,压强最大的是
您最近一年使用:0次
7 . 回答下列问题
(1)下列各种说法或表述正确的是_________ 。(填序号)
①石油、煤、天然气、可燃冰、植物油都属于化石燃料。
②开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放
③利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法
④淀粉、纤维素、蛋白质、油脂均属于天然有机高分子化合物
⑤CH3—CH=CH—C≡C—CH3分子中所有碳原子一定在同一平面上
⑥ 的二氯代物有12种
的二氯代物有12种
(2)有机物由碳、氢、氧、氮四种元素组成,其中含碳32%,氢6.7%,氧43%(均为质量分数)。该有机物的相对分子质量为75,其分子式为_________ 。若该有机物是蛋白质水解的产物,它与乙醇反应生成的酯可用于合成医药和农药,写出生成该酯的化学方程式__________________ 。
(3)甲醇是一种基础有机化工原料,广泛应用于有机合成、医药、农药、染料、高分子等化工生产领域。利用二氧化碳合成甲醇,能有效降低二氧化碳排放量,为甲醇合成提供了一条绿色合成的新途径。工业上利用该反应合成甲醇。已知:25℃,101KPa下:
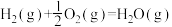 ΔH1=-242kJ·mol-1
ΔH1=-242kJ·mol-1
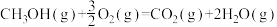 ΔH2=-676kJ·mol-1
ΔH2=-676kJ·mol-1
①写出CO2和H2生成气态甲醇等产物的热化学方程式__________________ 。
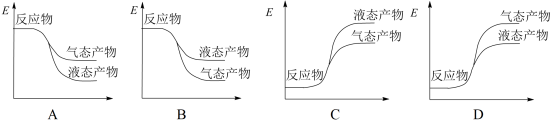
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是_________ (填字母序号)。
③某兴趣小组对该反应进行了实验探究。在一定温度和催化剂条件下,将1molCO2和3molH2通入2L密闭容器中进行反应(此时容器内总压强为200kPa),反应物和产物的分压随时间的变化曲线如图所示。
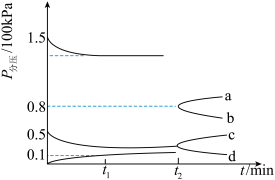
若保持容器体积不变,t1时反应达到平衡,测得H2的体积分数为 ,此时用H2压强表示0-t1时间内的反应速率v(H2)=
,此时用H2压强表示0-t1时间内的反应速率v(H2)=_________ kPa·min-1。
(1)下列各种说法或表述正确的是
①石油、煤、天然气、可燃冰、植物油都属于化石燃料。
②开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放
③利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法
④淀粉、纤维素、蛋白质、油脂均属于天然有机高分子化合物
⑤CH3—CH=CH—C≡C—CH3分子中所有碳原子一定在同一平面上
⑥
 的二氯代物有12种
的二氯代物有12种(2)有机物由碳、氢、氧、氮四种元素组成,其中含碳32%,氢6.7%,氧43%(均为质量分数)。该有机物的相对分子质量为75,其分子式为
(3)甲醇是一种基础有机化工原料,广泛应用于有机合成、医药、农药、染料、高分子等化工生产领域。利用二氧化碳合成甲醇,能有效降低二氧化碳排放量,为甲醇合成提供了一条绿色合成的新途径。工业上利用该反应合成甲醇。已知:25℃,101KPa下:
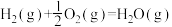 ΔH1=-242kJ·mol-1
ΔH1=-242kJ·mol-1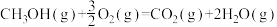 ΔH2=-676kJ·mol-1
ΔH2=-676kJ·mol-1①写出CO2和H2生成气态甲醇等产物的热化学方程式
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是

③某兴趣小组对该反应进行了实验探究。在一定温度和催化剂条件下,将1molCO2和3molH2通入2L密闭容器中进行反应(此时容器内总压强为200kPa),反应物和产物的分压随时间的变化曲线如图所示。

若保持容器体积不变,t1时反应达到平衡,测得H2的体积分数为
 ,此时用H2压强表示0-t1时间内的反应速率v(H2)=
,此时用H2压强表示0-t1时间内的反应速率v(H2)=
您最近一年使用:0次
名校
8 . Ⅰ.700℃时,若向2L恒容的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g) C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。
C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。

(1)0~10min 内的 CO2平均反应速率v( CO2)=___________
(2)图中A点v正___________ v逆(填“>”“<”或“=”)。
(3)下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中CO2与N2的物质的量之比为1∶1
B.混合气体的总物质的量不随时间的变化而变化
C.单位时间内每消耗a mol N2,同时消耗2a mol NO
D.N2的质量分数在混合气体中保持不变
E.混合气体的密度不随时间的变化而变化
Ⅱ.氢氧燃料电池的电解质溶液为KOH溶液,电池总反应为2H2+O2=2H2O。回答下列问题:
(4)该电池的负极反应式为___________ 。
(5)电池工作一段时间后电解质溶液的
___________ (填“增大”“减小”或“不变”)。
 C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。
C(s)+2NO(g);其中N2、NO物质的量随时间变化的曲线如图所示。
(1)0~10min 内的 CO2平均反应速率v( CO2)=
(2)图中A点v正
(3)下列叙述中能说明上述反应达到平衡状态的是
A.反应中CO2与N2的物质的量之比为1∶1
B.混合气体的总物质的量不随时间的变化而变化
C.单位时间内每消耗a mol N2,同时消耗2a mol NO
D.N2的质量分数在混合气体中保持不变
E.混合气体的密度不随时间的变化而变化
Ⅱ.氢氧燃料电池的电解质溶液为KOH溶液,电池总反应为2H2+O2=2H2O。回答下列问题:
(4)该电池的负极反应式为
(5)电池工作一段时间后电解质溶液的

您最近一年使用:0次
9 . 研究化学反应的原理,对掌握物质的应用有重要的意义。
Ⅰ.硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:
(1)工业上用 为原料制备粗硅。
为原料制备粗硅。
①反应的化学方程式为______ 。
② 的用途是
的用途是______ (任写一种)。
(2)反应Ⅲ生成2 mol Si(s)时,______ (填“吸收”或“放出”)______ 热量。
(3)在2L密闭容器中投入过量Si(s)和3 mol HCl(g)发生反应Ⅰ,经过t min反应达到平衡状态,测得容器中HCl的平衡浓度为0.6 mol·L 。
。
①反应开始到t min,用HCl浓度变化表示的平均反应速率为______ mol⋅L ⋅min
⋅min 。
。
②为加快反应速率,可采取的措施为______ (任写一种)。
③下列叙述不能说明反应Ⅰ一定达到平衡状态的是______ (填标号)。
a.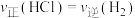 b.硅的质量保持不变
b.硅的质量保持不变
c.HCl的质量分数保持不变 d. 保持不变
保持不变
Ⅱ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。

(4)电极X为______ (填“正极”、“负极”)。
(5)电池工作时,质子通过交换膜______ (填“从左到右”、“从右到左”)迁移。
(6)正极的电极反应式为______ 。
Ⅰ.硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:

(1)工业上用
 为原料制备粗硅。
为原料制备粗硅。①反应的化学方程式为
②
 的用途是
的用途是(2)反应Ⅲ生成2 mol Si(s)时,
(3)在2L密闭容器中投入过量Si(s)和3 mol HCl(g)发生反应Ⅰ,经过t min反应达到平衡状态,测得容器中HCl的平衡浓度为0.6 mol·L
 。
。①反应开始到t min,用HCl浓度变化表示的平均反应速率为
 ⋅min
⋅min 。
。②为加快反应速率,可采取的措施为
③下列叙述不能说明反应Ⅰ一定达到平衡状态的是
a.
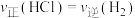 b.硅的质量保持不变
b.硅的质量保持不变c.HCl的质量分数保持不变 d.
 保持不变
保持不变Ⅱ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。

(4)电极X为
(5)电池工作时,质子通过交换膜
(6)正极的电极反应式为
您最近一年使用:0次
名校
解题方法
10 . 将CO2与H2反应转化为甲醇(CH3OH)是变废为宝的好方法,其原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。一定温度下,在2L的密闭容器中CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体)。
CH3OH(g)+H2O(g)。一定温度下,在2L的密闭容器中CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体)。

(1)在0~3min内用CO2表示该反应的速率是_____ 。(保留2位有效数字)。该反应达到最大限度时H2的转化率_____ ,此时CH3OH在平衡混合物中的体积分数为_____ (均用百分数表示,且保留3位有效数字)。
(2)10min后,反应处于化学平衡状态,下列说法中能作为该反应处于平衡状态的依据的是_____ 。
a.3v正(H2)=v逆(CO2)
b.混合气体的密度不再发生变化
c.混合气体的平均相对分子质量不再发生改变
d.体系的温度不再发生改变
e.混合气体的颜色不再发生改变
f.CO2与H2的物质的量之比不再发生改变
g.甲醇的质量分数不再发生改变
h.体系压强不再发生改变
(3)若上述反应在甲、乙、丙三个相同容器内同时进行,测得甲中v(CO2)=0.1mol•L-1•min-1,乙中v(H2)=0.2mol•L-1•min-1,丙中v(CH3OH)=0.3mol•L-1•s-1,则反应速率最快的是_____ 。
(4)甲醇(CH3OH)是一种有毒物质,常温下检测甲醇含量的测试仪工作原理示意图如图:
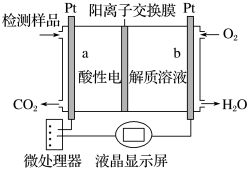
a电极发生的电极反应式为_____ 。
 CH3OH(g)+H2O(g)。一定温度下,在2L的密闭容器中CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体)。
CH3OH(g)+H2O(g)。一定温度下,在2L的密闭容器中CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体)。
(1)在0~3min内用CO2表示该反应的速率是
(2)10min后,反应处于化学平衡状态,下列说法中能作为该反应处于平衡状态的依据的是
a.3v正(H2)=v逆(CO2)
b.混合气体的密度不再发生变化
c.混合气体的平均相对分子质量不再发生改变
d.体系的温度不再发生改变
e.混合气体的颜色不再发生改变
f.CO2与H2的物质的量之比不再发生改变
g.甲醇的质量分数不再发生改变
h.体系压强不再发生改变
(3)若上述反应在甲、乙、丙三个相同容器内同时进行,测得甲中v(CO2)=0.1mol•L-1•min-1,乙中v(H2)=0.2mol•L-1•min-1,丙中v(CH3OH)=0.3mol•L-1•s-1,则反应速率最快的是
(4)甲醇(CH3OH)是一种有毒物质,常温下检测甲醇含量的测试仪工作原理示意图如图:

a电极发生的电极反应式为
您最近一年使用:0次
2023-05-06更新
|
247次组卷
|
2卷引用:湖北省巴东县第一高级中学2020-2021学年高一下学期第四次月考化学试题



