1 . 纳米氧化锌具有颗粒微小,比表面积大,分散性好,疏松多孔等物理特性和极强的化学活性,目前已广泛用于橡胶、陶瓷、催化剂、涂料和磁性材料的辅助生产。以铜转炉烟灰为原料,采用浸取、均相沉淀、干燥煅烧等工艺制备纳米氧化锌的工艺方法过程简单,生产成本低。具体流程如下:
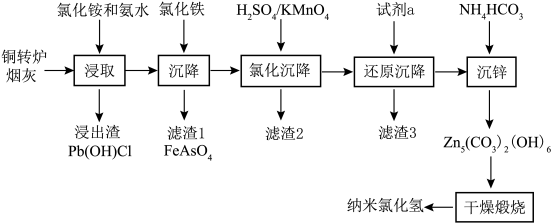
已知某铜转炉烟灰化学成分百分含量分析如下表:
铜转炉烟灰主要化学成分分析结果 %
以上金属元素在铜转炉烟灰中均以硫酸盐和氧化物形式存在,砷以砷酸盐形式存在。
流程中涉及离子的氢氧化物溶度积常数如下表:
请回答下列问题:
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃ ,浸出率随温度升高而降低的原因可能是___________ ;
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___________ 。
(3)在“沉降”过程中,FeCl3做沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是___________ ,缩短沉降时间;
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5 ,使还原产物为MnO2,滤渣2主要成分为___________ ;
(5)“还原沉降”选用的“试剂a”为___________ (填化学式);
(6)“沉锌”反应的离子方程式为___________ ,整个流程中可以循环利用的副产品是___________ (填化学式);
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整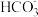 和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,
和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时, 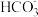 的浓度为
的浓度为___________ 沉淀物的粒径最佳。

已知某铜转炉烟灰化学成分百分含量分析如下表:
铜转炉烟灰主要化学成分分析结果 %
| Cu | Zn | Pb | Fe( Ⅱ) | As |
| 10.30 | 8.75 | 19.07 | 2.51 | 4.68 |
流程中涉及离子的氢氧化物溶度积常数如下表:
| 离子 | Cu2+ | Zn2+ | Fe2+ | Fe3+ |
| Ksp | 2.2× 10-20 | 6.7×10-17 | 8.0×10-16 | 4.0×10-38 |
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃ ,浸出率随温度升高而降低的原因可能是
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为
(3)在“沉降”过程中,FeCl3做沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5 ,使还原产物为MnO2,滤渣2主要成分为
(5)“还原沉降”选用的“试剂a”为
(6)“沉锌”反应的离子方程式为
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整
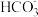 和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,
和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时, 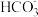 的浓度为
的浓度为n(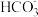 )/n(Zn2+) )/n(Zn2+) | 粒度分布质量分数1% | ||||
| 0.0-0.1um | 0.1~0.5um | 0.5~1.0um | 1.0~5.0um | 5.0um以上 | |
| 2 | 25.3 | 38.41 | 34.55 | 1.74 | 0.001 |
| 2.5 | 40.82 | 50.35 | 8.37 | 0.46 | 0.001 |
| 3 | 35.2 | 55.37 | 8.2 | 1.23 | 0.001 |
您最近一年使用:0次
2023-04-29更新
|
213次组卷
|
2卷引用:内蒙古呼和浩特市2023届高三下学期第二次质量数据监测理科综合化学试题
2 . 合成NH3是重要的研究课题,一种合成NH3的流程示意如图。
相关数据如表:
已知:Mg3N2溶于水发生反应Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
I.固氮:
(1)从结构上解释N2化学性质稳定的原因_____ 。上述固氮反应的化学方程式是_____ 。固氮的适宜温度范围是_____ 。(填编号)
a.500~600℃ b.700~800℃ c.900~1000℃
(2)检测固氮作用:向固氮后的产物中加水,_____ (填操作和现象),说明Mg能起到固氮作用。
II.转氨:选用试剂a完成转化。
(3)选用H2O进行转化,发现从体系中分离出NH3较困难,若选用HCl气体进行转化,发现能产生NH3,且产物MgCl2能直接循环利用,但NH3的收率较低,原因是_____ 。
活性炭还原NO2的原理为2NO2(g)+2C(s) N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2
N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2 N2O4)。实验测得NO2的转化率与时间的关系如图所示:
N2O4)。实验测得NO2的转化率与时间的关系如图所示:
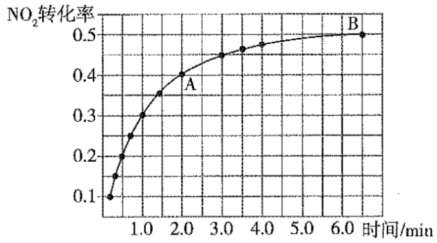
(4)反应达到平衡时CO2的体积分数为_____ ,混合气体的平均摩尔质量 (A)
(A)_____  (B)(填“大于”“小于”或“等于”)。
(B)(填“大于”“小于”或“等于”)。
(5)下列能够判断该反应已达到平衡状态的是_____ 。(填序号)
a.CO2的质量分数保持不变
b.容器中N2与CO2的百分含量之比保持不变
c.2v(逆)(NO2)=V(正)(N2)
d.混合气体的颜色保持不变

相关数据如表:
| 物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 分解温度/℃ |
| Mg | 649 | 1090 | >300 | Mg3N2:>800 |
已知:Mg3N2溶于水发生反应Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
I.固氮:
(1)从结构上解释N2化学性质稳定的原因
a.500~600℃ b.700~800℃ c.900~1000℃
(2)检测固氮作用:向固氮后的产物中加水,
II.转氨:选用试剂a完成转化。
(3)选用H2O进行转化,发现从体系中分离出NH3较困难,若选用HCl气体进行转化,发现能产生NH3,且产物MgCl2能直接循环利用,但NH3的收率较低,原因是
活性炭还原NO2的原理为2NO2(g)+2C(s)
 N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2
N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2 N2O4)。实验测得NO2的转化率与时间的关系如图所示:
N2O4)。实验测得NO2的转化率与时间的关系如图所示:
(4)反应达到平衡时CO2的体积分数为
 (A)
(A) (B)(填“大于”“小于”或“等于”)。
(B)(填“大于”“小于”或“等于”)。(5)下列能够判断该反应已达到平衡状态的是
a.CO2的质量分数保持不变
b.容器中N2与CO2的百分含量之比保持不变
c.2v(逆)(NO2)=V(正)(N2)
d.混合气体的颜色保持不变
您最近一年使用:0次
解题方法
3 . 2-丁烯是一种重要的有机化工原料。回答下列问题:
(1)已知2-丁烯有顺、反两种同分异构体,可表示为顺 、反
、反 。一定条件下,它们分别发生加成反应的热化学方程式为:
。一定条件下,它们分别发生加成反应的热化学方程式为:
①顺 :
:

 。
。
②反 :
:


相同条件下,两种气体之间存在如下转化:

该反应的△H=________ 。下列叙述中,能表明该反应已达到平衡状态的是________ (填序号)。
a.顺-C4H8的含量保持不变
b.混合气体的平均摩尔质量保持不变
c.混合气体中碳的质量分数保持不变
达到平衡后,若要进一步提高体系中反-C4H8的含量,可采取的措施是___________________________ 。
(2)2-丁烯与氯气反应时,一般用镍作催化剂。镍具有优良的物理和化学特性,是许多领域尤其是高科技产业的重要原料。
①羰基法提纯粗镍涉及的两步反应依次为:
Ⅰ.Ni(s)+4CO(g) Ni(CO)4(g) △H<0
Ni(CO)4(g) △H<0
Ⅱ.Ni(CO)4(g) Ni(s)+4CO(g)
Ni(s)+4CO(g)
则下图中能反映出羰基法提纯粗镍过程中能量变化的是________ 。

②一定条件下,在2L密闭容器中制备Ni(CO)4,粗镍(所含杂质不与CO反应)剩余质量和反应时间的关系如图所示。Ni(CO)4在0~10min的平均反应速率为________ mol/(L·min)。

③若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,重新达到平衡时________ (填序号)。
a.平衡常数K增大 b.CO的浓度减小 c.v逆[Ni(CO)4]增大
④设计简单实验方案用羰基法提纯粗镍:将粗镍粉末装入玻璃管一端,抽真空后充入CO并封管,______________________________________________________________________ 。
(1)已知2-丁烯有顺、反两种同分异构体,可表示为顺
 、反
、反 。一定条件下,它们分别发生加成反应的热化学方程式为:
。一定条件下,它们分别发生加成反应的热化学方程式为:①顺
 :
:
 。
。②反
 :
:

相同条件下,两种气体之间存在如下转化:

该反应的△H=
a.顺-C4H8的含量保持不变
b.混合气体的平均摩尔质量保持不变
c.混合气体中碳的质量分数保持不变
达到平衡后,若要进一步提高体系中反-C4H8的含量,可采取的措施是
(2)2-丁烯与氯气反应时,一般用镍作催化剂。镍具有优良的物理和化学特性,是许多领域尤其是高科技产业的重要原料。
①羰基法提纯粗镍涉及的两步反应依次为:
Ⅰ.Ni(s)+4CO(g)
 Ni(CO)4(g) △H<0
Ni(CO)4(g) △H<0 Ⅱ.Ni(CO)4(g)
 Ni(s)+4CO(g)
Ni(s)+4CO(g) 则下图中能反映出羰基法提纯粗镍过程中能量变化的是

②一定条件下,在2L密闭容器中制备Ni(CO)4,粗镍(所含杂质不与CO反应)剩余质量和反应时间的关系如图所示。Ni(CO)4在0~10min的平均反应速率为

③若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,重新达到平衡时
a.平衡常数K增大 b.CO的浓度减小 c.v逆[Ni(CO)4]增大
④设计简单实验方案用羰基法提纯粗镍:将粗镍粉末装入玻璃管一端,抽真空后充入CO并封管,
您最近一年使用:0次
名校
4 . 丙烯是重要的有机化工原料,主要用于生产聚丙烯、丙烯腈、环氧丙烷等。
(1)以丁烯和乙烯为原料反应生成丙烯的方法被称为“烯烃歧化法”,反应为:C4H8(g)+C2H4(g)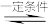 2C3H6(g)。已知:
2C3H6(g)。已知:
①C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ∆H1=-1411kJ•mol-1
②C3H6(g)+ O2(g)=3CO2(g)+3H2O(l) ∆H2=-2049kJ•mol-1
O2(g)=3CO2(g)+3H2O(l) ∆H2=-2049kJ•mol-1
③C4H8(g)+6O2(g)=4CO2(g)+4H2O(l) ∆H3=-2539kJ•mol-1
“烯烃歧化法”的反应的热化学方程式为_______ 。
(2)一定温度下,在一体积恒为V升的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化法的主要反应。t1时刻达到平衡状态,此时容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol,且C3H6占平衡总体积的1/4。
①求该时间段内的反应速率v(C4H8)=_______ 。(用只含a、V、t1的式子表示)
②判断该反应达到平衡的标志是_______
A.2v(C4H8)生成=v(C3H6)消耗
B.C4H8、C2H4、C3H6的物质的量之比为1:1:2
C.混合气体的平均相对分子质量不再改变
D.C4H8、C2H4、C3H6的浓度均不再变化
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应﹕C4H8(g)+C2H4(g)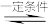 2C3H6(g),该反应中正反应速率v正=k正·p(C4H8)·p(C2H4),逆反应速率v逆=k逆·p2(C3H6),其中k正、k逆为速率常数,则Kp为
2C3H6(g),该反应中正反应速率v正=k正·p(C4H8)·p(C2H4),逆反应速率v逆=k逆·p2(C3H6),其中k正、k逆为速率常数,则Kp为_______ (用k正、k逆表示)。
II“丁烯裂解法”是另一种重要的丙烯生产法,但生产过程中会有生成乙烯的副反应发生。反应如下主反应:3C4H8 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8 2C2H4
2C2H4
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(P)变化的趋势分别如图1和图2所示:

(4)平衡体系中的丙烯和乙烯的质量比是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是__ (填字母序号)。
A.300oC0.1MPa B.700oC0.1MPa C.300oC0.5MPa D.700oC0.5MPa
(5)有研究者结合图1数据并综合考虑各种因素,认为450℃的反应温度比300℃或700℃更合适,从反应原理角度分析其理由可能是____ 。
(6)图2中,随压强增大平衡体系中丙烯的百分含量呈上升趋势,从平衡角度解释其原因是__ 。
(1)以丁烯和乙烯为原料反应生成丙烯的方法被称为“烯烃歧化法”,反应为:C4H8(g)+C2H4(g)
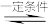 2C3H6(g)。已知:
2C3H6(g)。已知:①C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ∆H1=-1411kJ•mol-1
②C3H6(g)+
 O2(g)=3CO2(g)+3H2O(l) ∆H2=-2049kJ•mol-1
O2(g)=3CO2(g)+3H2O(l) ∆H2=-2049kJ•mol-1③C4H8(g)+6O2(g)=4CO2(g)+4H2O(l) ∆H3=-2539kJ•mol-1
“烯烃歧化法”的反应的热化学方程式为
(2)一定温度下,在一体积恒为V升的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化法的主要反应。t1时刻达到平衡状态,此时容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol,且C3H6占平衡总体积的1/4。
①求该时间段内的反应速率v(C4H8)=
②判断该反应达到平衡的标志是
A.2v(C4H8)生成=v(C3H6)消耗
B.C4H8、C2H4、C3H6的物质的量之比为1:1:2
C.混合气体的平均相对分子质量不再改变
D.C4H8、C2H4、C3H6的浓度均不再变化
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应﹕C4H8(g)+C2H4(g)
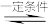 2C3H6(g),该反应中正反应速率v正=k正·p(C4H8)·p(C2H4),逆反应速率v逆=k逆·p2(C3H6),其中k正、k逆为速率常数,则Kp为
2C3H6(g),该反应中正反应速率v正=k正·p(C4H8)·p(C2H4),逆反应速率v逆=k逆·p2(C3H6),其中k正、k逆为速率常数,则Kp为II“丁烯裂解法”是另一种重要的丙烯生产法,但生产过程中会有生成乙烯的副反应发生。反应如下主反应:3C4H8
 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8 2C2H4
2C2H4测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(P)变化的趋势分别如图1和图2所示:

(4)平衡体系中的丙烯和乙烯的质量比是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是
A.300oC0.1MPa B.700oC0.1MPa C.300oC0.5MPa D.700oC0.5MPa
(5)有研究者结合图1数据并综合考虑各种因素,认为450℃的反应温度比300℃或700℃更合适,从反应原理角度分析其理由可能是
(6)图2中,随压强增大平衡体系中丙烯的百分含量呈上升趋势,从平衡角度解释其原因是
您最近一年使用:0次
5 . 二甲醚是一种重要的精细化工产品,被广泛用于制药、染料、农药及日用化工。以下为其中一种合成二甲醚的方法:
①CO2(g)+3H2(g)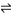 CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
②2CH3OH(g)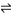 CH3OCH3(g)+H2O(g) △H2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5kJ·mol-1
③2CO2(g)+6H2(g)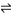 CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=________ kJ·mol-1。
(2)某温度下在容积为2L的密闭容器中加入CH3OH(g)发生反应②,测得有关数据如下:
①前2min内,H2O(g)的平均反应速率为________ mol·L-1·min-1;此反应在该温度下的平衡常数为________ ;若再向容器中分别加入CH3OH(g)0.02mol、CH3OCH3(g)1.0mol,此时该反应中υ正________ υ逆(填“>”、“<”或“=”)。
②根据文献,甲醇的转化率可以根据冷凝的液相中甲醇与水的百分含量来计算(忽略挥发到气相的甲醇),若以A表示冷凝液中水的质量分数,B表示冷凝液中甲醇的质量分数,则甲醇的转化率α(CH3OH)=________ 。
(3)一定条件下,发生反应③,原料气中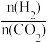 和温度对CO2转化率影响的实验数据如图所示。
和温度对CO2转化率影响的实验数据如图所示。
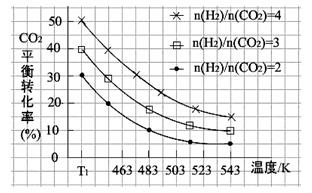
结合图象,可得出CO2平衡转化率受外界条件影响的变化规律为:
a:________ ;
b:________ 。
①CO2(g)+3H2(g)
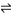 CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1②2CH3OH(g)
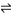 CH3OCH3(g)+H2O(g) △H2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5kJ·mol-1③2CO2(g)+6H2(g)
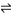 CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3(1)△H3=
(2)某温度下在容积为2L的密闭容器中加入CH3OH(g)发生反应②,测得有关数据如下:
| 反应时间/min | 0 | 1 | 2 | 3 | 4 |
| n(CH3OH)/mol | 1.02 | 0.4 | 0.2 | 0.02 | 0.02 |
①前2min内,H2O(g)的平均反应速率为
②根据文献,甲醇的转化率可以根据冷凝的液相中甲醇与水的百分含量来计算(忽略挥发到气相的甲醇),若以A表示冷凝液中水的质量分数,B表示冷凝液中甲醇的质量分数,则甲醇的转化率α(CH3OH)=
(3)一定条件下,发生反应③,原料气中
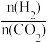 和温度对CO2转化率影响的实验数据如图所示。
和温度对CO2转化率影响的实验数据如图所示。
结合图象,可得出CO2平衡转化率受外界条件影响的变化规律为:
a:
b:
您最近一年使用:0次
2019-02-25更新
|
302次组卷
|
2卷引用:【校级联考】安徽省皖江名校联盟2019届高三下学期开年摸底大联考理科综合化学试题
17-18高一下·江苏无锡·期末
名校
6 . H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
(1)已知25℃,1.01×105Pa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:___________________________________________ 。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。

①从反应开始到平衡,CO2的平均反应速率v(CO2)=___________________ 。
②达到平衡时,H2的转化率为__________ 。
③该反应的平衡常数K=___________________ (表达式)。
④下列措施不能提高反应速率的是__________ 。
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) + 2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______ 。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
(1)已知25℃,1.01×105Pa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=
②达到平衡时,H2的转化率为
③该反应的平衡常数K=
④下列措施不能提高反应速率的是
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) + 2H2(g)
 CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
您最近一年使用:0次
2018-07-24更新
|
327次组卷
|
4卷引用:【新东方】高中化学140
(已下线)【新东方】高中化学140(已下线)2022年浙江1月高考真题变式题(26-31)【全国市级联考】江苏省无锡市普通高中2017-2018学年高一下学期期末考试化学试题【全国百强校】内蒙古集宁一中(西校区)2017-2018学年高一下学期期末考试化学试题
解题方法
7 . 2-丁烯是一种重要的有机化工原料。回答下列问题:
(1)已知2一丁烯有顺、反两种同分异构体,可表示为顺-C4H8、反-C4H8。一定条件下,它们分别发生加成反应的热化学方程式为:
①顺-C4H8: (g)+H2(g)→CH3CH2CH2CH3(g) △H="-118.9" kJ/mol,
(g)+H2(g)→CH3CH2CH2CH3(g) △H="-118.9" kJ/mol,
②反-C4H8: (g)+H2(g)→CH3CH2CH2CH3(g) △H=-112.7 kJ/mol,
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-112.7 kJ/mol,
相同条件下,两种气体之间存在如下转化:

该反应的反应热为:△H=_______________。下列叙述中能表明该反应已达到平衡状态的是________(填序号)
a.顺-C4H8的含量保持不变
b.混合气体的平均摩尔质量保持不变
c.混合气体中碳的质量分数保持不变
达到平衡后,若要进一步提高体系中反-C4H8的含量,可采取的措施是_______________。
(2)2-丁烯与氢气反应时,一般用镍作催化剂,镍具有优良的物理和化学特性,是许多领域尤其是高科技产业的重要原料。
①羰基法提纯粗镍涉及的两步反应依次为:
Ⅰ.Ni(s)+4CO(g) Ni(CO)4(g)△H<0;
Ni(CO)4(g)△H<0;
Ⅱ.Ni(CO)4(g) Ni(s)+4CO(g),
Ni(s)+4CO(g),
则下图中能反映出羰基法提纯粗镍过程中能量变化的是_______________。

②在一定条件下的2L密闭容器中制备Ni(CO)4,粗镍(所含杂质不与CO反应)剩余质量和反应时间的关系如图所示.Ni(CO)4在0~10min的平均反应速率为_______________。

③若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,重新达到平衡时_______________(填序号)
a.平衡常数K增大 b.CO的浓度减小 c.v正[Ni(CO)4]增大
④设计简单实验方案用羰基法提纯粗镍,将粗镍粉末装入玻璃管一端,抽真空后充入CO并封管,_______________。
(1)已知2一丁烯有顺、反两种同分异构体,可表示为顺-C4H8、反-C4H8。一定条件下,它们分别发生加成反应的热化学方程式为:
①顺-C4H8:
 (g)+H2(g)→CH3CH2CH2CH3(g) △H="-118.9" kJ/mol,
(g)+H2(g)→CH3CH2CH2CH3(g) △H="-118.9" kJ/mol,②反-C4H8:
 (g)+H2(g)→CH3CH2CH2CH3(g) △H=-112.7 kJ/mol,
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-112.7 kJ/mol,相同条件下,两种气体之间存在如下转化:

该反应的反应热为:△H=_______________。下列叙述中能表明该反应已达到平衡状态的是________(填序号)
a.顺-C4H8的含量保持不变
b.混合气体的平均摩尔质量保持不变
c.混合气体中碳的质量分数保持不变
达到平衡后,若要进一步提高体系中反-C4H8的含量,可采取的措施是_______________。
(2)2-丁烯与氢气反应时,一般用镍作催化剂,镍具有优良的物理和化学特性,是许多领域尤其是高科技产业的重要原料。
①羰基法提纯粗镍涉及的两步反应依次为:
Ⅰ.Ni(s)+4CO(g)
 Ni(CO)4(g)△H<0;
Ni(CO)4(g)△H<0;Ⅱ.Ni(CO)4(g)
 Ni(s)+4CO(g),
Ni(s)+4CO(g),则下图中能反映出羰基法提纯粗镍过程中能量变化的是_______________。

②在一定条件下的2L密闭容器中制备Ni(CO)4,粗镍(所含杂质不与CO反应)剩余质量和反应时间的关系如图所示.Ni(CO)4在0~10min的平均反应速率为_______________。

③若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,重新达到平衡时_______________(填序号)
a.平衡常数K增大 b.CO的浓度减小 c.v正[Ni(CO)4]增大
④设计简单实验方案用羰基法提纯粗镍,将粗镍粉末装入玻璃管一端,抽真空后充入CO并封管,_______________。
您最近一年使用:0次
8 . 在某温度下,5L密闭容器内发生如下反应:CH4(g)+H2O (g) CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
(1)反应中的非极性分子为:______ 、______ 。
(2)一个可逆反应的平衡常数只随温度而变化,请写出该反应的平衡常数表达式______ ,当温度升高,该平衡常数______ (填“增大”、“减小”或“不变”)。
(3)反应20min后生成了18g氢气,甲烷的平均反应速率为______ 。
(4)下列选项中的物理量不变时,一定可以判断反应达到平衡的是______(双选)。
(5)在某一时刻,v正=v逆=v,此时反应达到平衡。若改变一条件,可使得v正<v逆<v,指出可以改变的条件______ ,并说明理由:__________________ 。
A.升高温度 B.增大压强 C.降低温度 D.降低压强
(6)已知CO与H2合成CH3OH是可逆反应:CO+2H2 CH3OH。试求:当投料比n(CO):n(H2)=
CH3OH。试求:当投料比n(CO):n(H2)= ______ 时,平衡时CO与H2的转化率相同。
 CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0(1)反应中的非极性分子为:
(2)一个可逆反应的平衡常数只随温度而变化,请写出该反应的平衡常数表达式
(3)反应20min后生成了18g氢气,甲烷的平均反应速率为
(4)下列选项中的物理量不变时,一定可以判断反应达到平衡的是______(双选)。
| A.氢元素的质量分数 | B.容器内的压强 |
| C.反应的平衡常数 | D.容器内气体的平均分子量 |
A.升高温度 B.增大压强 C.降低温度 D.降低压强
(6)已知CO与H2合成CH3OH是可逆反应:CO+2H2
 CH3OH。试求:当投料比n(CO):n(H2)=
CH3OH。试求:当投料比n(CO):n(H2)=
您最近一年使用:0次
解题方法
9 . 恒温恒容条件下,向密闭容器中加入一定量M,发生反应的方程式为①M N;②N
N;②N Q。反应①的速率v1=k1c(M),反应②的速率v2=k2c(N),式中k1、k2为速率常数。图甲为该体系中M、N、Q的质量分数w随时间变化的曲线,图乙为反应①和②的lnk~T曲线(k为速率常数)。下列说法正确的是
Q。反应①的速率v1=k1c(M),反应②的速率v2=k2c(N),式中k1、k2为速率常数。图甲为该体系中M、N、Q的质量分数w随时间变化的曲线,图乙为反应①和②的lnk~T曲线(k为速率常数)。下列说法正确的是
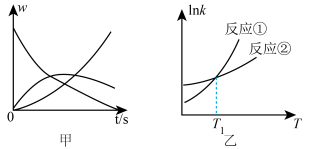
 N;②N
N;②N Q。反应①的速率v1=k1c(M),反应②的速率v2=k2c(N),式中k1、k2为速率常数。图甲为该体系中M、N、Q的质量分数w随时间变化的曲线,图乙为反应①和②的lnk~T曲线(k为速率常数)。下列说法正确的是
Q。反应①的速率v1=k1c(M),反应②的速率v2=k2c(N),式中k1、k2为速率常数。图甲为该体系中M、N、Q的质量分数w随时间变化的曲线,图乙为反应①和②的lnk~T曲线(k为速率常数)。下列说法正确的是
| A.反应过程中,随c(M)的减小,反应①、②的速率均降低 |
| B.温度高于T1时,总反应速率由反应①决定 |
| C.欲提高N的产率,需降低反应温度且控制反应时间 |
| D.体系中可能存在v(M)=v(N)+v(Q) |
您最近一年使用:0次
2023·上海·模拟预测
名校
解题方法
10 . 某温度下,在体积为5 L的密闭容器内发生如下反应: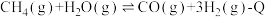
(1)在上述反应的反应物与生成物中,非极性分子为:_______ 。
(2)若反应20 min后气体总物质的量增加了10 mol,则甲烷的平均反应速率为_______ 。
(3)下列选项中的物理量不变时,一定可以判断反应达到平衡的是_______。
(4)在某一时刻,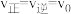 ,反应若改变某一条件,可使得
,反应若改变某一条件,可使得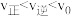 ,指出可以改变的条件,并说明理由:
,指出可以改变的条件,并说明理由:_______ 。
已知CO与合成 是可逆反应:
是可逆反应: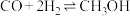 。
。
(5)若上述反应达到平衡时CO与 的转化率相同,则投料比
的转化率相同,则投料比
_______ 。
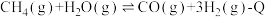
(1)在上述反应的反应物与生成物中,非极性分子为:
(2)若反应20 min后气体总物质的量增加了10 mol,则甲烷的平均反应速率为
(3)下列选项中的物理量不变时,一定可以判断反应达到平衡的是_______。
| A.容器内氢元素的质量分数 | B.容器内的压强 |
| C.反应的平衡常数 | D.容器内气体的平均相对分子质量 |
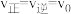 ,反应若改变某一条件,可使得
,反应若改变某一条件,可使得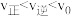 ,指出可以改变的条件,并说明理由:
,指出可以改变的条件,并说明理由:已知CO与合成
 是可逆反应:
是可逆反应: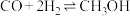 。
。(5)若上述反应达到平衡时CO与
 的转化率相同,则投料比
的转化率相同,则投料比
您最近一年使用:0次



