1 . 为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入1mol CO2、3mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。经测得CO2和CH3OH的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CO2和CH3OH的物质的量随时间变化如图所示。
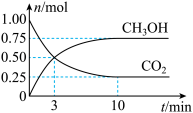
(1)在3min末,H2的浓度为_______ ,这时,反应速率 υ(正)_______ υ(逆)(选填>、<或 =)。
(2)从反应开始到平衡,平均反应速率υ(CO2)=_______ 。达到平衡时,H2的转化率为_______ 。
(3)下列措施不能提高反应速率的是_______。
(4)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:υ(H2)=0.3 mol∙L−1∙s−1;乙:υ(CO2)=0.12 mol∙L−1∙s−1;丙:υ(CH3OH)=4.8 mol∙L−1∙min−1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______ 。
(5)在一体积固定的密闭容器中投入一定量的CO2和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是_______ 。
A.反应中CO2与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1mol CO2,同时生成1mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
 CH3OH(g)+H2O(g)。经测得CO2和CH3OH的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CO2和CH3OH的物质的量随时间变化如图所示。
(1)在3min末,H2的浓度为
(2)从反应开始到平衡,平均反应速率υ(CO2)=
(3)下列措施不能提高反应速率的是_______。
| A.升高温度 | B.加入催化剂 | C.增大压强 | D.及时分离出CH3OH |
(5)在一体积固定的密闭容器中投入一定量的CO2和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
A.反应中CO2与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1mol CO2,同时生成1mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
您最近一年使用:0次
2 . 合成NH3是重要的研究课题,一种合成NH3的流程示意如图。
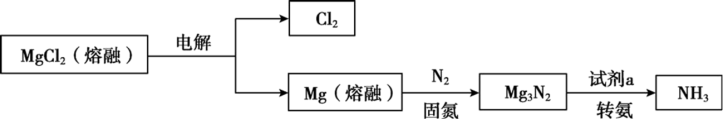
相关数据如表:
已知:Mg3N2溶于水发生反应Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
I.固氮:
(1)从结构上解释N2化学性质稳定的原因_____ 。上述固氮反应的化学方程式是_____ 。固氮的适宜温度范围是_____ 。(填编号)
a.500~600℃ b.700~800℃ c.900~1000℃
(2)检测固氮作用:向固氮后的产物中加水,_____ (填操作和现象),说明Mg能起到固氮作用。
II.转氨:选用试剂a完成转化。
(3)选用H2O进行转化,发现从体系中分离出NH3较困难,若选用HCl气体进行转化,发现能产生NH3,且产物MgCl2能直接循环利用,但NH3的收率较低,原因是_____ 。
活性炭还原NO2的原理为2NO2(g)+2C(s) N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2
N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2 N2O4)。实验测得NO2的转化率与时间的关系如图所示:
N2O4)。实验测得NO2的转化率与时间的关系如图所示:
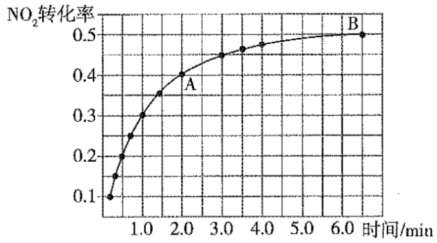
(4)反应达到平衡时CO2的体积分数为_____ ,混合气体的平均摩尔质量 (A)
(A)_____  (B)(填“大于”“小于”或“等于”)。
(B)(填“大于”“小于”或“等于”)。
(5)下列能够判断该反应已达到平衡状态的是_____ 。(填序号)
a.CO2的质量分数保持不变
b.容器中N2与CO2的百分含量之比保持不变
c.2v(逆)(NO2)=V(正)(N2)
d.混合气体的颜色保持不变

相关数据如表:
| 物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 分解温度/℃ |
| Mg | 649 | 1090 | >300 | Mg3N2:>800 |
已知:Mg3N2溶于水发生反应Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
I.固氮:
(1)从结构上解释N2化学性质稳定的原因
a.500~600℃ b.700~800℃ c.900~1000℃
(2)检测固氮作用:向固氮后的产物中加水,
II.转氨:选用试剂a完成转化。
(3)选用H2O进行转化,发现从体系中分离出NH3较困难,若选用HCl气体进行转化,发现能产生NH3,且产物MgCl2能直接循环利用,但NH3的收率较低,原因是
活性炭还原NO2的原理为2NO2(g)+2C(s)
 N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2
N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2 N2O4)。实验测得NO2的转化率与时间的关系如图所示:
N2O4)。实验测得NO2的转化率与时间的关系如图所示:
(4)反应达到平衡时CO2的体积分数为
 (A)
(A) (B)(填“大于”“小于”或“等于”)。
(B)(填“大于”“小于”或“等于”)。(5)下列能够判断该反应已达到平衡状态的是
a.CO2的质量分数保持不变
b.容器中N2与CO2的百分含量之比保持不变
c.2v(逆)(NO2)=V(正)(N2)
d.混合气体的颜色保持不变
您最近一年使用:0次
名校
解题方法
3 . 化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)在煤的气化反应器中发生如下几种反应:
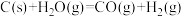


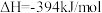


则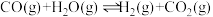

_______
(2)已知830℃时,在一个容积固定的密闭容器中,发生反应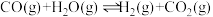 下列能判断该反应达到化学平衡状态的是
下列能判断该反应达到化学平衡状态的是 _______
a.容器中的压强不变 b.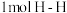 键断裂的同时断裂
键断裂的同时断裂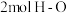 键
键
c.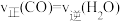 d.
d.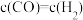
此温度下该反应的 ,等物质的量的
,等物质的量的 和
和 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为_______
(3)将不同量的 和
和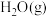 分别通入到体积为2L的恒容密闭容器中,进行反应
分别通入到体积为2L的恒容密闭容器中,进行反应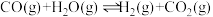 ,得到如表三组数据:
,得到如表三组数据:
①实验1中以 表示的反应速率为
表示的反应速率为_______ 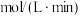 ;
;
②该反应的逆反应为_______ (填“吸”或“放”)热反应;
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且 ,则a、b应满足的关系是
,则a、b应满足的关系是_______ (用含a、b的数学式表示).
(4)目前工业上有一种方法是用 来生产甲醇。一定条件下发生反应:
来生产甲醇。一定条件下发生反应: ,如图1,表示该反应进行过程中能量(单位为
,如图1,表示该反应进行过程中能量(单位为 )的变化
)的变化

①在体积为1L的恒容密闭容器中,充入 和
和 ,下列措施中能使
,下列措施中能使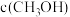 增大的是
增大的是_______ (填字母)
a.升高温度 b.充入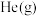 ,使体系压强增大
,使体系压强增大
c.将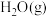 从体系中分离出来 d.再充入
从体系中分离出来 d.再充入 和
和
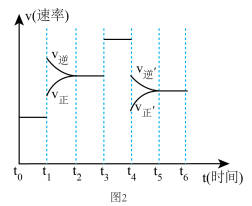
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态且只改变一个条件)反应速率随时间的变化.如图2:其中表示平衡混合物中 含量最高的一段时间是
含量最高的一段时间是_______ ;如 平衡常数为
平衡常数为 ,
, 平衡常数为
平衡常数为 ,则
,则
_______  (填>、=、<)。
(填>、=、<)。
(1)在煤的气化反应器中发生如下几种反应:
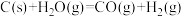


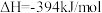


则
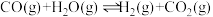

(2)已知830℃时,在一个容积固定的密闭容器中,发生反应
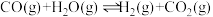 下列能判断该反应达到化学平衡状态的是
下列能判断该反应达到化学平衡状态的是 a.容器中的压强不变 b.
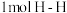 键断裂的同时断裂
键断裂的同时断裂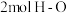 键
键c.
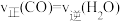 d.
d.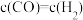
此温度下该反应的
 ,等物质的量的
,等物质的量的 和
和 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为(3)将不同量的
 和
和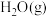 分别通入到体积为2L的恒容密闭容器中,进行反应
分别通入到体积为2L的恒容密闭容器中,进行反应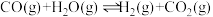 ,得到如表三组数据:
,得到如表三组数据:| 实验组 | 温度/℃ | 起始量 | 平衡量 | 达到平衡所需时间/min | ||
 |  |  |  | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | a | b | c | d | t |
 表示的反应速率为
表示的反应速率为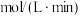 ;
;②该反应的逆反应为
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且
 ,则a、b应满足的关系是
,则a、b应满足的关系是(4)目前工业上有一种方法是用
 来生产甲醇。一定条件下发生反应:
来生产甲醇。一定条件下发生反应: ,如图1,表示该反应进行过程中能量(单位为
,如图1,表示该反应进行过程中能量(单位为 )的变化
)的变化
①在体积为1L的恒容密闭容器中,充入
 和
和 ,下列措施中能使
,下列措施中能使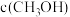 增大的是
增大的是a.升高温度 b.充入
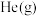 ,使体系压强增大
,使体系压强增大c.将
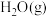 从体系中分离出来 d.再充入
从体系中分离出来 d.再充入 和
和
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态且只改变一个条件)反应速率随时间的变化.如图2:其中表示平衡混合物中
 含量最高的一段时间是
含量最高的一段时间是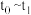 平衡常数为
平衡常数为 ,
,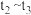 平衡常数为
平衡常数为 ,则
,则
 (填>、=、<)。
(填>、=、<)。
您最近一年使用:0次
名校
解题方法
4 . CH3OH、CO、CH4等都是重要的能源,也是重要的化工原料。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
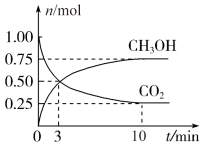
①从反应开始到平衡,CO2的平均反应速率v(CO2)=____ 。
②达到平衡时,H2的浓度为____ mol/L。
(2)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是____ 。
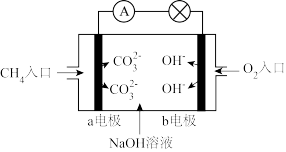
(3)某种甲烷燃料电池的工作原理如图所示氧气通入的一极为电源的____ 极,a电极反应式:____ ,b电极反应式:____ 。
(4)当电路中累计有2 mol电子通过时,消耗的甲烷体积为(在标准状况下)____ L。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=
②达到平衡时,H2的浓度为
(2)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)
 CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是| A.反应中CO与CH3OH的物质的量之比为1:1 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH |
| D.CH3OH的质量分数在混合气体中保持不变 |
(4)当电路中累计有2 mol电子通过时,消耗的甲烷体积为(在标准状况下)

您最近一年使用:0次
2022-05-12更新
|
440次组卷
|
3卷引用:河南省南阳市2021-2022学年高一下学期期中质量评估化学试题
5 . 减少CO的排放和降低空气中CO含量都是实现碳达峰、碳中和的重要手段。
I.化学链燃烧(CLC)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集CO2,从而减少CO2的排放。基于CuO/Cu2O载体的甲烷化学链燃烧技术如图所示。

空气反应器与燃料反应器中发生的反应分别如下:
i.2Cu2O(s)+O2(g) 4CuO(s) ΔH1=-227kJ·mol-1
4CuO(s) ΔH1=-227kJ·mol-1
ii.8CuO(s)+CH4(g) 4Cu2O(s)+CO2(g)+2H2O(g) ΔH2=-348kJ·mol-1
4Cu2O(s)+CO2(g)+2H2O(g) ΔH2=-348kJ·mol-1
回答下列问题:
(1)反应iii.CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH3=
CO2(g)+2H2O(g) ΔH3=___________ 。
(2)氧的质量分数::载氧体I___________ (填>”“<”或“=”)载氧体Ⅱ。
II.催化还原CO2是降低空气中CO2含量的重要手段之一、研究表明,在催化剂存在下,CO2和H2可发生两个平行应分别生成CH3OH和CO。反应的热化学方程式如下:
iv.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH4
CH3OH(g)+H2O(g) ΔH4
v.CO2(g)+H2(g) CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5
某实验兴趣小组在一定温度下,将0.1molCO2和0.3molH2充人容积为2L的恒容密闭容器中,4min后,反应达到平衡,此时测得反应前后的压强比为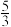 H2O(g)的物质的量分数为37.5%。回答下列问题:
H2O(g)的物质的量分数为37.5%。回答下列问题:
(3)对于反应iv,在___________ (填“高温”或“低温”)下有利于该反应自发进行。
(4)反应达平衡后:
①c(CO)=___________ mol·L,0~4min,v(CH3OH)=___________ mol·L-1.min-1。
②H2的转化率为___________ %(保留三位有效数字)。
③该温度下,反应iv的平衡常数K=___________ 。
④若再往该容器中充人0.45molH2和0.09molCO,对于反应V,此时V正___________ (填“>”“<”或“=”)V逆,判断的理由是___________ 。
I.化学链燃烧(CLC)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集CO2,从而减少CO2的排放。基于CuO/Cu2O载体的甲烷化学链燃烧技术如图所示。

空气反应器与燃料反应器中发生的反应分别如下:
i.2Cu2O(s)+O2(g)
 4CuO(s) ΔH1=-227kJ·mol-1
4CuO(s) ΔH1=-227kJ·mol-1ii.8CuO(s)+CH4(g)
 4Cu2O(s)+CO2(g)+2H2O(g) ΔH2=-348kJ·mol-1
4Cu2O(s)+CO2(g)+2H2O(g) ΔH2=-348kJ·mol-1回答下列问题:
(1)反应iii.CH4(g)+2O2(g)
 CO2(g)+2H2O(g) ΔH3=
CO2(g)+2H2O(g) ΔH3=(2)氧的质量分数::载氧体I
II.催化还原CO2是降低空气中CO2含量的重要手段之一、研究表明,在催化剂存在下,CO2和H2可发生两个平行应分别生成CH3OH和CO。反应的热化学方程式如下:
iv.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH4
CH3OH(g)+H2O(g) ΔH4v.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5某实验兴趣小组在一定温度下,将0.1molCO2和0.3molH2充人容积为2L的恒容密闭容器中,4min后,反应达到平衡,此时测得反应前后的压强比为
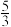 H2O(g)的物质的量分数为37.5%。回答下列问题:
H2O(g)的物质的量分数为37.5%。回答下列问题:(3)对于反应iv,在
(4)反应达平衡后:
①c(CO)=
②H2的转化率为
③该温度下,反应iv的平衡常数K=
④若再往该容器中充人0.45molH2和0.09molCO,对于反应V,此时V正
您最近一年使用:0次
17-18高一下·江苏无锡·期末
名校
6 . H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
(1)已知25℃,1.01×105Pa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:___________________________________________ 。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。

①从反应开始到平衡,CO2的平均反应速率v(CO2)=___________________ 。
②达到平衡时,H2的转化率为__________ 。
③该反应的平衡常数K=___________________ (表达式)。
④下列措施不能提高反应速率的是__________ 。
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) + 2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______ 。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
(1)已知25℃,1.01×105Pa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=
②达到平衡时,H2的转化率为
③该反应的平衡常数K=
④下列措施不能提高反应速率的是
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) + 2H2(g)
 CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
您最近一年使用:0次
2018-07-24更新
|
327次组卷
|
4卷引用:2022年浙江1月高考真题变式题(26-31)
(已下线)2022年浙江1月高考真题变式题(26-31)【全国市级联考】江苏省无锡市普通高中2017-2018学年高一下学期期末考试化学试题【全国百强校】内蒙古集宁一中(西校区)2017-2018学年高一下学期期末考试化学试题(已下线)【新东方】高中化学140
解题方法
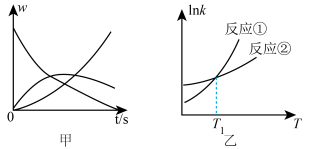
7 . 恒温恒容条件下,向密闭容器中加入一定量M,发生反应的方程式为①M N;②N
N;②N Q。反应①的速率v1=k1c(M),反应②的速率v2=k2c(N),式中k1、k2为速率常数。图甲为该体系中M、N、Q的质量分数w随时间变化的曲线,图乙为反应①和②的lnk~T曲线(k为速率常数)。下列说法正确的是
Q。反应①的速率v1=k1c(M),反应②的速率v2=k2c(N),式中k1、k2为速率常数。图甲为该体系中M、N、Q的质量分数w随时间变化的曲线,图乙为反应①和②的lnk~T曲线(k为速率常数)。下列说法正确的是
 N;②N
N;②N Q。反应①的速率v1=k1c(M),反应②的速率v2=k2c(N),式中k1、k2为速率常数。图甲为该体系中M、N、Q的质量分数w随时间变化的曲线,图乙为反应①和②的lnk~T曲线(k为速率常数)。下列说法正确的是
Q。反应①的速率v1=k1c(M),反应②的速率v2=k2c(N),式中k1、k2为速率常数。图甲为该体系中M、N、Q的质量分数w随时间变化的曲线,图乙为反应①和②的lnk~T曲线(k为速率常数)。下列说法正确的是
| A.反应过程中,随c(M)的减小,反应①、②的速率均降低 |
| B.温度高于T1时,总反应速率由反应①决定 |
| C.欲提高N的产率,需降低反应温度且控制反应时间 |
| D.体系中可能存在v(M)=v(N)+v(Q) |
您最近一年使用:0次
名校
8 . 完成下列问题。
(1)硫酸在工业生产中有着重要的意义, 是工业制硫酸的重要原料。
是工业制硫酸的重要原料。 时,向
时,向 的恒容密闭容器中充入
的恒容密闭容器中充入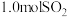 和
和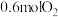 ,发生如下反应:
,发生如下反应:
① 后反应达到平衡,
后反应达到平衡, 和
和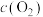 相等,
相等,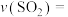
_______  ,平衡后向容器中再充入
,平衡后向容器中再充入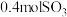 和
和 ,此时,
,此时, (正)
(正)___________  (逆)。(填“>”、“=”或“<”)。
(逆)。(填“>”、“=”或“<”)。
②相同温度下,起始投料变为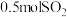 和
和 ,
, 的平衡转化率
的平衡转化率___________ 。(填“增大”、“不变”或“减小”)
(2)2020年,我国明确提出“碳达峰”与“碳中和”的目标,研究二氧化碳的利用对这一宏伟目标的实现具有现实意义。
已知反应 ,若在一密闭容器中通入
,若在一密闭容器中通入 和
和 ,一定条件下发生该反应,测得
,一定条件下发生该反应,测得 的平衡转化率、温度及压强的关系如图所示:
的平衡转化率、温度及压强的关系如图所示:
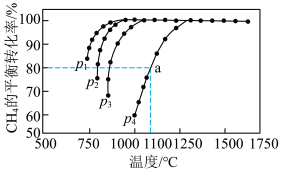
①下列描述能说明该反应处于化学平衡状态的是___________ (填字母)。
A. 的质量分数保持不变 B.容器内气体密度保持不变
的质量分数保持不变 B.容器内气体密度保持不变
C.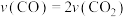 D.容器内混合气体的平均相对分子质量保持不变
D.容器内混合气体的平均相对分子质量保持不变
②图中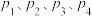 ,压强最大的是
,压强最大的是___________ 。
(1)硫酸在工业生产中有着重要的意义,
 是工业制硫酸的重要原料。
是工业制硫酸的重要原料。 时,向
时,向 的恒容密闭容器中充入
的恒容密闭容器中充入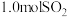 和
和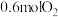 ,发生如下反应:
,发生如下反应:
①
 后反应达到平衡,
后反应达到平衡, 和
和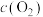 相等,
相等,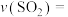
 ,平衡后向容器中再充入
,平衡后向容器中再充入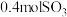 和
和 ,此时,
,此时, (正)
(正) (逆)。(填“>”、“=”或“<”)。
(逆)。(填“>”、“=”或“<”)。②相同温度下,起始投料变为
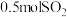 和
和 ,
, 的平衡转化率
的平衡转化率(2)2020年,我国明确提出“碳达峰”与“碳中和”的目标,研究二氧化碳的利用对这一宏伟目标的实现具有现实意义。
已知反应
 ,若在一密闭容器中通入
,若在一密闭容器中通入 和
和 ,一定条件下发生该反应,测得
,一定条件下发生该反应,测得 的平衡转化率、温度及压强的关系如图所示:
的平衡转化率、温度及压强的关系如图所示:
①下列描述能说明该反应处于化学平衡状态的是
A.
 的质量分数保持不变 B.容器内气体密度保持不变
的质量分数保持不变 B.容器内气体密度保持不变C.
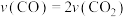 D.容器内混合气体的平均相对分子质量保持不变
D.容器内混合气体的平均相对分子质量保持不变②图中
 ,压强最大的是
,压强最大的是
您最近一年使用:0次
9 . 某温度下,在2L恒容密闭容器中进行反应mX(g)+nY(g) pZ(g)+qQ(g)(m、n、p、q均为化学计量数)。在0~3min内,各物质物质的量随时间的变化如表所示:
pZ(g)+qQ(g)(m、n、p、q均为化学计量数)。在0~3min内,各物质物质的量随时间的变化如表所示:
已知:0~2min内,v(Q)=0.075mol/(L•min); =
= 。
。
回答下列问题:
(1)起始时,n(Y)=______ mol,n(Q)=______ mol。
(2)m=______ ,n=______ 。
(3)0~2min内,v(Z)=______ mol/(L•min)。
(4)反应达到平衡时,Q的物质的量分数为______ ,该反应的平衡常数K=______ (不用化简,写出计算式即可)。
(5)下列叙述能作为判断该反应已达到化学平衡状态的依据的是______ (填标号)。
①n(X):n(Y):n(Z):n(Q)=m:n:p:q
②Y的物质的量浓度不再发生改变
③物质Z的质量分数不再发生改变
④混合气体的总质量不再发生改变
 pZ(g)+qQ(g)(m、n、p、q均为化学计量数)。在0~3min内,各物质物质的量随时间的变化如表所示:
pZ(g)+qQ(g)(m、n、p、q均为化学计量数)。在0~3min内,各物质物质的量随时间的变化如表所示:| X | Y | Z | Q | |
| 0min/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
已知:0~2min内,v(Q)=0.075mol/(L•min);
 =
=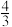 。
。回答下列问题:
(1)起始时,n(Y)=
(2)m=
(3)0~2min内,v(Z)=
(4)反应达到平衡时,Q的物质的量分数为
(5)下列叙述能作为判断该反应已达到化学平衡状态的依据的是
①n(X):n(Y):n(Z):n(Q)=m:n:p:q
②Y的物质的量浓度不再发生改变
③物质Z的质量分数不再发生改变
④混合气体的总质量不再发生改变
您最近一年使用:0次
10 . 甲醇(CH3OH)是一种重要的化工原料。已知
CH3OH(1) + O2(g) = CO(g) + 2H2O(g) ; △H = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ; △H = -566.00 kJ·mol-1
H2O(1) = H2O (g) ; △H = +44.00 kJ·mol-1
(1)试写出能表示CH3OH(l)燃烧热的热化学方程式:_______ 。
(2)800℃时A、B、C三种气体在恒容密闭容器中反应时的浓度变化如图所示,分析图像,回答下列问题:
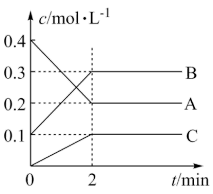
①该反应的方程式为_______ 。
②2min内,用B表示的反应速率为_______ 。
③下列能说明该反应达到平衡状态的是_______ 。
A.体系压强保持不变 B.容器中气体密度保持不变 C.混合气体平均摩尔质量保持不变 D.每消耗2mol A的同时生成1mol C E.A、B、C浓度之比为2:2:1 F.混合气体中A的质量分数保持不变
④为加快该反应的反应速率,可采取的措施是_______ 。
A.恒容通入He B.分离出B C.选择高效的催化剂 D.适当升高体系温度
CH3OH(1) + O2(g) = CO(g) + 2H2O(g) ; △H = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ; △H = -566.00 kJ·mol-1
H2O(1) = H2O (g) ; △H = +44.00 kJ·mol-1
(1)试写出能表示CH3OH(l)燃烧热的热化学方程式:
(2)800℃时A、B、C三种气体在恒容密闭容器中反应时的浓度变化如图所示,分析图像,回答下列问题:

①该反应的方程式为
②2min内,用B表示的反应速率为
③下列能说明该反应达到平衡状态的是
A.体系压强保持不变 B.容器中气体密度保持不变 C.混合气体平均摩尔质量保持不变 D.每消耗2mol A的同时生成1mol C E.A、B、C浓度之比为2:2:1 F.混合气体中A的质量分数保持不变
④为加快该反应的反应速率,可采取的措施是
A.恒容通入He B.分离出B C.选择高效的催化剂 D.适当升高体系温度
您最近一年使用:0次



