解题方法
1 . 探究CH₃OH合成反应化学平衡的影响因素,有利于提高CH₃OH的产率。在一定条件下,以CO₂和H₂为原料合成CH₃OH涉及的主要反应如下:
①CO₂(g)+3H₂(g) CH₃OH(g)+H₂O(g) ΔH₁
CH₃OH(g)+H₂O(g) ΔH₁
②CO₂(g)+H₂(g) CO(g)+H₂O(g) ΔH₂
CO(g)+H₂O(g) ΔH₂
③CO(g)+2H₂(g) CH₃OH(g) ΔH₃
CH₃OH(g) ΔH₃
回答下列问题:
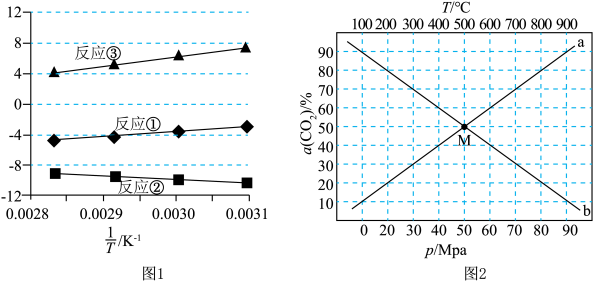
(1)ΔH₃=_______ (用ΔH₁、ΔH₂表示),已知反应①、②、③以物质的量分数表示的平衡常数KX与温度T变化关系如图1所示。据此判断 的数值范围是
的数值范围是_______ (填标号)。
A. -1 B.-1~0 C.0~1 D.
-1 B.-1~0 C.0~1 D. 1
1
(2)在催化剂N表面进行反应①,当起始量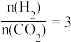 时,在不同条件下达到平衡,体系中CO₂的转化率为
时,在不同条件下达到平衡,体系中CO₂的转化率为 (CO₂),在T=400℃下
(CO₂),在T=400℃下 (CO₂)随压强变化关系和在p=60MPa下
(CO₂)随压强变化关系和在p=60MPa下 (CO₂)随温度变化关系如图2所示。其中代表在T=400℃下
(CO₂)随温度变化关系如图2所示。其中代表在T=400℃下 (CO₂)随压强变化关系的是
(CO₂)随压强变化关系的是________ 线(填“a”或“b”);a、b两线的交点M对应的平衡常数________ (填“相同”或“不同”)。当 (CO₂)为80%时,反应条件可能是
(CO₂)为80%时,反应条件可能是________ 。
(3)以In₂O₃作催化剂,可使CO₂在温和的条件下转化为CH₃OH,经历如下过程:
Ⅰ.催化剂活化:In₂O₃(无活性)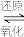 In2O3-x (有活性)
In2O3-x (有活性)
Ⅱ.CO₂和H₂在活化后的催化剂表面发生反应①,同时伴随反应②。
已知:CH₃OH选择性= 。工业生产中,会适当增大气体压强,以增大CH₃OH的选择性,其原因可能为
。工业生产中,会适当增大气体压强,以增大CH₃OH的选择性,其原因可能为 __________ ;同时将产物中的水蒸气导出,可以减少反应____________ (用化学方程式表示)的发生,达到减少催化剂失活,提高甲醇选择性的目的。
(4)温度为T℃时,在一个刚性容器中模拟工业上合成CH₃OH,往容器中通入1mol CO₂、3mol H₂,发生反应①和②,反应过程中容器内的压强随着时间变化如下表所示。
则反应开始至20 min的平均反应速率;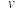 (CH₃OH)=
(CH₃OH)=__________ MPa/ min;已知平衡时CH₃OH的选择性为80%,则反应①的压强平衡常数Kp=___________ MPa-2(结果化为最简分数;压强平衡常数:用平衡分压代替平衡浓度,分压=总压×气体物质的量分数)。
①CO₂(g)+3H₂(g)
 CH₃OH(g)+H₂O(g) ΔH₁
CH₃OH(g)+H₂O(g) ΔH₁②CO₂(g)+H₂(g)
 CO(g)+H₂O(g) ΔH₂
CO(g)+H₂O(g) ΔH₂③CO(g)+2H₂(g)
 CH₃OH(g) ΔH₃
CH₃OH(g) ΔH₃回答下列问题:
(1)ΔH₃=
 的数值范围是
的数值范围是A.
 -1 B.-1~0 C.0~1 D.
-1 B.-1~0 C.0~1 D. 1
1
(2)在催化剂N表面进行反应①,当起始量
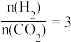 时,在不同条件下达到平衡,体系中CO₂的转化率为
时,在不同条件下达到平衡,体系中CO₂的转化率为 (CO₂),在T=400℃下
(CO₂),在T=400℃下 (CO₂)随压强变化关系和在p=60MPa下
(CO₂)随压强变化关系和在p=60MPa下 (CO₂)随温度变化关系如图2所示。其中代表在T=400℃下
(CO₂)随温度变化关系如图2所示。其中代表在T=400℃下 (CO₂)随压强变化关系的是
(CO₂)随压强变化关系的是 (CO₂)为80%时,反应条件可能是
(CO₂)为80%时,反应条件可能是(3)以In₂O₃作催化剂,可使CO₂在温和的条件下转化为CH₃OH,经历如下过程:
Ⅰ.催化剂活化:In₂O₃(无活性)
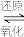 In2O3-x (有活性)
In2O3-x (有活性)Ⅱ.CO₂和H₂在活化后的催化剂表面发生反应①,同时伴随反应②。
已知:CH₃OH选择性=
 。工业生产中,会适当增大气体压强,以增大CH₃OH的选择性,其原因可能为
。工业生产中,会适当增大气体压强,以增大CH₃OH的选择性,其原因可能为 (4)温度为T℃时,在一个刚性容器中模拟工业上合成CH₃OH,往容器中通入1mol CO₂、3mol H₂,发生反应①和②,反应过程中容器内的压强随着时间变化如下表所示。
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 压强/MPa | 120 | 105 | 95 | 90 | 88 | 88 |
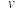 (CH₃OH)=
(CH₃OH)=
您最近一年使用:0次
名校
解题方法
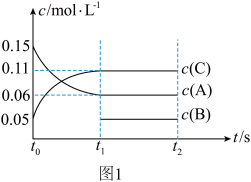
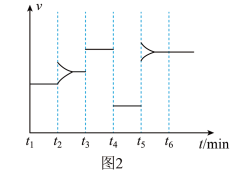
2 . 一定条件下向某密闭容器中加入 、
、 和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,
和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,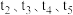 时刻各改变一种条件,且改变的条件均不同。若
时刻各改变一种条件,且改变的条件均不同。若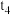 时刻改变的条件是压强,则下列说法错误的是
时刻改变的条件是压强,则下列说法错误的是
 、
、 和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,
和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系, 时刻各改变一种条件,且改变的条件均不同。若
时刻各改变一种条件,且改变的条件均不同。若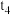 时刻改变的条件是压强,则下列说法错误的是
时刻改变的条件是压强,则下列说法错误的是

A.若 ,则前 ,则前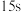 的平均反应速率 的平均反应速率 |
B.该反应的化学方程式为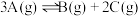 |
C.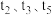 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度 |
D.B的起始物质的量为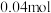 |
您最近一年使用:0次
2023-01-17更新
|
819次组卷
|
21卷引用:河南省许昌市第三中学2020-2021学年高二3月月考化学试题
河南省许昌市第三中学2020-2021学年高二3月月考化学试题河南省商丘市回民中学2022-2023学年高三上学期期末考试(线上)化学试题山西省实验中学2018届高三上学期学业质量监测化学试题黑龙江省大庆市铁人中学2018-2019学年高一下学期期末化学试题江西省吉安市遂川中学2019—2020学年高二上学期第一次月考化学试题(A)黑龙江省大庆实验中学2019-2020学年高二上学期第一次月考化学试题甘肃省天水市天水一中2019-2020学年高二(普通班)上学期第一次月考化学(理)试题天津市六校(静海一中,杨村中学,宝坻一中,大港一中等)2019-2020学年高二上学期期中联考化学试题天津市七校2019-2020学年高二上学期期中联考化学试题广东省揭阳市惠来县第一中学2019-2020学年高二上学期期中考试化学试题2020届高三化学二轮冲刺新题专练——化学反应速率的图像分析(提升练)黑龙江省鹤岗市第一中学2019-2020学年高一下学期期末考试化学试题(已下线)第17讲 化学平衡计算与图像-2021年高考化学一轮复习名师精讲练鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时2 反应条件对化学平衡的影响高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素(已下线)第二章 化学反应速率与化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)山西省运城市景胜中学2020-2021学年高二10月月考化学试题选择性必修1 专题2 第三单元 课时1 影响化学平衡的因素(已下线)6.2.2 化学平衡(第2课时 化学平衡移动)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)黑龙江省牡丹江市第三高级中学2023-2024学年高二上学期期中考试化学试题四川省广安市华蓥中学2023-2024学年高二上学期12月月考化学试题
3 . T℃时,反应物和生成物均为气体的某反应,反应过程中浓度变化如图(Ⅰ)所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
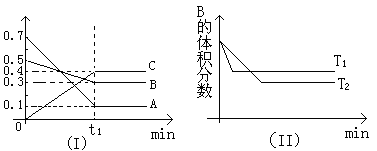

| A.在t1时间内用B表示该反应的平均速率为:0.6mol·L-1·min-1 |
| B.在(t1+10)时,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
| C.T时,在相同容器中,若由0.1mol·L-1A、0.3mol·L-1B和0.4mol·L-1C反应,达到平衡后,C的浓度仍为0.4mol·L-1 |
| D.在其他条件不变时,升高温度,正、逆反应速率均增大,且A的转化率增大 |
您最近一年使用:0次
2016-12-09更新
|
1018次组卷
|
2卷引用:河南省三门峡市2018届高三上学期期末考试化学试题
解题方法
4 . 铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)ΔH>0
2Fe(s)+3CO2(g)ΔH>0
①该反应的平衡常数表达式为:K=_____________________________
②该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11.2 g。则10 min内CO的平均反应速率为___________________________
(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是___________ 。
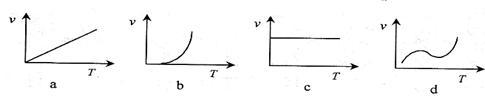
(3)Fe3+盐和Al3+盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性。但Fe3+只有在碱性介质中才能被氧化为 ,请完成下列方程式:
,请完成下列方程式:
____ Fe(OH)3 +____ ClO- + ____ ==____  +
+ ____ Cl- +___ ;
(4)若将a g Fe和Al的混合物溶于2 mol/L的足量的硫酸中,再往溶液中加入足量的6 mol/L的NaOH溶液,充分反应,过滤,洗涤,干燥灼烧,称量所得固体的质量仍为a g,则原混合物中Al的质量分数为______________ 。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)ΔH>0
2Fe(s)+3CO2(g)ΔH>0①该反应的平衡常数表达式为:K=
②该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11.2 g。则10 min内CO的平均反应速率为
(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是

(3)Fe3+盐和Al3+盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性。但Fe3+只有在碱性介质中才能被氧化为
 ,请完成下列方程式:
,请完成下列方程式: +
+ (4)若将a g Fe和Al的混合物溶于2 mol/L的足量的硫酸中,再往溶液中加入足量的6 mol/L的NaOH溶液,充分反应,过滤,洗涤,干燥灼烧,称量所得固体的质量仍为a g,则原混合物中Al的质量分数为
您最近一年使用:0次



