2024高三下·全国·专题练习
1 . 研究CO2 加氢制CH4 对资源综合利用有重要意义。相关的主要化学反应如下:
Ⅰ.CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1<0
CH4(g)+2H2O(g) ΔH1<0
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
Ⅲ.2CO(g)+2H2(g) CO2(g)+CH4(g) ΔH3=-247.1kJ· mol-1
CO2(g)+CH4(g) ΔH3=-247.1kJ· mol-1
在一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和4 mol H2发生上述反应,20 min时,容器内反应达到平衡,容器中CH4(g)为a mol,CO为b mol,以H2表示的0~20 min内平均反应速率v(H2)=________ mol·L-1·min-1(用含a、b、V的代数式表示,下同),此时H2O(g) 的浓度为________ mol·L-1,反应Ⅱ的平衡常数为________ (列出计算式)。
Ⅰ.CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH1<0
CH4(g)+2H2O(g) ΔH1<0Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2Ⅲ.2CO(g)+2H2(g)
 CO2(g)+CH4(g) ΔH3=-247.1kJ· mol-1
CO2(g)+CH4(g) ΔH3=-247.1kJ· mol-1在一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和4 mol H2发生上述反应,20 min时,容器内反应达到平衡,容器中CH4(g)为a mol,CO为b mol,以H2表示的0~20 min内平均反应速率v(H2)=
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
2 . 对于基元反应,如aA+bB cC+dD,反应速率v正=k正·ca(A)·cb(B),v逆=k逆·cc(C)·cd(D),其中k正、k逆是取决于温度的速率常数。已知:
cC+dD,反应速率v正=k正·ca(A)·cb(B),v逆=k逆·cc(C)·cd(D),其中k正、k逆是取决于温度的速率常数。已知:
反应Ⅰ:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH1=-902kJ·mol-1
4NO(g)+6H2O(g)ΔH1=-902kJ·mol-1
反应Ⅱ:8NH3(g)+6NO2(g) 7N2(g)+12H2O(g)ΔH2=-2740kJ·mol-1
7N2(g)+12H2O(g)ΔH2=-2740kJ·mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)ΔH3=+182.6kJ·mol-1
对于基元反应Ⅳ:2NO(g)+O2(g) 2NO2(g)ΔH4,在653K时,速率常数k正=2.6×103L2·mol-2·s-1,k逆=4.1×103L·mol-1·s-1
2NO2(g)ΔH4,在653K时,速率常数k正=2.6×103L2·mol-2·s-1,k逆=4.1×103L·mol-1·s-1
(1)ΔH4=______ kJ·mol-1
(2)计算653K时的平衡常数K=______ 。
(3)653K时,若NO的浓度为0.006mol·L-1,O2的浓度为0.290mol·L-1,则正反应速率为______ mol·L-1·s-1
 cC+dD,反应速率v正=k正·ca(A)·cb(B),v逆=k逆·cc(C)·cd(D),其中k正、k逆是取决于温度的速率常数。已知:
cC+dD,反应速率v正=k正·ca(A)·cb(B),v逆=k逆·cc(C)·cd(D),其中k正、k逆是取决于温度的速率常数。已知:反应Ⅰ:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g)ΔH1=-902kJ·mol-1
4NO(g)+6H2O(g)ΔH1=-902kJ·mol-1反应Ⅱ:8NH3(g)+6NO2(g)
 7N2(g)+12H2O(g)ΔH2=-2740kJ·mol-1
7N2(g)+12H2O(g)ΔH2=-2740kJ·mol-1反应Ⅲ:N2(g)+O2(g)=2NO(g)ΔH3=+182.6kJ·mol-1
对于基元反应Ⅳ:2NO(g)+O2(g)
 2NO2(g)ΔH4,在653K时,速率常数k正=2.6×103L2·mol-2·s-1,k逆=4.1×103L·mol-1·s-1
2NO2(g)ΔH4,在653K时,速率常数k正=2.6×103L2·mol-2·s-1,k逆=4.1×103L·mol-1·s-1(1)ΔH4=
(2)计算653K时的平衡常数K=
(3)653K时,若NO的浓度为0.006mol·L-1,O2的浓度为0.290mol·L-1,则正反应速率为
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
3 . 空气中CO2含量的控制和CO2资源利用具有重要意义。
(1)已知25℃、101 下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g)ΔH1=+41.2kJ·mol-1
CO(g)+H2O(g)ΔH1=+41.2kJ·mol-1
该反应的速率方程为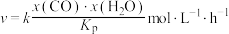 ,其中x表示相应气体的物质的量分数,
,其中x表示相应气体的物质的量分数, 为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后
为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后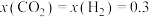 ,此时反应Ⅰ的速率
,此时反应Ⅰ的速率
______  (用含k的代数式表示)。
(用含k的代数式表示)。
(1)已知25℃、101
 下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:Ⅰ:CO2(g)+H2(g)
 CO(g)+H2O(g)ΔH1=+41.2kJ·mol-1
CO(g)+H2O(g)ΔH1=+41.2kJ·mol-1该反应的速率方程为
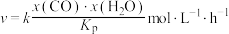 ,其中x表示相应气体的物质的量分数,
,其中x表示相应气体的物质的量分数, 为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后
为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后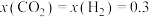 ,此时反应Ⅰ的速率
,此时反应Ⅰ的速率
 (用含k的代数式表示)。
(用含k的代数式表示)。
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
4 . H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g) ΔH>0.在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min反应达到平衡,平衡时H2O(g)的物质的量分数为0.125,用H2O(g)的浓度变化表示的反应速率v(H2O)=
COS(g)+H2O(g) ΔH>0.在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min反应达到平衡,平衡时H2O(g)的物质的量分数为0.125,用H2O(g)的浓度变化表示的反应速率v(H2O)=______ 。H2S的平衡转化率
______ %。
 COS(g)+H2O(g) ΔH>0.在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min反应达到平衡,平衡时H2O(g)的物质的量分数为0.125,用H2O(g)的浓度变化表示的反应速率v(H2O)=
COS(g)+H2O(g) ΔH>0.在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min反应达到平衡,平衡时H2O(g)的物质的量分数为0.125,用H2O(g)的浓度变化表示的反应速率v(H2O)=
您最近一年使用:0次
23-24高二上·全国·期中
解题方法
5 . 某温度下,在2 L密闭容器中进行反应:mX(g)+nY(g)⇌ pZ(g)+qQ(g),式中m、n、p、q为物质的化学计量数。在0~3 min内,各物质的物质的量变化如表所示:
已知2 min内v(Q)=0.075 mol·L-1·min-1,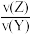 =1/2。
=1/2。
(1)试确定以下物质的相关量:起始时n(Y)=_______ ,n(Q)=_______ 。
(2)化学方程式中m=_______ ,n=_______ ,p=_______ ,q=_______ 。
(3)用Z表示2 min内的反应速率:_______ 。
(4)2 min末Q的转化率为_______ 。
物质 时间 | X | Y | Z | Q |
| 起始/mol | 0.7 | 1 | ||
| 2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3 min末/mol | 0.8 |
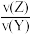 =1/2。
=1/2。(1)试确定以下物质的相关量:起始时n(Y)=
(2)化学方程式中m=
(3)用Z表示2 min内的反应速率:
(4)2 min末Q的转化率为
您最近一年使用:0次
解题方法
6 . 一定温度下,向容积为 的密闭容器中通入
的密闭容器中通入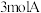 和
和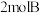 ,混合气体起始压强为
,混合气体起始压强为 。发生反应:
。发生反应: ,反应进行到
,反应进行到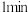 时测得剩余
时测得剩余 ,此时
,此时 的浓度为
的浓度为 。反应进行到
。反应进行到 时该容器内混合气体总压强为p,5min后反应达到平衡。
时该容器内混合气体总压强为p,5min后反应达到平衡。
(1)x为___________ 。
(2)反应在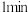 内,B的平均反应速率为
内,B的平均反应速率为___________ 。
(3)请用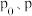 来表示
来表示 时反应物B的转化率为
时反应物B的转化率为___________ 。
(4)在四种不同的条件下测定得到以下反应速率,其中表示的反应速率最快的是___________。
 的密闭容器中通入
的密闭容器中通入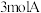 和
和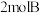 ,混合气体起始压强为
,混合气体起始压强为 。发生反应:
。发生反应: ,反应进行到
,反应进行到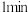 时测得剩余
时测得剩余 ,此时
,此时 的浓度为
的浓度为 。反应进行到
。反应进行到 时该容器内混合气体总压强为p,5min后反应达到平衡。
时该容器内混合气体总压强为p,5min后反应达到平衡。(1)x为
(2)反应在
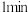 内,B的平均反应速率为
内,B的平均反应速率为(3)请用
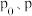 来表示
来表示 时反应物B的转化率为
时反应物B的转化率为(4)在四种不同的条件下测定得到以下反应速率,其中表示的反应速率最快的是___________。
A. | B.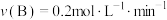 |
C. | D.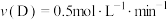 |
您最近一年使用:0次
解题方法
7 . 无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)⇌2NO2(g) ΔH=+24.4 kJ·mol-1。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为_______ (以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=_______ kPa·s-1。
您最近一年使用:0次
解题方法
8 . 已知2N2O5(g)=2N2O4(g)+O2(g),起始时N2O5(g)为35.8 kPa,分解的反应速率v=2×10-3×pN2O5(kPa·min-1)。t=62 min时,测得体系中pO2=2.9 kPa,则此时的pN2O5=_______ kPa,v=_______ kPa·min-1。
您最近一年使用:0次
9 . 某温度下,真空恒容密闭容器中发生反应:2NO2⇌2NO+O2,经过4min后,测得混合气中NO2浓度为0.12mol·L-1,O2的浓度为0.24mol·L-1,且各物质的浓度不再发生变化。求:
(1)NO2的起始浓度为___________ 。
(2)4min时NO2的转化率为___________ 。
(3)4min内生成NO的化学反应速率为___________ 。
(4)4min时NO的体积分数是___________ 。
(5)4min时容器的压强是开始时的___________ 倍。
(1)NO2的起始浓度为
(2)4min时NO2的转化率为
(3)4min内生成NO的化学反应速率为
(4)4min时NO的体积分数是
(5)4min时容器的压强是开始时的
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
10 . Bodensteins研究了下列反应:2HI(g)  H2(g)+I2(g),在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g),在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为___________ (以K和k正表示)。若k正=0.0027 min-1,在t=40 min时,v正=___________ min-1。
 H2(g)+I2(g),在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g),在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
您最近一年使用:0次



