名校
1 . 用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计对比实验探究温度、浓度、pH对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是
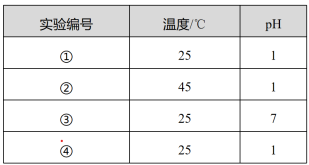


| A.实验①在15 min内M的降解速率约为1.33×10-5mol·L-1·min-1 |
| B.若其他条件相同,实验①②说明升高温度,M降解速率增大 |
| C.若其他条件相同,实验①③证明pH越高,越不利于M的降解 |
| D.实验④说明M的起始浓度越小,降解的速率越快 |
您最近一年使用:0次
2023-05-16更新
|
316次组卷
|
2卷引用:四川省泸县第五中学2022-2023学年高一下学期6月期末考试化学试题
21-22高二上·全国·期中
名校
解题方法
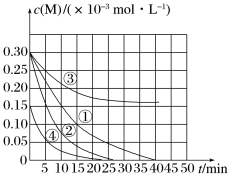
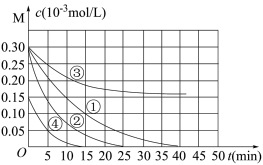
2 . 用Na2FeO4 溶液氧化废水中的还原性污染物 M,为研究降解效果。设计如下对比实验探究温度、浓度、pH 对降解速率和效果的影响,实验测得 M 的浓度与时间关系如图所示,下列说法错误的是

| 实验编号 | 温度℃ | pH |
| ① | 25 | 1 |
| ② | 45 | 1 |
| ③ | 25 | 7 |
| ④ | 25 | 1 |
| A.实验①在 15min 内 M 的降解速率为 1.33×10-5mol/(L·min) |
| B.实验①②说明升高温度,M 降解速率增大 |
| C.实验①③证明 pH 越高,越不利于 M 的降解 |
| D.实验②④说明 M 的浓度越小,降解的速率越慢 |
您最近一年使用:0次
2021-11-07更新
|
238次组卷
|
5卷引用:四川省成都市天府新区2021-2022学年高一下学期期末考试化学试题
四川省成都市天府新区2021-2022学年高一下学期期末考试化学试题(已下线)必考点02 化学反应速率-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)北京理工大学附属中学2021-2022学年高二上学期期中练习化学试题河南省郑州市第十九高级中学2022-2023学年高二上学期开学文理分科考试化学试题山西省晋中市平遥县第二中学校2021-2022学年高二上学期期中考试化学试题
名校
3 . 某研究性学习小组利用 溶液和酸性
溶液和酸性 溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
(1)通过实验_______ (填实验序号)可探究出温度变化对化学反应速率的影响,其中
_______ 。
(2)已知反应后 转化为
转化为 逸出,
逸出, 转化为
转化为 ,每消耗
,每消耗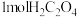 转移
转移_______ mol电子。
(3)若 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是_______ 。忽略溶液体积的变化,利用实验B中0~8s内,用 的浓度变化表示的反应速率
的浓度变化表示的反应速率
_______ 。
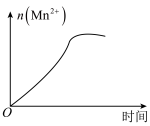
(4)该小组的一位同学通过查阅资料发现,上述实验过程中 随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对
随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对 与草酸之间的反应有某种特殊作用,则该作用是
与草酸之间的反应有某种特殊作用,则该作用是_______ 。设计实验证明,分别取等体积等浓度的 和
和 混合,平均分成两份,一份中不加任何试剂,一份加入少量
混合,平均分成两份,一份中不加任何试剂,一份加入少量 固体,观察到两溶液都没有褪色,原因是:
固体,观察到两溶液都没有褪色,原因是:_______ 。
 溶液和酸性
溶液和酸性 溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:| 实验序号 | 实验温度/K | 溶液颜色褪至无色所需时间/s | |||||
酸性 溶液 溶液 |  溶液 溶液 |  | |||||
 |  | 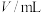 | 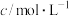 | 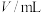 | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 |  |
| B | T | 2 | 0.02 | 3 | 0.1 |  | 8 |
| C | 313 | 2 | 0.02 |  | 0.1 | 1 |  |
(1)通过实验

(2)已知反应后
 转化为
转化为 逸出,
逸出, 转化为
转化为 ,每消耗
,每消耗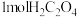 转移
转移(3)若
 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是 的浓度变化表示的反应速率
的浓度变化表示的反应速率
(4)该小组的一位同学通过查阅资料发现,上述实验过程中
 随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对
随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对 与草酸之间的反应有某种特殊作用,则该作用是
与草酸之间的反应有某种特殊作用,则该作用是 和
和 混合,平均分成两份,一份中不加任何试剂,一份加入少量
混合,平均分成两份,一份中不加任何试剂,一份加入少量 固体,观察到两溶液都没有褪色,原因是:
固体,观察到两溶液都没有褪色,原因是:
您最近一年使用:0次
名校
4 . 某学习小组利用5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O来探究“外界条件对化学反应速率的影响”。实验时,先分别量取KMnO4酸性溶液、H2C2O4(一种弱酸)溶液,然后倒入大试管中迅速振荡,通过测定褪色所需时间来判断反应的快慢。
(1)下列因素能加快该反应速率的是___________。
(2)为了观察到紫色褪去,如果H2C2O4与KMnO4溶液的体积相同,则它们初始物质的量浓度需要满足的关系为:c(H2C2O4):c(KMnO4)___________ 。
(3)甲同学设计了如下实验
①探究温度对化学反应速率影响的组合实验编号是___________ 。
②已知b实验生成CO2体积随时间的变化曲线如图,请在图中画出a实验生成CO2体积随时间的变化曲线。___________

③实验b测得混合后溶液褪色的时间为30s,忽略混合前后体积的微小变化,则这段时间平均反应速率v(H2C2O4)=___________ (保留3位有效数字)。
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
①乙同学据此提出以下假设:
假设1:___________ 。
假设2:生成Mn2+对反应有催化作用
假设3:生成CO2对反应有催化作用
假设4:反应生成的K+或 该反应有催化作用
该反应有催化作用
丙同学认为假设4不合理,其理由是___________ 。
②丁同学用如下实验证明假设2成立:在A和B二试管中分别加入4mL0.2mol·L-1草酸溶液,再在A试管中加入lmL0.1mol·L-1MnSO4溶液、B试管中加入___________ mL蒸馏水,然后在两支试管中同时分别加入1mL0.1mol·L-1KMnO4酸性溶液。预期的实验现象是___________ 。在B试管中加入蒸馏水的目的是___________ 。同学们认为不宜用MnCl2溶液代替MnSO4溶液对该反应进行催化探究,其原因是(用离子方程式表示)___________ 。
(1)下列因素能加快该反应速率的是___________。
| A.加入少量K2SO4固体 | B.加入少量NaCl固体 |
| C.增大压强 | D.加入少量Na2C2O4固体 |
(2)为了观察到紫色褪去,如果H2C2O4与KMnO4溶液的体积相同,则它们初始物质的量浓度需要满足的关系为:c(H2C2O4):c(KMnO4)
(3)甲同学设计了如下实验
| 实验 编号 | H2C2O4溶液 | KMnO4溶液 | 温度/℃ | 褪色时间/s | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | |||
| a | 0.10 | 2.0 | 0.010 | 4.0 | 25 | t1 |
| b | 0.20 | 2.0 | 0.010 | 4.0 | 25 | t2 |
| c | 0.20 | 2.0 | 0.010 | 4.0 | 50 | t3 |
②已知b实验生成CO2体积随时间的变化曲线如图,请在图中画出a实验生成CO2体积随时间的变化曲线。

③实验b测得混合后溶液褪色的时间为30s,忽略混合前后体积的微小变化,则这段时间平均反应速率v(H2C2O4)=
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
①乙同学据此提出以下假设:
假设1:
假设2:生成Mn2+对反应有催化作用
假设3:生成CO2对反应有催化作用
假设4:反应生成的K+或
 该反应有催化作用
该反应有催化作用丙同学认为假设4不合理,其理由是
②丁同学用如下实验证明假设2成立:在A和B二试管中分别加入4mL0.2mol·L-1草酸溶液,再在A试管中加入lmL0.1mol·L-1MnSO4溶液、B试管中加入
您最近一年使用:0次
5 . 同学们测定和探究影响反应速率的因素,设计了如下系列实验。
Ⅰ.甲同学测定室温下 溶液与用硫酸酸化的
溶液与用硫酸酸化的 溶液的反应速率。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时。该小组设计了如下的方案。
溶液的反应速率。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时。该小组设计了如下的方案。
(1)写出 与
与 反应的离子反应方程式:
反应的离子反应方程式:__________________
(2)实验测得酸性 溶液褪色所用的时间为10s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
溶液褪色所用的时间为10s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率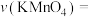
______
(3)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应较慢,溶液变色不明显;但不久突然褪色,反应明显加快。某同学认为是反应放热导致溶液温度升高所致,重做B组实验,测定反应过程中不同时间溶液的温度,结果如表:
①结合实验目的与表中数据,你得出的结论是______
②从影响化学反应速率的因素看,你认为还可能是______ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是______ (填字母)。
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
Ⅱ.乙同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
(4)该实验①、②可探究______ 对反应速率的影响,因此 和
和 分别是
分别是______ 、______ 。实验①、③可探究硫酸浓度对反应速率的影响,因此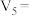
______ 。
(5)已知硫代硫酸钠与稀硫酸反应生产S和 ,请写出反应的离子方程式:
,请写出反应的离子方程式:_______________ 。
Ⅰ.甲同学测定室温下
 溶液与用硫酸酸化的
溶液与用硫酸酸化的 溶液的反应速率。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时。该小组设计了如下的方案。
溶液的反应速率。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时。该小组设计了如下的方案。
| 酸性 | ||
浓度/ | 体积/mL | 浓度/ | 体积/mL |
5.0 | 6.0 | 2.0 | 4.0 |
 与
与 反应的离子反应方程式:
反应的离子反应方程式:(2)实验测得酸性
 溶液褪色所用的时间为10s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
溶液褪色所用的时间为10s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率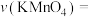
(3)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应较慢,溶液变色不明显;但不久突然褪色,反应明显加快。某同学认为是反应放热导致溶液温度升高所致,重做B组实验,测定反应过程中不同时间溶液的温度,结果如表:
时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
温度/℃ | 20 | 21 | 21 | 21.5 | 22 | 22 |
②从影响化学反应速率的因素看,你认为还可能是
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
Ⅱ.乙同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度/℃ |
| 稀硫酸 |
| ||
V/mL | c(mol/L) | V/mL | c(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 |
| 0.10 |
| 0.50 |
|
③ | 20 |
| 0.10 | 4.0 | 0.50 |
|
 和
和 分别是
分别是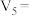
(5)已知硫代硫酸钠与稀硫酸反应生产S和
 ,请写出反应的离子方程式:
,请写出反应的离子方程式:
您最近一年使用:0次
名校
6 . 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下,回答下列问题:
(1)通过实验A、B,可探究___________ 的改变对反应速率的影响,其中
___________ ,T1=___________ ;通过实验___________ (填序号)可探究出温度变化对化学反应速率的影响。
(2)利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___________ 。(保留2位有效数字)
(3)写出该反应的离子方程式___________ 。
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应较慢,溶液变色不明显;但不久突然褪色,反应明显加快。某同学认为是反应放热导致溶液温度升高所致,重做B组实验,测定反应过程中不同时间溶液的温度,结果如表:
①结合实验目的与表中数据,你得出的结论是___________ 。
②从影响化学反应速率的因素看,你认为还可能是___________ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是___________ (填字母)。
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
| 实验序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol/L | V/mL | c/mol/L | V/mL | |||
| A | 293 | 20 | 0.2 | 40 | 1 | 0 | t1 |
| B | T1 | 20 | 0.2 | 30 | 1 | V1 | 8 |
| C | 313 | 20 | 0.2 | V2 | 1 | 0 | t2 |

(2)利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=
(3)写出该反应的离子方程式
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应较慢,溶液变色不明显;但不久突然褪色,反应明显加快。某同学认为是反应放热导致溶液温度升高所致,重做B组实验,测定反应过程中不同时间溶液的温度,结果如表:
| 时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
| 温度/℃ | 20 | 21 | 21 | 21.5 | 22 | 22 |
②从影响化学反应速率的因素看,你认为还可能是
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
您最近一年使用:0次
2023-10-30更新
|
246次组卷
|
2卷引用:四川省内江市第二中学2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
7 . 南山中学高二某班同学为了探究影响化学反应速率的外界因素,进行以下实验:实验一:向 稀硫酸中加入过量的锌粉,标准状况下测得数据累积值如下:
稀硫酸中加入过量的锌粉,标准状况下测得数据累积值如下:
(1)在0~1、1~2、2~3、3~4、4~5min各时间段中:反应速率最快的时间段是______  ,主要的原因可能是
,主要的原因可能是______ 。
(2)为了减缓反应速率但不减少产生氢气的量,可以在稀硫酸中加入______。
实验二:通过测定酸性 溶液褪色所需的时间探究浓度对反应速率的影响,某组同学在室温下完成以下实验:
溶液褪色所需的时间探究浓度对反应速率的影响,某组同学在室温下完成以下实验:
(3)该实验所涉及反应的离子方程式为______ 。
(4)
______ ,对比实验发现浓度对化学反应速率有何影响?请结合碰撞理论解释______ 。
(5)2号实验中,用 表示的反应速率为
表示的反应速率为______ 。(假设反应前后溶液的总体积不变)。
(6)在实验中发现开始一段时间反应速率较慢,溶液褪色不明显:但不久突然褪色,反应速率明显加快。从影响化学反应速率的因素看,你认为还可能是的______ 影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要试剂最合理的是______ 。(填字母)。
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
 稀硫酸中加入过量的锌粉,标准状况下测得数据累积值如下:
稀硫酸中加入过量的锌粉,标准状况下测得数据累积值如下:时间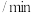 | 1 | 2 | 3 | 4 | 5 |
| 氢气体积 | 50 | 120 | 232 | 290 | 310 |
 ,主要的原因可能是
,主要的原因可能是(2)为了减缓反应速率但不减少产生氢气的量,可以在稀硫酸中加入______。
A. 溶液 溶液 | B. 溶液 溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
实验二:通过测定酸性
 溶液褪色所需的时间探究浓度对反应速率的影响,某组同学在室温下完成以下实验:
溶液褪色所需的时间探究浓度对反应速率的影响,某组同学在室温下完成以下实验:| 实验编号 | 1 | 2 | 3 | 4 |
水 | 10 | 5 | 0 |  |
 溶液 溶液 | 5 | 10 | 10 | 5 |
 溶液 溶液 | 5 | 5 | 10 | 10 |
时间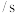 | 40 | 20 | 10 | — |
(4)

(5)2号实验中,用
 表示的反应速率为
表示的反应速率为(6)在实验中发现开始一段时间反应速率较慢,溶液褪色不明显:但不久突然褪色,反应速率明显加快。从影响化学反应速率的因素看,你认为还可能是的
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
您最近一年使用:0次
名校
8 . 某学习小组为了探究影响高锰酸钾酸性溶液与NaHSO3溶液反应速率的因素,该小组设计如表实验方案。
下列说法正确的是
| 实验 | V(NaHSO3)/mL c=0.1 mol/L | V(KMnO4)/mL c=0.6 mol/L | V(H2SO4)/mL c=0.1 mol/L | V(MnSO4)/mL c=0.1 mol/L | V(H2O)/mL | 褪色时间t/min |
| 1 | 3.0 | 2.0 | 1.0 | 0.0 | 2.0 | 8 |
| 2 | 3.0 | 2.0 | 2.0 | 0.0 | a | 6 |
| 3 | 4.0 | 2.0 | 2.0 | 0.0 | 0.0 | 4 |
| 4 | 4.0 | 2.0 | 1.0 | 0.5 | b | 3 |
A.该反应的离子方程式为:5 +2 +2 +6H+=2Mn2++5 +6H+=2Mn2++5 +3H2O +3H2O |
| B.a=1.0,b=0.5 |
C.实验3从反应开始到反应结束这段时间内反应速率v( )=0.025 mol/(L∙min) )=0.025 mol/(L∙min) |
D.实验证明 可能是该反应的催化剂 可能是该反应的催化剂 |
您最近一年使用:0次
2023-04-25更新
|
363次组卷
|
14卷引用:四川省射洪中学2022—2023学年高一下学期(强基班)第三次月考化学试题
四川省射洪中学2022—2023学年高一下学期(强基班)第三次月考化学试题四川省射洪中学校强基班2023-2024学年高一下学期4月第一次月考化学试题山西省吕梁市临县第一中学2021-2022学年高一下学期5月月考化学试题广西玉林市普通高中2021-2022学年高一下学期期末考试化学试题河南省开封市五县2021-2022学年高二下学期期末考试化学试题(已下线)2.1.2 影响化学反应速率的因素 活化能 -2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)重庆市西南大学附属中学校2021-2022学年高一下学期期末考试化学试题(已下线)化学反应速率与化学平衡——课时2化学反应速率的影响因素(已下线)【2023】【高一下】【其他】【余高2】【高中化学】【刘尼尼收集】新疆生产建设兵团第一师高级中学2022-2023学年高一下学期4月月考化学试题贵州省遵义市仁怀市高中教育联盟2022-2023学年高一下学期5月期中考试化学试题(已下线)第05练 化学反应的速率与限度-2023年【暑假分层作业】高一化学(人教版2019必修第二册)山东省东营市利津县高级中学2022-2023学年高一下学期5月月考化学试题 (已下线)清单04 化学反应的速率和限度(考点清单)(讲+练)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)
名校
解题方法
9 . 实验室利用下列方案探究影响化学反应速率的因素,实验时,分别量取 溶液和酸性
溶液和酸性 溶液,迅速混合并开始计时,通过测定
溶液,迅速混合并开始计时,通过测定 溶液褪色时间来判断反应的快慢。请回答相关问题:
溶液褪色时间来判断反应的快慢。请回答相关问题:
(1)该反应的离子方程式为___________ 。
(2)实验①、②、③所加 溶液均要过量,理由是
溶液均要过量,理由是___________ 。
(3)实验①和实验②是探究___________ 对化学反应速率的影响。
(4)实验②测得反应所用的时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=___________ 。
(5)实验①和②起初反应均很慢,过了一会儿速率突然增大,可能原因是___________ 。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的___________ (填字母)。
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
 溶液和酸性
溶液和酸性 溶液,迅速混合并开始计时,通过测定
溶液,迅速混合并开始计时,通过测定 溶液褪色时间来判断反应的快慢。请回答相关问题:
溶液褪色时间来判断反应的快慢。请回答相关问题:| 编号 | 温度/℃ |  溶液 溶液 | 酸性 溶液 溶液 | ||
浓度/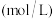 | 体积/ | 浓度/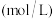 | 体积/ | ||
| ① | 25 | 0.10 | 2.0 | 0.010 | 4.0 |
| ② | 25 | 0.20 | 2.0 | 0.010 | 4.0 |
| ③ | 50 | 0.20 | 2.0 | 0.010 | 4.0 |
(2)实验①、②、③所加
 溶液均要过量,理由是
溶液均要过量,理由是(3)实验①和实验②是探究
(4)实验②测得反应所用的时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=
(5)实验①和②起初反应均很慢,过了一会儿速率突然增大,可能原因是
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
您最近一年使用:0次
2023-10-07更新
|
30次组卷
|
2卷引用:四川省绵阳南山中学实验学校2023-2024学年高二上学期9月月考化学试题
名校
10 . 恒温恒容,4A(s)+3B(g) 2C(g)+D(g)经2min,B的浓度减少0.6mol•L-1,下列说法正确的是
2C(g)+D(g)经2min,B的浓度减少0.6mol•L-1,下列说法正确的是
 2C(g)+D(g)经2min,B的浓度减少0.6mol•L-1,下列说法正确的是
2C(g)+D(g)经2min,B的浓度减少0.6mol•L-1,下列说法正确的是| A.用A表示的反应速率是0.4mol•L-1•min-1 |
| B.气体的密度不再变化,则证明反应已经达到平衡状态 |
| C.2min末的反应速率v(B)=0.3mol•L-1•min-1 |
| D.分别用B、C表示反应的速率,其关系是:3v(B)=2v(C) |
您最近一年使用:0次
2023-04-22更新
|
281次组卷
|
2卷引用:四川省巴中市恩阳区2022-2023学年高二上学期1月期末化学试题


 浓度
浓度