1 . 纳米氧化锌具有颗粒微小,比表面积大,分散性好,疏松多孔等物理特性和极强的化学活性,目前已广泛用于橡胶、陶瓷、催化剂、涂料和磁性材料的辅助生产。以铜转炉烟灰为原料,采用浸取、均相沉淀、干燥煅烧等工艺制备纳米氧化锌的工艺方法过程简单,生产成本低。具体流程如下:
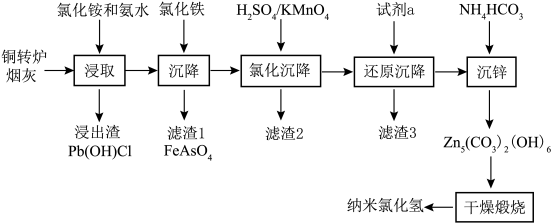
已知某铜转炉烟灰化学成分百分含量分析如下表:
铜转炉烟灰主要化学成分分析结果 %
以上金属元素在铜转炉烟灰中均以硫酸盐和氧化物形式存在,砷以砷酸盐形式存在。
流程中涉及离子的氢氧化物溶度积常数如下表:
请回答下列问题:
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃ ,浸出率随温度升高而降低的原因可能是___________ ;
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___________ 。
(3)在“沉降”过程中,FeCl3做沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是___________ ,缩短沉降时间;
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5 ,使还原产物为MnO2,滤渣2主要成分为___________ ;
(5)“还原沉降”选用的“试剂a”为___________ (填化学式);
(6)“沉锌”反应的离子方程式为___________ ,整个流程中可以循环利用的副产品是___________ (填化学式);
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整 和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,
和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,  的浓度为
的浓度为___________ 沉淀物的粒径最佳。

已知某铜转炉烟灰化学成分百分含量分析如下表:
铜转炉烟灰主要化学成分分析结果 %
| Cu | Zn | Pb | Fe( Ⅱ) | As |
| 10.30 | 8.75 | 19.07 | 2.51 | 4.68 |
流程中涉及离子的氢氧化物溶度积常数如下表:
| 离子 | Cu2+ | Zn2+ | Fe2+ | Fe3+ |
| Ksp | 2.2× 10-20 | 6.7×10-17 | 8.0×10-16 | 4.0×10-38 |
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃ ,浸出率随温度升高而降低的原因可能是
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为
(3)在“沉降”过程中,FeCl3做沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5 ,使还原产物为MnO2,滤渣2主要成分为
(5)“还原沉降”选用的“试剂a”为
(6)“沉锌”反应的离子方程式为
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整
 和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,
和Zn2+的浓度,以保证最终沉淀物粒径在1um 以下,通过下表可判断,当Zn2+的浓度恒定在0.8 mol·L-1时,  的浓度为
的浓度为n( )/n(Zn2+) )/n(Zn2+) | 粒度分布质量分数1% | ||||
| 0.0-0.1um | 0.1~0.5um | 0.5~1.0um | 1.0~5.0um | 5.0um以上 | |
| 2 | 25.3 | 38.41 | 34.55 | 1.74 | 0.001 |
| 2.5 | 40.82 | 50.35 | 8.37 | 0.46 | 0.001 |
| 3 | 35.2 | 55.37 | 8.2 | 1.23 | 0.001 |
您最近一年使用:0次
2023-04-29更新
|
213次组卷
|
2卷引用:四川省宜宾市叙州区第二中学校2023-2024学年高三上学期10月月考理综化学试题
名校
2 . 向体积为2 L的固定密闭容器中通入2mol X气体,在一定温度下发生如下反应:2X(g)  Y(g)+3Z(g)ΔH=+92.0kJ· mol-1。经5 min 后反应达到平衡,此时测得容器内的压强为起始时的1.5倍。
Y(g)+3Z(g)ΔH=+92.0kJ· mol-1。经5 min 后反应达到平衡,此时测得容器内的压强为起始时的1.5倍。
(1)用Y表示的化学反应速率为_____ ,X的转化率为______ ,平衡时反应吸收的热量为_________ 。
(2)在定温,定容的条件下向平衡体系中再充入1mol X(g)气体,平衡______ (填“正向”“不”“逆向”)移动, X(g)的转化率______ (填“增大”“减小”“不变”),Y(g)的质量分数______ (填“增大”“减小”“不变”)。
(3)在相同温度,相同容积的密闭容器中起始时充入0.8molX(g),0.6molY(g),1.8molZ(g),此时V正______ V逆(填“大于”、“小于”或“等于”);平衡时X(g)的百分含量______ (填“大于”、“小于”或“等于”)原平衡。
 Y(g)+3Z(g)ΔH=+92.0kJ· mol-1。经5 min 后反应达到平衡,此时测得容器内的压强为起始时的1.5倍。
Y(g)+3Z(g)ΔH=+92.0kJ· mol-1。经5 min 后反应达到平衡,此时测得容器内的压强为起始时的1.5倍。(1)用Y表示的化学反应速率为
(2)在定温,定容的条件下向平衡体系中再充入1mol X(g)气体,平衡
(3)在相同温度,相同容积的密闭容器中起始时充入0.8molX(g),0.6molY(g),1.8molZ(g),此时V正
您最近一年使用:0次
3 . 回答下列问题
(1)下列各种说法或表述正确的是_________ 。(填序号)
①石油、煤、天然气、可燃冰、植物油都属于化石燃料。
②开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放
③利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法
④淀粉、纤维素、蛋白质、油脂均属于天然有机高分子化合物
⑤CH3—CH=CH—C≡C—CH3分子中所有碳原子一定在同一平面上
⑥ 的二氯代物有12种
的二氯代物有12种
(2)有机物由碳、氢、氧、氮四种元素组成,其中含碳32%,氢6.7%,氧43%(均为质量分数)。该有机物的相对分子质量为75,其分子式为_________ 。若该有机物是蛋白质水解的产物,它与乙醇反应生成的酯可用于合成医药和农药,写出生成该酯的化学方程式__________________ 。
(3)甲醇是一种基础有机化工原料,广泛应用于有机合成、医药、农药、染料、高分子等化工生产领域。利用二氧化碳合成甲醇,能有效降低二氧化碳排放量,为甲醇合成提供了一条绿色合成的新途径。工业上利用该反应合成甲醇。已知:25℃,101KPa下:
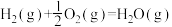 ΔH1=-242kJ·mol-1
ΔH1=-242kJ·mol-1
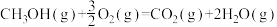 ΔH2=-676kJ·mol-1
ΔH2=-676kJ·mol-1
①写出CO2和H2生成气态甲醇等产物的热化学方程式__________________ 。
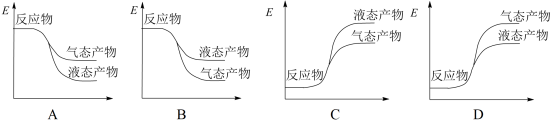
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是_________ (填字母序号)。
③某兴趣小组对该反应进行了实验探究。在一定温度和催化剂条件下,将1molCO2和3molH2通入2L密闭容器中进行反应(此时容器内总压强为200kPa),反应物和产物的分压随时间的变化曲线如图所示。
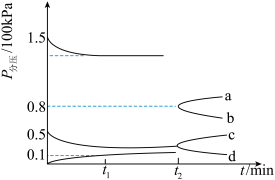
若保持容器体积不变,t1时反应达到平衡,测得H2的体积分数为 ,此时用H2压强表示0-t1时间内的反应速率v(H2)=
,此时用H2压强表示0-t1时间内的反应速率v(H2)=_________ kPa·min-1。
(1)下列各种说法或表述正确的是
①石油、煤、天然气、可燃冰、植物油都属于化石燃料。
②开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放
③利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法
④淀粉、纤维素、蛋白质、油脂均属于天然有机高分子化合物
⑤CH3—CH=CH—C≡C—CH3分子中所有碳原子一定在同一平面上
⑥
 的二氯代物有12种
的二氯代物有12种(2)有机物由碳、氢、氧、氮四种元素组成,其中含碳32%,氢6.7%,氧43%(均为质量分数)。该有机物的相对分子质量为75,其分子式为
(3)甲醇是一种基础有机化工原料,广泛应用于有机合成、医药、农药、染料、高分子等化工生产领域。利用二氧化碳合成甲醇,能有效降低二氧化碳排放量,为甲醇合成提供了一条绿色合成的新途径。工业上利用该反应合成甲醇。已知:25℃,101KPa下:
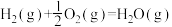 ΔH1=-242kJ·mol-1
ΔH1=-242kJ·mol-1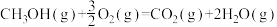 ΔH2=-676kJ·mol-1
ΔH2=-676kJ·mol-1①写出CO2和H2生成气态甲醇等产物的热化学方程式
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是

③某兴趣小组对该反应进行了实验探究。在一定温度和催化剂条件下,将1molCO2和3molH2通入2L密闭容器中进行反应(此时容器内总压强为200kPa),反应物和产物的分压随时间的变化曲线如图所示。

若保持容器体积不变,t1时反应达到平衡,测得H2的体积分数为
 ,此时用H2压强表示0-t1时间内的反应速率v(H2)=
,此时用H2压强表示0-t1时间内的反应速率v(H2)=
您最近一年使用:0次
名校
解题方法
4 . 一定温度下,向0.5 L的密闭容器中通入两种气体反应物,反应中各气体的物质的量变化如图所示。回答下列问题:

(1)写出容器中发生的化学反应方程式___________ (用图中字母表示)。
(2)0~1 s内,以B的浓度表示反应的平均速率ʋ(B) =___________ mol·L−1·s−1,1~5 s内,以B的浓度表示反应的平均速率为ʋ′(B),由图可知ʋ(B)___________ ʋ′(B)(填“>”“<”或“=”),其原因是___________ 。
(3)当可逆反应达到平衡时,C的转化率为___________ 。
(4)容器内初始压强用p(初)表示,平衡时压强用p(平)表示,则p(平):p(初) =___________ 。
(5)某条件下可逆反应达平衡后,降低温度,逆反应速率___________ (填“增大”“减小”或“不变”),下列情况能说明容器内可逆反应再次达到化学平衡的是___________ (填标号)。
A.ʋ(B)正 = ʋ(A)逆
B.气体B的质量分数不再改变
C.容器气体总质量不再改变
D.气体D的物质的量浓度不再改变

(1)写出容器中发生的化学反应方程式
(2)0~1 s内,以B的浓度表示反应的平均速率ʋ(B) =
(3)当可逆反应达到平衡时,C的转化率为
(4)容器内初始压强用p(初)表示,平衡时压强用p(平)表示,则p(平):p(初) =
(5)某条件下可逆反应达平衡后,降低温度,逆反应速率
A.ʋ(B)正 = ʋ(A)逆
B.气体B的质量分数不再改变
C.容器气体总质量不再改变
D.气体D的物质的量浓度不再改变
您最近一年使用:0次
2023-04-29更新
|
295次组卷
|
2卷引用:四川省成都市蓉城名校联盟2022-2023学年高一下学期期中联考化学试题
5 . 将不同量的H2O(g)和CO气体分别通入到1L的恒容密闭容器中进行反应: 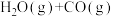

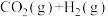 ;得到以下三组数据,据此回答下列问题:
;得到以下三组数据,据此回答下列问题:
(1)①由以上数据计算,0~5min内实验1中以 表示的反应速率为
表示的反应速率为___________ 。
②该反应在650℃时平衡常数数值为___________ ,该反应的逆反应为___________ (填“吸” 或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是___________ 。
(2)图1、2 表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的情况:
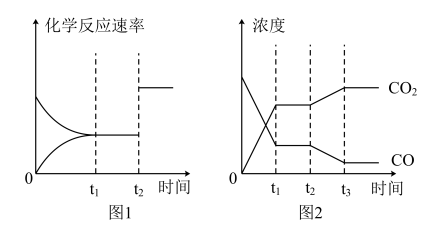
①图1中时刻t2发生改变的条件可能是___________ (写2条)。
②图2中时刻t2发生改变的条件可能是___________ (写2条)。
(3)在850℃时,其平衡常数K=1,相同温度下,在该容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2,5.0mol H2,此时反应向___________ (填“正反应” 或“逆反应”)方向进行,平衡时CO2的物质的量为___________ 。

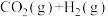 ;得到以下三组数据,据此回答下列问题:
;得到以下三组数据,据此回答下列问题:实验 | 温度 | 起始量 | 平衡量 | 达到平衡所需时间 | ||
H2O | CO |
| CO | |||
1 | 650℃ | 1mol | 2mol | 0.8mol | 1.2mol | 5min |
2 | 900℃ | 0.5mol | 1mol | 0.2mol | 0.8mol | 3min |
3 | 900℃ | a | b | c | d | t |
(1)①由以上数据计算,0~5min内实验1中以
 表示的反应速率为
表示的反应速率为②该反应在650℃时平衡常数数值为
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是
(2)图1、2 表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的情况:

①图1中时刻t2发生改变的条件可能是
②图2中时刻t2发生改变的条件可能是
(3)在850℃时,其平衡常数K=1,相同温度下,在该容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2,5.0mol H2,此时反应向
您最近一年使用:0次
名校
6 . T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图-1所示;若保持其他条件不变,温度分别为T1和T2,Y的体积百分含量与时间的关系如图-2所示。下列分析正确的是
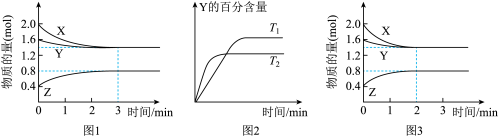

A.容器中发生的反应可表示为:2X(g)+Y(g) 2Z(g) 2Z(g) |
B.0~3 min内, (X)=0.2 mol•L-1•min-1 (X)=0.2 mol•L-1•min-1 |
C.其他条件不变升高温度, 正、 正、 逆都增大,且重新平衡前 逆都增大,且重新平衡前 正> 正> 逆 逆 |
| D.若改变条件,使反应进程如图-3所示,则改变的条件可能是增大压强 |
您最近一年使用:0次
名校
7 . 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。
(1)该反应的化学方程式为___________ 。
(2)反应开始至2min,以气体Z表示的平均反应速率为___________ 。1min时,正反应速率___________ (填“>”“<”或“=”)逆反应速率。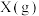 的平衡转化率为
的平衡转化率为___________ 。
(3)恒温恒容条件下,能说明该反应达到化学平衡状态的标志是___________。
①混合气体的压强不再变化
②混合气体的密度不再变化
③X的百分含量不再变化
④混合气体的平均相对分子质量不再变化
⑤v(X):v(Y)=3:1
(4)反应开始至2min末,以气体X表示的平均反应速率为___________ ;反应开始时与反应达平衡状态时的压强之比为___________ 。
(1)该反应的化学方程式为
(2)反应开始至2min,以气体Z表示的平均反应速率为
 的平衡转化率为
的平衡转化率为(3)恒温恒容条件下,能说明该反应达到化学平衡状态的标志是___________。
①混合气体的压强不再变化
②混合气体的密度不再变化
③X的百分含量不再变化
④混合气体的平均相对分子质量不再变化
⑤v(X):v(Y)=3:1
| A.①②⑤ | B.①③④ | C.②③④ | D.③④⑤ |
(4)反应开始至2min末,以气体X表示的平均反应速率为
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题。
(1)请根据下列信息判断氢气燃烧生成水蒸气时热量变化。
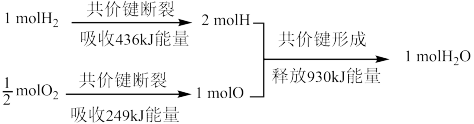
生成1mol水释放的能量___________ kJ。
(2)2SO2(g)+O2(g) 2SO3(g),是工业制硫酸的主要反应之一、某条件下,在2 L恒容容器中投入2 mol SO2和1 mol O2,如图是反应体系中部分物质的物质的量随时间的变化曲线。
2SO3(g),是工业制硫酸的主要反应之一、某条件下,在2 L恒容容器中投入2 mol SO2和1 mol O2,如图是反应体系中部分物质的物质的量随时间的变化曲线。
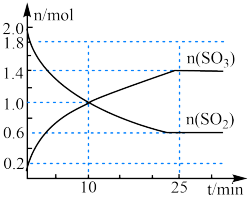
①0到10 min内, v(O2)=___________ 。
②下列情况能说明该反应达到化学平衡状态的是___________ (填字母)。
A. n(SO2) = n(SO3) B. v正 (SO2)=v逆 (SO2)
C. O2的含量保持不变 D.SO2、O2、SO3的浓度之比为2:1:2
③在密闭容器里,通入a mol SO2 (g)、b mol O2 (g)、c mol SO3 (g),发生上述反应,当改变某种条件时,反应速率会减小的是___________ (填字母)。
A.降低温度 B.加入催化剂
C.增大容器体积 D.恒容下,充入He
④工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7%,O2:11%,N2:82%):
化工生产中,为了提高反应进行的程度而调控反应条件时,需要考虑控制反应条件的成本和实际可能性。催化氧化的生产时:温度较低时,反应速率小,需要很长时间才能达到化学平衡,生产成本高;而压强越大,对动力和生产设备的要求也越高。请结合上表,分析工业生产SO2催化氧化过程的适宜条件为:___________ 。
(1)请根据下列信息判断氢气燃烧生成水蒸气时热量变化。

生成1mol水释放的能量
(2)2SO2(g)+O2(g)
 2SO3(g),是工业制硫酸的主要反应之一、某条件下,在2 L恒容容器中投入2 mol SO2和1 mol O2,如图是反应体系中部分物质的物质的量随时间的变化曲线。
2SO3(g),是工业制硫酸的主要反应之一、某条件下,在2 L恒容容器中投入2 mol SO2和1 mol O2,如图是反应体系中部分物质的物质的量随时间的变化曲线。
①0到10 min内, v(O2)=
②下列情况能说明该反应达到化学平衡状态的是
A. n(SO2) = n(SO3) B. v正 (SO2)=v逆 (SO2)
C. O2的含量保持不变 D.SO2、O2、SO3的浓度之比为2:1:2
③在密闭容器里,通入a mol SO2 (g)、b mol O2 (g)、c mol SO3 (g),发生上述反应,当改变某种条件时,反应速率会减小的是
A.降低温度 B.加入催化剂
C.增大容器体积 D.恒容下,充入He
④工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7%,O2:11%,N2:82%):
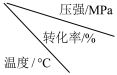 | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
您最近一年使用:0次
2023-09-09更新
|
244次组卷
|
2卷引用:四川省泸县第五中学2023-2024学年高二上学期10月月考化学试题
解答题-原理综合题
|
适中(0.65)
|
9 . 我国氢能源汽车已经开始销售,氢能源的热值高、无污染,使其成为理想的能源,工业上量产化制氢原理是:CH4(g)+2H2O(g)  CO2(g)+4H2(g) ΔH=akJ/mol。
CO2(g)+4H2(g) ΔH=akJ/mol。
(1)相关化学键键能数据如下表所示。
则a=___________ 。
(2)关于上述反应中CO2产物的再利用一直是科研工作者研究的重点。工业上利用 CO2和 制备甲醇的原理是:CO2(g) + 3H2(g)
制备甲醇的原理是:CO2(g) + 3H2(g) H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和
H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和 初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。
初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。

①220℃时,经过2min达到M点,则该条件下0~2min内的平均反应速率
___________ ;无分子筛膜时,升高温度,反应速率 将
将___________ (选填“增大”、“减小” 或“不变”)。
②其他条件不变,有分子筛膜时甲醇的平衡产率总是高于没有分子筛膜,其原因可能是___________ 。
(3)工业上利用 CO2和H2制备甲醇的容器中存在的反应有:
反应Ⅰ:CO2(g) + 3H2(g) H2O(g) + CH3OH(g)
H2O(g) + CH3OH(g)
反应Ⅱ:CO2(g) + 4H2(g) 2H2O(g) + CH4(g)
2H2O(g) + CH4(g)
反应Ⅲ:2CO2(g) + 6H2(g) 4H2O(g) + C2H4(g)
4H2O(g) + C2H4(g)
为分析催化剂对反应的选择性,在1L恒容密闭容器中充入2.0 mol CO2和5.3mol H2。若测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示:

①该催化剂在较低温度时主要选择反应___________ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。
②研究发现,若温度过高,三种含碳产物的物质的量均会迅速降低,其主要原因可能是___________ 。
③在一定温度下达到平衡,此时测得容器中部分物质的含量 ,
,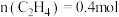 ,
,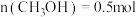 。则该温度下反应Ⅰ的平衡常数K=
。则该温度下反应Ⅰ的平衡常数K=_______  (结果保留两位小数)。
(结果保留两位小数)。
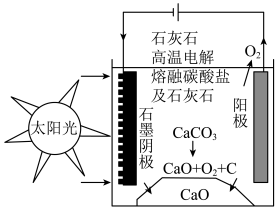
(4)研究人员研究出一种方法,可实现水泥生产时 零排放,其基本原理如图所示。温度小于
零排放,其基本原理如图所示。温度小于 时进行电解反应,碳酸钙先分解为
时进行电解反应,碳酸钙先分解为 和
和 ,电解质为熔融碳酸钠,阳极的电极反应为
,电解质为熔融碳酸钠,阳极的电极反应为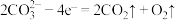 ,则阴极的电极反应为
,则阴极的电极反应为___________ 。
 CO2(g)+4H2(g) ΔH=akJ/mol。
CO2(g)+4H2(g) ΔH=akJ/mol。(1)相关化学键键能数据如下表所示。
| 化学键 | H-H | C=O | H-O | C-H |
 | 435 | 745 | 463 | 415 |
(2)关于上述反应中CO2产物的再利用一直是科研工作者研究的重点。工业上利用 CO2和
 制备甲醇的原理是:CO2(g) + 3H2(g)
制备甲醇的原理是:CO2(g) + 3H2(g) H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和
H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和 初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。
初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。
①220℃时,经过2min达到M点,则该条件下0~2min内的平均反应速率

 将
将②其他条件不变,有分子筛膜时甲醇的平衡产率总是高于没有分子筛膜,其原因可能是
(3)工业上利用 CO2和H2制备甲醇的容器中存在的反应有:
反应Ⅰ:CO2(g) + 3H2(g)
 H2O(g) + CH3OH(g)
H2O(g) + CH3OH(g) 反应Ⅱ:CO2(g) + 4H2(g)
 2H2O(g) + CH4(g)
2H2O(g) + CH4(g)反应Ⅲ:2CO2(g) + 6H2(g)
 4H2O(g) + C2H4(g)
4H2O(g) + C2H4(g) 为分析催化剂对反应的选择性,在1L恒容密闭容器中充入2.0 mol CO2和5.3mol H2。若测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示:

①该催化剂在较低温度时主要选择反应
②研究发现,若温度过高,三种含碳产物的物质的量均会迅速降低,其主要原因可能是
③在一定温度下达到平衡,此时测得容器中部分物质的含量
 ,
,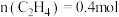 ,
,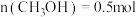 。则该温度下反应Ⅰ的平衡常数K=
。则该温度下反应Ⅰ的平衡常数K= (结果保留两位小数)。
(结果保留两位小数)。(4)研究人员研究出一种方法,可实现水泥生产时
 零排放,其基本原理如图所示。温度小于
零排放,其基本原理如图所示。温度小于 时进行电解反应,碳酸钙先分解为
时进行电解反应,碳酸钙先分解为 和
和 ,电解质为熔融碳酸钠,阳极的电极反应为
,电解质为熔融碳酸钠,阳极的电极反应为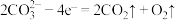 ,则阴极的电极反应为
,则阴极的电极反应为
您最近一年使用:0次
解题方法
10 . 2022年1月17日,习近平主席在出席世界经济论坛视频会议发表演讲时指出,“实现碳达峰、碳中和是中国高质量发展的内在要求,也是中国对国际社会的庄严承诺”。二氧化碳的捕集、利用与封存(CCUS)已成为科学家研究的重要课题。
(1)下列措施不利于实现我国“碳达峰、碳中和”目标的是___________(填字母)。
(2)二氧化碳加氢可转化为二甲醚(CH3OCH3),既可降低二氧化碳排放量,也可得到性能优良的汽车燃料。反应原理为: 。
。
①该反应的能量变化如图所示,该反应为_________ (填“放热”或“吸热”)反应。

②在体积为2L的密闭容器中,充入3molCO2(g)和9molH2(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。

反应到达A点时,
_________  (填“>”、“<”或“=”)。0~5min内,
(填“>”、“<”或“=”)。0~5min内,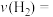
_________ 。反应达到平衡状态时,二甲醚的体积分数为_________ (百分号内保留2位小数)。下列不能说明该反应已达平衡状态的是_________ (填字母)。
A.H2的含量保持不变 B.CO2(g)与H2(g)的物质的量之比保持不变
C.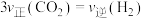 D.混合气体的平均密度保持不变
D.混合气体的平均密度保持不变
③下列说法错误的有_________ (填字母)。
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应不需要加热就能发生
C.需要加热才能发生的反应都是吸热反应
D.化学反应中的能量变化主要是由化学键变化引起的
E.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
(1)下列措施不利于实现我国“碳达峰、碳中和”目标的是___________(填字母)。
| A.完善充电桩、自行车道等相应的配套设施建设,引导公众优先绿色出行 |
| B.大规模开采可燃冰作为新能源和通过清洁煤技术减少煤燃烧污染 |
| C.支持风力发电、光伏发电、潮汐发电等行业健康有序发展 |
| D.加大农村房屋建筑节能改造力度,降低冬季取暖燃料的使用 |
 。
。 ①该反应的能量变化如图所示,该反应为

②在体积为2L的密闭容器中,充入3molCO2(g)和9molH2(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。

反应到达A点时,

 (填“>”、“<”或“=”)。0~5min内,
(填“>”、“<”或“=”)。0~5min内,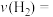
A.H2的含量保持不变 B.CO2(g)与H2(g)的物质的量之比保持不变
C.
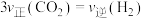 D.混合气体的平均密度保持不变
D.混合气体的平均密度保持不变③下列说法错误的有
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应不需要加热就能发生
C.需要加热才能发生的反应都是吸热反应
D.化学反应中的能量变化主要是由化学键变化引起的
E.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
您最近一年使用:0次



