1 . Haber法是工业上常使用的合成氨技术,对该技术的改进一直是科学家探索的重要课题,其反应原理为:

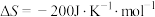 。回答下列问题:
。回答下列问题:
(1)已知:

1molN―H键断裂吸收的能量等于_______ kJ(保留一位小数),合成氨反应在常温(T=298K)下_______ (填“能”或“不能”)自发进行。
(2)将1.00mol 和3.00mol
和3.00mol 充入到容积为3L的恒容密闭容器中模拟反应,测得数据如下图所示。
充入到容积为3L的恒容密闭容器中模拟反应,测得数据如下图所示。

①图甲中反应达到平衡时的平均反应速率
_______ 。
②图乙的平衡体系中A、B、C三点的平衡常数 、
、 、
、 间的大小关系是
间的大小关系是_______ 。
(3)针对反应速率与平衡产率之间的矛盾,我国科学家研究发现采用M―LiH(M表示金属)复合催化剂能在较低的温度下合成 ,可有效缓解这一矛盾。300℃时,实验测得不同催化剂反应速率(用单位时间内每克催化剂所获得的
,可有效缓解这一矛盾。300℃时,实验测得不同催化剂反应速率(用单位时间内每克催化剂所获得的 的物质的量表示)如图所示:
的物质的量表示)如图所示:

①无LiH,催化效率最高的金属是_______ 。
②有LiH,反应速率明显增大。文献报道了M―LiH可能的催化历程经如下三步完成。
第ⅰ步: (在M表面解离)
(在M表面解离)
第ⅱ步:
第ⅲ步:_______ 。
(4)工业上需考虑多种因素提高合成氨产率,其措施有:加入合适的催化剂、调控适宜温度、_______ 、_______ 。


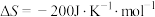 。回答下列问题:
。回答下列问题:(1)已知:

1molN―H键断裂吸收的能量等于
(2)将1.00mol
 和3.00mol
和3.00mol 充入到容积为3L的恒容密闭容器中模拟反应,测得数据如下图所示。
充入到容积为3L的恒容密闭容器中模拟反应,测得数据如下图所示。
①图甲中反应达到平衡时的平均反应速率

②图乙的平衡体系中A、B、C三点的平衡常数
 、
、 、
、 间的大小关系是
间的大小关系是(3)针对反应速率与平衡产率之间的矛盾,我国科学家研究发现采用M―LiH(M表示金属)复合催化剂能在较低的温度下合成
 ,可有效缓解这一矛盾。300℃时,实验测得不同催化剂反应速率(用单位时间内每克催化剂所获得的
,可有效缓解这一矛盾。300℃时,实验测得不同催化剂反应速率(用单位时间内每克催化剂所获得的 的物质的量表示)如图所示:
的物质的量表示)如图所示:
①无LiH,催化效率最高的金属是
②有LiH,反应速率明显增大。文献报道了M―LiH可能的催化历程经如下三步完成。
第ⅰ步:
 (在M表面解离)
(在M表面解离)第ⅱ步:

第ⅲ步:
(4)工业上需考虑多种因素提高合成氨产率,其措施有:加入合适的催化剂、调控适宜温度、
您最近一年使用:0次
解题方法
2 . 丙烯是应用广泛的基础化工原料,工业上通过丙烷脱氢制备的主要反应如下:
反应Ⅰ:丙烷直接脱氢:
反应Ⅱ:氧气氧化丙烷脱氢:
回答下列问题:
(1)反应 △H=
△H=_____ kJ∙mol-1,Kp=_____ (用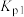 ,
, 表示)。
表示)。
(2)丙烷直接脱氢制备时,有利于提高C3H8的平衡转化率的条件是_____(填字母标号)。
(3)一定条件下,向1L实验容器中充入1mol气态C3H8发生反应Ⅰ。将不同温度下采集到的数据绘制出温度对C3H8的转化率和C3H6的选择性(转化的C3H8中生成C3H6的百分比)影响如图所示。
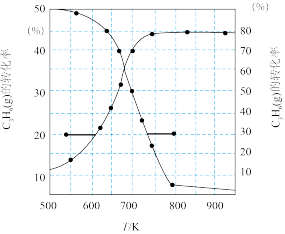
①700K时,该反应10min达化学平衡,根据图中数据,反应I中v生成(C3H6)=_____ mol/(L·min)。
②从图中获知反应Ⅰ存在着高温降低C3H6的选择性与低温降低C3H8的转化率的调控矛盾。请结合第(2)问分析实际工业制备中向容器充入水蒸气的主要目的是_____ 。
(4)科学家通过新型催化剂的应用在反应Ⅱ中使用CO2替代O2开发了丙烷氧化脱氢的新工艺。该工艺中CO2与丙烷脱氢机理如图所示:(AB为催化剂的活性吸附位点)。
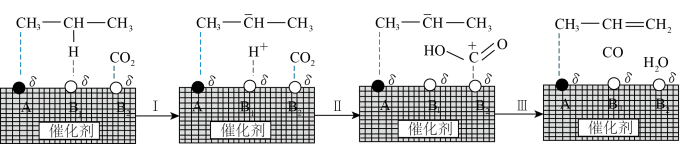
①写出图中CO2与C3H8反应的总化学方程式_____ 。
②向某绝热恒容密闭容器中充入一定量的C3H8和CO2发生反应。工业上可通过传感器监测下列指标来判断该反应达到平衡状态的是_____ (填字母标号):监测发现反应中C3H8的转化率会随充入CO2的分压增加呈现先增大后减小的变化,结合CO2与C3H8脱氢机理分析可能原因是_____ 。
A.容器内混合气体的温度
B.容器内混合气体密度
C.容器内C3H6的气体分压
D.v(C3H6)=v(CO2)
反应Ⅰ:丙烷直接脱氢:

反应Ⅱ:氧气氧化丙烷脱氢:

回答下列问题:
(1)反应
 △H=
△H=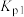 ,
, 表示)。
表示)。(2)丙烷直接脱氢制备时,有利于提高C3H8的平衡转化率的条件是_____(填字母标号)。
| A.低温低压 | B.低温高压 | C.高温高压 | D.高温低压 |
(3)一定条件下,向1L实验容器中充入1mol气态C3H8发生反应Ⅰ。将不同温度下采集到的数据绘制出温度对C3H8的转化率和C3H6的选择性(转化的C3H8中生成C3H6的百分比)影响如图所示。

①700K时,该反应10min达化学平衡,根据图中数据,反应I中v生成(C3H6)=
②从图中获知反应Ⅰ存在着高温降低C3H6的选择性与低温降低C3H8的转化率的调控矛盾。请结合第(2)问分析实际工业制备中向容器充入水蒸气的主要目的是
(4)科学家通过新型催化剂的应用在反应Ⅱ中使用CO2替代O2开发了丙烷氧化脱氢的新工艺。该工艺中CO2与丙烷脱氢机理如图所示:(AB为催化剂的活性吸附位点)。

①写出图中CO2与C3H8反应的总化学方程式
②向某绝热恒容密闭容器中充入一定量的C3H8和CO2发生反应。工业上可通过传感器监测下列指标来判断该反应达到平衡状态的是
A.容器内混合气体的温度
B.容器内混合气体密度
C.容器内C3H6的气体分压
D.v(C3H6)=v(CO2)
您最近一年使用:0次



