名校
解题方法
1 . 在一定温度下发生的可逆反应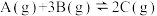 。下列能说明该反应达到化学平衡的是
。下列能说明该反应达到化学平衡的是
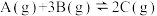 。下列能说明该反应达到化学平衡的是
。下列能说明该反应达到化学平衡的是| A.反应停止了 | B.单位时间内生成n mol A的同时生成2n mol C |
| C.容器内A、B、C的浓度相等 | D.用A、B、C表示的反应速率之比为1:3:2 |
您最近一年使用:0次
名校
2 . 在一定温度下,4 L恒容密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示。回答下列问题:___________ ,0~t1时刻,N的平均反应速率为___________ 。
(2)t1、t2、t3三个时刻中,处于平衡状态的为___________ (填 “t1”“t2” 或“t3”),t3后的某一时刻给体系升高温度,v(正)将___________ (填 “增大”或“减小”或“不变”)。
(3)平衡后容器中气体的压强和反应前气体的压强之比为___________ ,平衡时N的转化率为___________ 。
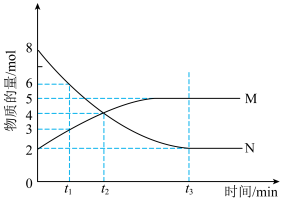
(4)可用电化学原理处理SO2制备硫酸,装置图如下图,电极为多孔材料,M极的电极反应式___________ 。
(2)t1、t2、t3三个时刻中,处于平衡状态的为
(3)平衡后容器中气体的压强和反应前气体的压强之比为
(4)可用电化学原理处理SO2制备硫酸,装置图如下图,电极为多孔材料,M极的电极反应式
您最近一年使用:0次
3 . Haber法是工业上常使用的合成氨技术,对该技术的改进一直是科学家探索的重要课题,其反应原理为:
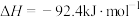
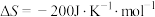 。回答下列问题:
。回答下列问题:
(1)已知:

1molN―H键断裂吸收的能量等于_______ kJ(保留一位小数),合成氨反应在常温(T=298K)下_______ (填“能”或“不能”)自发进行。
(2)将1.00mol 和3.00mol
和3.00mol 充入到容积为3L的恒容密闭容器中模拟反应,测得数据如下图所示。
充入到容积为3L的恒容密闭容器中模拟反应,测得数据如下图所示。

①图甲中反应达到平衡时的平均反应速率
_______ 。
②图乙的平衡体系中A、B、C三点的平衡常数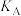 、
、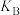 、
、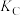 间的大小关系是
间的大小关系是_______ 。
(3)针对反应速率与平衡产率之间的矛盾,我国科学家研究发现采用M―LiH(M表示金属)复合催化剂能在较低的温度下合成 ,可有效缓解这一矛盾。300℃时,实验测得不同催化剂反应速率(用单位时间内每克催化剂所获得的
,可有效缓解这一矛盾。300℃时,实验测得不同催化剂反应速率(用单位时间内每克催化剂所获得的 的物质的量表示)如图所示:
的物质的量表示)如图所示:

①无LiH,催化效率最高的金属是_______ 。
②有LiH,反应速率明显增大。文献报道了M―LiH可能的催化历程经如下三步完成。
第ⅰ步: (在M表面解离)
(在M表面解离)
第ⅱ步:
第ⅲ步:_______ 。
(4)工业上需考虑多种因素提高合成氨产率,其措施有:加入合适的催化剂、调控适宜温度、_______ 、_______ 。

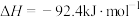
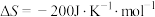 。回答下列问题:
。回答下列问题:(1)已知:

1molN―H键断裂吸收的能量等于
(2)将1.00mol
 和3.00mol
和3.00mol 充入到容积为3L的恒容密闭容器中模拟反应,测得数据如下图所示。
充入到容积为3L的恒容密闭容器中模拟反应,测得数据如下图所示。
①图甲中反应达到平衡时的平均反应速率

②图乙的平衡体系中A、B、C三点的平衡常数
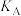 、
、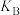 、
、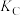 间的大小关系是
间的大小关系是(3)针对反应速率与平衡产率之间的矛盾,我国科学家研究发现采用M―LiH(M表示金属)复合催化剂能在较低的温度下合成
 ,可有效缓解这一矛盾。300℃时,实验测得不同催化剂反应速率(用单位时间内每克催化剂所获得的
,可有效缓解这一矛盾。300℃时,实验测得不同催化剂反应速率(用单位时间内每克催化剂所获得的 的物质的量表示)如图所示:
的物质的量表示)如图所示:
①无LiH,催化效率最高的金属是
②有LiH,反应速率明显增大。文献报道了M―LiH可能的催化历程经如下三步完成。
第ⅰ步:
 (在M表面解离)
(在M表面解离)第ⅱ步:

第ⅲ步:
(4)工业上需考虑多种因素提高合成氨产率,其措施有:加入合适的催化剂、调控适宜温度、
您最近一年使用:0次
名校
4 . 二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚,三步反应如下:
①2H2(g) + CO(g)⇌CH3OH(g) ΔH =-90.8kJ·mol-1
② CO(g) + H2O(g)⇌CO2(g) + H2(g) ΔH =-41.3kJ·mol-1
③2CH3OH(g)⇌CH3OCH3(g) + H2O(g) ΔH =-23.5kJ·mol-1
回答下列问题:
(1)一定条件下的密闭容器中,②反应达到平衡后,要提高CO的转化率,可以采取的措施是(填字母代号)_______ 。
a.高温高压 b.加入催化剂 c.增加H2O的浓度 d.分离出CO2
(2)写出由 H2(g)和CO(g)生成 CH3OCH3(g)和CO2(g)的热化学反应方程式_______ 。
(3)已知反应③在某温度下的平衡常数为400。此温度下,在恒容密闭容器中加入一定量的 CH3OH(g),反应T时刻测得各组分的浓度如下:
①比较T时刻正、逆反应速率的大小关系:v(正)_______ v(逆)(填“>”“<”或“=”)。
②若加入 CH3OH(g)后,经10min 反应达到平衡,此时c(CH3OH) =_______ ;0~10min内反应速率v(CH3OH)= _______ 。
③若反应达平衡后,温度不变,从体系中移走部分CH3OCH3,重新达到平衡后,CH3OH(g)的转化率_______ (填“增大”“减小”或“不变”)。若要使该反应平衡常数增大可采取的措施是_______ 。
①2H2(g) + CO(g)⇌CH3OH(g) ΔH =-90.8kJ·mol-1
② CO(g) + H2O(g)⇌CO2(g) + H2(g) ΔH =-41.3kJ·mol-1
③2CH3OH(g)⇌CH3OCH3(g) + H2O(g) ΔH =-23.5kJ·mol-1
回答下列问题:
(1)一定条件下的密闭容器中,②反应达到平衡后,要提高CO的转化率,可以采取的措施是(填字母代号)
a.高温高压 b.加入催化剂 c.增加H2O的浓度 d.分离出CO2
(2)写出由 H2(g)和CO(g)生成 CH3OCH3(g)和CO2(g)的热化学反应方程式
(3)已知反应③在某温度下的平衡常数为400。此温度下,在恒容密闭容器中加入一定量的 CH3OH(g),反应T时刻测得各组分的浓度如下:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 浓度(mol/L) | 0.44 | 0.6 | 0.6 |
②若加入 CH3OH(g)后,经10min 反应达到平衡,此时c(CH3OH) =
③若反应达平衡后,温度不变,从体系中移走部分CH3OCH3,重新达到平衡后,CH3OH(g)的转化率
您最近一年使用:0次
名校
5 . 异丙醇(C3H8O)可由生物质转化得到,催化异丙醇脱水制取高值化学品丙烯(C3H6)的工业化技术已引起人们的关注,其主要反应如下:
Ⅰ、C3H8O (g) C3H6 (g)+H2O(g) ΔH1=+52kJ·mol-1
C3H6 (g)+H2O(g) ΔH1=+52kJ·mol-1
Ⅱ、2C3H6(g) C6H12(g) ΔH2=-97kJ·mol-1
C6H12(g) ΔH2=-97kJ·mol-1
回答下列问题:
(1)已知2C3H8O(g)+9O2(g)=6CO2 (g)+8H2O(g) ΔH=-3750kJ·mol-1,则C3H6(g)燃烧生成CO2(g)和H2O(g)的热化学方程式为_____ 。
(2)在1350℃下,刚性密闭容器中的反应体系内水蒸气浓度与反应时间关系如下表:
4~8μs内,v(C3H8O)=_____ ppm·μs一1;
②t_____ 16(填“>”“<”或“=”)。
(3)在恒温刚性密闭容器中,反应Ⅰ、Ⅱ均达到平衡的判据是_____ (填标号)。
a.H2O(g)的分压不变
b.混合气体密度不变
c.n(C3H6)=2n(C6H12)
d.v正(H2O)=v逆(C3H8O)
(4)下图为反应Ⅰ、Ⅱ达到平衡时lgQp与温度的关系曲线。

(已知:对于可逆反应aA(g)+bB(g) cC(g)+dD(g),任意时刻Qp=
cC(g)+dD(g),任意时刻Qp= ,式中p(X))表示物质×的分压)
,式中p(X))表示物质×的分压)
①在350℃恒压平衡体系中充入少量水蒸气时,反应Ⅰ的的状态最有可能对应图中的_____ 点(填“甲”“乙”或“丙”),判断依据是_____ 。
②350℃时,在密闭容器中加入一定量的C3H8O,体系达到平衡后,测得C6H12的分压为xMPa,则水蒸气的分压为_____ MPa(用含x的代数式表示)。
Ⅰ、C3H8O (g)
 C3H6 (g)+H2O(g) ΔH1=+52kJ·mol-1
C3H6 (g)+H2O(g) ΔH1=+52kJ·mol-1Ⅱ、2C3H6(g)
 C6H12(g) ΔH2=-97kJ·mol-1
C6H12(g) ΔH2=-97kJ·mol-1回答下列问题:
(1)已知2C3H8O(g)+9O2(g)=6CO2 (g)+8H2O(g) ΔH=-3750kJ·mol-1,则C3H6(g)燃烧生成CO2(g)和H2O(g)的热化学方程式为
(2)在1350℃下,刚性密闭容器中的反应体系内水蒸气浓度与反应时间关系如下表:
| 反应时间/μs | 0 | 4 | 8 | 12 | t | 20 |
| H2O浓度/ppm | 0 | 2440 | 3200 | 3600 | 4000 | 4100 |
②t
(3)在恒温刚性密闭容器中,反应Ⅰ、Ⅱ均达到平衡的判据是
a.H2O(g)的分压不变
b.混合气体密度不变
c.n(C3H6)=2n(C6H12)
d.v正(H2O)=v逆(C3H8O)
(4)下图为反应Ⅰ、Ⅱ达到平衡时lgQp与温度的关系曲线。

(已知:对于可逆反应aA(g)+bB(g)
 cC(g)+dD(g),任意时刻Qp=
cC(g)+dD(g),任意时刻Qp= ,式中p(X))表示物质×的分压)
,式中p(X))表示物质×的分压) ①在350℃恒压平衡体系中充入少量水蒸气时,反应Ⅰ的的状态最有可能对应图中的
②350℃时,在密闭容器中加入一定量的C3H8O,体系达到平衡后,测得C6H12的分压为xMPa,则水蒸气的分压为
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
|
6 . 我国氢能源汽车已经开始销售,氢能源的热值高、无污染,使其成为理想的能源,工业上量产化制氢原理是:CH4(g)+2H2O(g)  CO2(g)+4H2(g) ΔH=akJ/mol。
CO2(g)+4H2(g) ΔH=akJ/mol。
(1)相关化学键键能数据如下表所示。
则a=___________ 。
(2)关于上述反应中CO2产物的再利用一直是科研工作者研究的重点。工业上利用 CO2和 制备甲醇的原理是:CO2(g) + 3H2(g)
制备甲醇的原理是:CO2(g) + 3H2(g) H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和
H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和 初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。
初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。

①220℃时,经过2min达到M点,则该条件下0~2min内的平均反应速率
___________ ;无分子筛膜时,升高温度,反应速率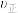 将
将___________ (选填“增大”、“减小” 或“不变”)。
②其他条件不变,有分子筛膜时甲醇的平衡产率总是高于没有分子筛膜,其原因可能是___________ 。
(3)工业上利用 CO2和H2制备甲醇的容器中存在的反应有:
反应Ⅰ:CO2(g) + 3H2(g) H2O(g) + CH3OH(g)
H2O(g) + CH3OH(g)
反应Ⅱ:CO2(g) + 4H2(g) 2H2O(g) + CH4(g)
2H2O(g) + CH4(g)
反应Ⅲ:2CO2(g) + 6H2(g) 4H2O(g) + C2H4(g)
4H2O(g) + C2H4(g)
为分析催化剂对反应的选择性,在1L恒容密闭容器中充入2.0 mol CO2和5.3mol H2。若测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示:

①该催化剂在较低温度时主要选择反应___________ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。
②研究发现,若温度过高,三种含碳产物的物质的量均会迅速降低,其主要原因可能是___________ 。
③在一定温度下达到平衡,此时测得容器中部分物质的含量 ,
,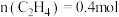 ,
,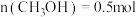 。则该温度下反应Ⅰ的平衡常数K=
。则该温度下反应Ⅰ的平衡常数K=_______  (结果保留两位小数)。
(结果保留两位小数)。
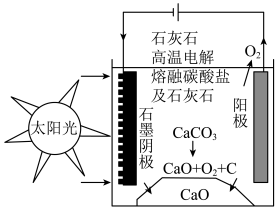
(4)研究人员研究出一种方法,可实现水泥生产时 零排放,其基本原理如图所示。温度小于
零排放,其基本原理如图所示。温度小于 时进行电解反应,碳酸钙先分解为
时进行电解反应,碳酸钙先分解为 和
和 ,电解质为熔融碳酸钠,阳极的电极反应为
,电解质为熔融碳酸钠,阳极的电极反应为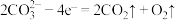 ,则阴极的电极反应为
,则阴极的电极反应为___________ 。
 CO2(g)+4H2(g) ΔH=akJ/mol。
CO2(g)+4H2(g) ΔH=akJ/mol。(1)相关化学键键能数据如下表所示。
| 化学键 | H-H | C=O | H-O | C-H |
 | 435 | 745 | 463 | 415 |
(2)关于上述反应中CO2产物的再利用一直是科研工作者研究的重点。工业上利用 CO2和
 制备甲醇的原理是:CO2(g) + 3H2(g)
制备甲醇的原理是:CO2(g) + 3H2(g) H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和
H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和 初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。
初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。
①220℃时,经过2min达到M点,则该条件下0~2min内的平均反应速率

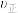 将
将②其他条件不变,有分子筛膜时甲醇的平衡产率总是高于没有分子筛膜,其原因可能是
(3)工业上利用 CO2和H2制备甲醇的容器中存在的反应有:
反应Ⅰ:CO2(g) + 3H2(g)
 H2O(g) + CH3OH(g)
H2O(g) + CH3OH(g) 反应Ⅱ:CO2(g) + 4H2(g)
 2H2O(g) + CH4(g)
2H2O(g) + CH4(g)反应Ⅲ:2CO2(g) + 6H2(g)
 4H2O(g) + C2H4(g)
4H2O(g) + C2H4(g) 为分析催化剂对反应的选择性,在1L恒容密闭容器中充入2.0 mol CO2和5.3mol H2。若测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示:

①该催化剂在较低温度时主要选择反应
②研究发现,若温度过高,三种含碳产物的物质的量均会迅速降低,其主要原因可能是
③在一定温度下达到平衡,此时测得容器中部分物质的含量
 ,
,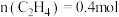 ,
,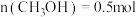 。则该温度下反应Ⅰ的平衡常数K=
。则该温度下反应Ⅰ的平衡常数K= (结果保留两位小数)。
(结果保留两位小数)。(4)研究人员研究出一种方法,可实现水泥生产时
 零排放,其基本原理如图所示。温度小于
零排放,其基本原理如图所示。温度小于 时进行电解反应,碳酸钙先分解为
时进行电解反应,碳酸钙先分解为 和
和 ,电解质为熔融碳酸钠,阳极的电极反应为
,电解质为熔融碳酸钠,阳极的电极反应为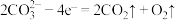 ,则阴极的电极反应为
,则阴极的电极反应为
您最近一年使用:0次
名校
7 . 将2molA和2molB混合于2L的密闭容器中,发生如下反应:3A(g)+B(s) xC(g)+2D(g),反应5min后,测得D的浓度为0.5mol/L,以C表示的平均反应速率v(C)=0.1mol/(L·min),下列说法正确的是
xC(g)+2D(g),反应5min后,测得D的浓度为0.5mol/L,以C表示的平均反应速率v(C)=0.1mol/(L·min),下列说法正确的是
 xC(g)+2D(g),反应5min后,测得D的浓度为0.5mol/L,以C表示的平均反应速率v(C)=0.1mol/(L·min),下列说法正确的是
xC(g)+2D(g),反应5min后,测得D的浓度为0.5mol/L,以C表示的平均反应速率v(C)=0.1mol/(L·min),下列说法正确的是| A.该反应方程式中,x=1 |
| B.5min时,A的物质的量为0.5mol |
| C.以B表示的平均反应速率为v(B)=0.05mol/(L·min) |
| D.5min后,向容器中再添加2molB,会使反应速率加快 |
您最近一年使用:0次
名校
8 . I.按要求完成下列题目:
(1)下列反应中,属于吸热反应的是________ (填字母)。
(2)已知氢气的燃烧热为285.8kJ/mol,写出表示氢气燃烧热的热化学方程式:________ 。
(3)利用中和热实验装置测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol•L-1的盐酸,则还需加入________ (填序号)。
A.1.0gNaOH固体
B.50mL0.50mol•L-1NaOH溶液
C.50mL0.55mol•L-1NaOH溶液
II.回答下列问题:
(4)在体积为1L密闭容器中充入3molCO2(g)和9molH2(g),发生反应2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。
CH3OCH3(g)+3H2O(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。

①反应到达3min时,v正________ v逆(填“>”“<”或“=”)。
②0~5min内,v(CO2)=________ mol•L-1•min-1。
③反应达到平衡状态时,CH3OCH3(g)的体积分数为________ %(保留1位小数)。
④a、b、c三点中代表达到平衡的是________ 。
(1)下列反应中,属于吸热反应的是
| A.碳与水蒸气反应 | B.氧化钙和水反应 |
| C.CaCO3受热分解 | D.锌与盐酸反应 |
(2)已知氢气的燃烧热为285.8kJ/mol,写出表示氢气燃烧热的热化学方程式:
(3)利用中和热实验装置测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol•L-1的盐酸,则还需加入
A.1.0gNaOH固体
B.50mL0.50mol•L-1NaOH溶液
C.50mL0.55mol•L-1NaOH溶液
II.回答下列问题:
(4)在体积为1L密闭容器中充入3molCO2(g)和9molH2(g),发生反应2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。
CH3OCH3(g)+3H2O(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。
①反应到达3min时,v正
②0~5min内,v(CO2)=
③反应达到平衡状态时,CH3OCH3(g)的体积分数为
④a、b、c三点中代表达到平衡的是
您最近一年使用:0次
9 . I.查阅资料:NaNO2溶液和NH4Cl溶液在50℃左右微热可反应生成N2。
(1)实验小组用不同浓度的NaNO2溶液、NH4Cl溶液及少量醋酸溶液(作催化剂)反应,其速率方程为v=kcm(NaNO2)•cn(NH4Cl)•c(H+),k为反应速率常数,以此计算反应的瞬时速率。反应物浓度与反应的瞬时速率如表所示:
①由表实验数据计算得m=________ 。
②该反应的速率常数k=________ L3•mol-3•min-1。
Ⅱ.由CO2与H2制备甲醇是当今研究的热点之一。
(2)在一定条件下,向0.5L恒容密闭容器中充入xmolCO2和ymolH2,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3=-50kJ•mol-1
CH3OH(g)+H2O(g) ΔH3=-50kJ•mol-1
①若x=1、y=3,测得在相同时间内,不同温度下H2的转化率如图1所示,点a_________ 填“已”或“未”)达到平衡。T2时,若起始压强为10atm,Kp=________ atm-2(结果保留一位小数,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。

②已知速率方程v正=k正c(CO2)·c3(H2),v逆=k逆c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度影响,图2表示速率常数k正、k逆的对数lgk与温度的倒数 之间的关系,A、B、D、E分别代表图1中a点、c点的速率常数,其中点
之间的关系,A、B、D、E分别代表图1中a点、c点的速率常数,其中点________ (填A或B或D或E)表示c点的lgk逆。

Ⅲ.回答下列问题:
(3)甲醇和CO2可直接合成碳酸二甲酯(CH3OCOOCH3,简称DMC):2CH3OH(g)+CO2(g) CH3OCOOCH3(g)+H2O(g) ΔH<0。一定条件下分别向甲、乙、丙三个恒容密闭容器中加入一定量的初始物质发生该反应,各容器中温度、反应物的起始量如表,反应过程中DMC的物质的量浓度随时间变化如图3所示:
CH3OCOOCH3(g)+H2O(g) ΔH<0。一定条件下分别向甲、乙、丙三个恒容密闭容器中加入一定量的初始物质发生该反应,各容器中温度、反应物的起始量如表,反应过程中DMC的物质的量浓度随时间变化如图3所示:

乙容器中,若平衡时n(CO2)=0.2mol,则T1________ T2(填“>”“<"或”=”)。甲、丙两容器的反应达平衡时CO2的转化率:甲________ 丙(填“>”“<"或”=”)。
(1)实验小组用不同浓度的NaNO2溶液、NH4Cl溶液及少量醋酸溶液(作催化剂)反应,其速率方程为v=kcm(NaNO2)•cn(NH4Cl)•c(H+),k为反应速率常数,以此计算反应的瞬时速率。反应物浓度与反应的瞬时速率如表所示:
| 实验编号 | NaNO2溶液/mol•L-1 | NH4Cl溶液/mol•L-1 | H+/mol•L-1 | V/mol•L-1•min-1 |
| 1 | 0.100 | 0.100 | 0.001 | 2.0×10-8 |
| 2 | 0.200 | 0.100 | 0.001 | 8.0×10-8 |
| 3 | 0.100 | 0.200 | 0.001 | 4.0×10-8 |
②该反应的速率常数k=
Ⅱ.由CO2与H2制备甲醇是当今研究的热点之一。
(2)在一定条件下,向0.5L恒容密闭容器中充入xmolCO2和ymolH2,发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH3=-50kJ•mol-1
CH3OH(g)+H2O(g) ΔH3=-50kJ•mol-1①若x=1、y=3,测得在相同时间内,不同温度下H2的转化率如图1所示,点a

②已知速率方程v正=k正c(CO2)·c3(H2),v逆=k逆c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度影响,图2表示速率常数k正、k逆的对数lgk与温度的倒数
 之间的关系,A、B、D、E分别代表图1中a点、c点的速率常数,其中点
之间的关系,A、B、D、E分别代表图1中a点、c点的速率常数,其中点
Ⅲ.回答下列问题:
(3)甲醇和CO2可直接合成碳酸二甲酯(CH3OCOOCH3,简称DMC):2CH3OH(g)+CO2(g)
 CH3OCOOCH3(g)+H2O(g) ΔH<0。一定条件下分别向甲、乙、丙三个恒容密闭容器中加入一定量的初始物质发生该反应,各容器中温度、反应物的起始量如表,反应过程中DMC的物质的量浓度随时间变化如图3所示:
CH3OCOOCH3(g)+H2O(g) ΔH<0。一定条件下分别向甲、乙、丙三个恒容密闭容器中加入一定量的初始物质发生该反应,各容器中温度、反应物的起始量如表,反应过程中DMC的物质的量浓度随时间变化如图3所示:
| 容器 | 甲 | 乙 | 丙 |
| 容积(L) | 0.5 | 0.5 | V |
| 温度(℃) | T1 | T2 | T1 |
| 起始量 | 1molCO2(g)、2molCH3OH(g) | 1molDMC(g)、1molH2O(g) | 2molCO2(g)、2molCH3OH(g) |
您最近一年使用:0次
名校
解题方法
10 . CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。某兴趣小组了解到空气燃料实验系统可利用二氧化碳和水直接合成甲醇,结合有关信息他们推测到其工作时反应原理如下:
I.CO2(g)+2H2(g) CO(g)+H2(g)+O2(g) △H=+akJ•mol-1
CO(g)+H2(g)+O2(g) △H=+akJ•mol-1
II.CO(g)+2H2(g) CH3OH(g) △H=-bkJ•mol-1
CH3OH(g) △H=-bkJ•mol-1
已知:2H2O(l)=O2(g)+2H2(g) △H=+ckJ•mol-1
(1)2CO2(g)+4H2O(g) 2CH3OH(g)+3O2(g)的△H为
2CH3OH(g)+3O2(g)的△H为________ kJ/mol。
(2)T℃时,在体积为1L的密闭容器中加入2molCO和4molH2发生反应II,经过5min达到平衡,此时H2的浓度为2mol•L-1。回答下列问题:
①下列叙述不能判断反应达到平衡的是________ (填选项符号)。
A.v正(CO)=v逆(CH3OH) B.混合气体密度不再变化
C.体系的压强不再变化 D.CO与H2转化率相等
②0~5min内用CO表示的反应速率为________ mol•L-1•min-1,反应的平衡常数K=________ (mol•L-1)-2。
③T℃时,再向容器中充入2molCO和4molH2,重新达到平衡时CO的浓度________ (填“>”或“<”或“=”)原平衡的2倍。
(3)其它条件不变,CO2平衡转化率与温度的关系如图所示,T1之后CO2平衡转化率随温度升高而降低的原因是________ 。

I.CO2(g)+2H2(g)
 CO(g)+H2(g)+O2(g) △H=+akJ•mol-1
CO(g)+H2(g)+O2(g) △H=+akJ•mol-1II.CO(g)+2H2(g)
 CH3OH(g) △H=-bkJ•mol-1
CH3OH(g) △H=-bkJ•mol-1已知:2H2O(l)=O2(g)+2H2(g) △H=+ckJ•mol-1
(1)2CO2(g)+4H2O(g)
 2CH3OH(g)+3O2(g)的△H为
2CH3OH(g)+3O2(g)的△H为(2)T℃时,在体积为1L的密闭容器中加入2molCO和4molH2发生反应II,经过5min达到平衡,此时H2的浓度为2mol•L-1。回答下列问题:
①下列叙述不能判断反应达到平衡的是
A.v正(CO)=v逆(CH3OH) B.混合气体密度不再变化
C.体系的压强不再变化 D.CO与H2转化率相等
②0~5min内用CO表示的反应速率为
③T℃时,再向容器中充入2molCO和4molH2,重新达到平衡时CO的浓度
(3)其它条件不变,CO2平衡转化率与温度的关系如图所示,T1之后CO2平衡转化率随温度升高而降低的原因是

您最近一年使用:0次
2023-11-03更新
|
12次组卷
|
2卷引用:四川省南充市嘉陵第一中学2023-2024学年高二上学期10月月考化学试题



