名校
解题方法
1 . CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。某兴趣小组了解到空气燃料实验系统可利用二氧化碳和水直接合成甲醇,结合有关信息他们推测到其工作时反应原理如下:
I.CO2(g)+2H2(g) CO(g)+H2(g)+O2(g) △H=+akJ•mol-1
CO(g)+H2(g)+O2(g) △H=+akJ•mol-1
II.CO(g)+2H2(g) CH3OH(g) △H=-bkJ•mol-1
CH3OH(g) △H=-bkJ•mol-1
已知:2H2O(l)=O2(g)+2H2(g) △H=+ckJ•mol-1
(1)2CO2(g)+4H2O(g) 2CH3OH(g)+3O2(g)的△H为
2CH3OH(g)+3O2(g)的△H为________ kJ/mol。
(2)T℃时,在体积为1L的密闭容器中加入2molCO和4molH2发生反应II,经过5min达到平衡,此时H2的浓度为2mol•L-1。回答下列问题:
①下列叙述不能判断反应达到平衡的是________ (填选项符号)。
A.v正(CO)=v逆(CH3OH) B.混合气体密度不再变化
C.体系的压强不再变化 D.CO与H2转化率相等
②0~5min内用CO表示的反应速率为________ mol•L-1•min-1,反应的平衡常数K=________ (mol•L-1)-2。
③T℃时,再向容器中充入2molCO和4molH2,重新达到平衡时CO的浓度________ (填“>”或“<”或“=”)原平衡的2倍。
(3)其它条件不变,CO2平衡转化率与温度的关系如图所示,T1之后CO2平衡转化率随温度升高而降低的原因是________ 。

I.CO2(g)+2H2(g)
 CO(g)+H2(g)+O2(g) △H=+akJ•mol-1
CO(g)+H2(g)+O2(g) △H=+akJ•mol-1II.CO(g)+2H2(g)
 CH3OH(g) △H=-bkJ•mol-1
CH3OH(g) △H=-bkJ•mol-1已知:2H2O(l)=O2(g)+2H2(g) △H=+ckJ•mol-1
(1)2CO2(g)+4H2O(g)
 2CH3OH(g)+3O2(g)的△H为
2CH3OH(g)+3O2(g)的△H为(2)T℃时,在体积为1L的密闭容器中加入2molCO和4molH2发生反应II,经过5min达到平衡,此时H2的浓度为2mol•L-1。回答下列问题:
①下列叙述不能判断反应达到平衡的是
A.v正(CO)=v逆(CH3OH) B.混合气体密度不再变化
C.体系的压强不再变化 D.CO与H2转化率相等
②0~5min内用CO表示的反应速率为
③T℃时,再向容器中充入2molCO和4molH2,重新达到平衡时CO的浓度
(3)其它条件不变,CO2平衡转化率与温度的关系如图所示,T1之后CO2平衡转化率随温度升高而降低的原因是

您最近一年使用:0次
2023-11-03更新
|
12次组卷
|
2卷引用:四川省南充市嘉陵第一中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
2 . 以煤为原料可合成一系列燃料。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
请写出甲醇燃烧生成H2O(g)的热化学方程式_________ ;
(2)向1 L密闭容器中加入2 mol CO、4 mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g) CH3OCH3(l)+H2O(l) ΔH=+71 kJ/mol
CH3OCH3(l)+H2O(l) ΔH=+71 kJ/mol
①该反应能否_________ 自发进行(填“能”、“不能”或“无法判断”)。
②下列叙述能说明此反应达到平衡状态的是_________ 。
a.混合气体的平均相对分子质量保持不变 b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变 d.混合气体的密度保持不变
e.1 mol CO生成的同时有1 mol O-H键断裂
(3)CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0在一定条件下,某反应过程中部分数据如下表:
CH3OH(g)+H2O(g) ΔH<0在一定条件下,某反应过程中部分数据如下表:
①0~10 min内,用H2O(g)表示的化学反应速率v(H2O)=_________ mol/(L·min)
②达到平衡时,该反应的平衡常数K=_________ (用分数表示)
③在其它条件不变的情况下,若30 min时改变温度为T2℃,此时H2的物质的量为3.2 mol,则T1_________ T2(填“>”、“<”或“=”),理由是_________ 。在其它条件不变的情况下,若30 min时向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_________ 移动(填“正向”、“逆向”或“不”)。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
请写出甲醇燃烧生成H2O(g)的热化学方程式
(2)向1 L密闭容器中加入2 mol CO、4 mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)
 CH3OCH3(l)+H2O(l) ΔH=+71 kJ/mol
CH3OCH3(l)+H2O(l) ΔH=+71 kJ/mol①该反应能否
②下列叙述能说明此反应达到平衡状态的是
a.混合气体的平均相对分子质量保持不变 b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变 d.混合气体的密度保持不变
e.1 mol CO生成的同时有1 mol O-H键断裂
(3)CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH<0在一定条件下,某反应过程中部分数据如下表:
CH3OH(g)+H2O(g) ΔH<0在一定条件下,某反应过程中部分数据如下表:| 反应条件 | 反应时间(min) | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 恒温恒容(T1℃、2 L) | 0 | 2 | 6 | 0 | 0 |
| 10 | 4.5 | ||||
| 20 | 1 | ||||
| 30 | 1 |
②达到平衡时,该反应的平衡常数K=
③在其它条件不变的情况下,若30 min时改变温度为T2℃,此时H2的物质的量为3.2 mol,则T1
您最近一年使用:0次
名校
解题方法
3 . I.(1)浙江大学用甲醇、CO、O2在常压、某温度和催化剂的条件下合成碳酸二甲酯(DMC)的研究开发。
已知:ⅰ. CO的燃烧热:△H=-283.0kJ•mol-1;
ⅱ.1mol H2O(l)完全蒸发变成H2O(g)需吸收44 kJ的热量;
ⅲ.2CH3OH(g)+CO2(g) CH3OCOOCH3(g)+H2O(g) △H=-15.5 kJ•mol-1
CH3OCOOCH3(g)+H2O(g) △H=-15.5 kJ•mol-1
则2CH3OH(g)+CO(g)+ 1/2O2(g) CH3OCOOCH3(g)+H2O(l) △H=
CH3OCOOCH3(g)+H2O(l) △H=_________ 。该反应平衡常数K的表达式为:____________ 。
(2)甲醇也是制备甲酸的一种重要原料。某温度时,将10mol甲酸钠溶于水,溶液显碱性,向该溶液中滴加1L某浓度的甲酸,使溶液呈中性,则滴加甲酸的过程中水的电离平衡将_____________ (填“正向”、“逆向”或“不”) 移动, 此中性溶液中离子浓度由大到小的顺序为:_____________ 。
Ⅱ.甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2(g) CH3OCOOCH3(g)+ H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产。
CH3OCOOCH3(g)+ H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产。
(1)在恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是___ (选填编号)。
A.2v正(CH3OH)=v逆(CO2) B.CH3OH与H2O的物质的量之比保持不变
C.容器内气体的密度不变 D.容器内压强不变
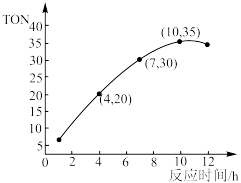
(2)某研究小组在某温度下,在100mL恒容密闭容器中投入2.5 mol CH3OH(g)、适量CO2和6×10-5mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示。计算公式为:TON = 转化的甲醇的物质的量/催化剂的物质的量。在该温度下,最佳反应时间是______ ;4~10 h内碳酸二甲酯的平均反应速率是________ 。
已知:ⅰ. CO的燃烧热:△H=-283.0kJ•mol-1;
ⅱ.1mol H2O(l)完全蒸发变成H2O(g)需吸收44 kJ的热量;
ⅲ.2CH3OH(g)+CO2(g)
 CH3OCOOCH3(g)+H2O(g) △H=-15.5 kJ•mol-1
CH3OCOOCH3(g)+H2O(g) △H=-15.5 kJ•mol-1则2CH3OH(g)+CO(g)+ 1/2O2(g)
 CH3OCOOCH3(g)+H2O(l) △H=
CH3OCOOCH3(g)+H2O(l) △H=(2)甲醇也是制备甲酸的一种重要原料。某温度时,将10mol甲酸钠溶于水,溶液显碱性,向该溶液中滴加1L某浓度的甲酸,使溶液呈中性,则滴加甲酸的过程中水的电离平衡将
Ⅱ.甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2(g)
 CH3OCOOCH3(g)+ H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产。
CH3OCOOCH3(g)+ H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产。
(1)在恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是
A.2v正(CH3OH)=v逆(CO2) B.CH3OH与H2O的物质的量之比保持不变
C.容器内气体的密度不变 D.容器内压强不变
(2)某研究小组在某温度下,在100mL恒容密闭容器中投入2.5 mol CH3OH(g)、适量CO2和6×10-5mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示。计算公式为:TON = 转化的甲醇的物质的量/催化剂的物质的量。在该温度下,最佳反应时间是
您最近一年使用:0次
2016-12-09更新
|
328次组卷
|
3卷引用:四川省南充高级中学2020届高三下学期第三次线上月考化学试题



