名校
解题方法
1 . 草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取和性质,进行如下实验。
实验Ⅰ:探究草酸的制备
实验室用硝酸氧化淀粉水解液制草酸:C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O。装置如图所示:

(1)上图实验装置中仪器乙的名称为:_______ ,B装置的作用_______ 。
(2)检验淀粉是否完全水解所需要的试剂为:_______ 。
实验Ⅱ:探究草酸的不稳定性
已知:草酸晶体(H2C2O4·2H2O,M=126g/mol)无色,易溶于水,熔点为101℃,受热易脱水、升华,170℃以上分解产生H2O、CO和CO2。草酸的酸性比碳酸强,其钙盐难溶于水。

(3)请选取以上的装置证明草酸晶体分解的产物(可重复使用,加热装置和连接装置已略去)。仪器装置连接顺序为:C→_______ →_______ →_______ →_______ →D→A→F→E
(4)若实验结束后测得A管后面的F装置质量增加4.4g,则至少需分解草酸晶体的质量为_______ g。
实验Ⅲ:探究草酸与酸性高锰酸钾的反应
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下对比实验;
写出高锰酸钾在酸性条件下氧化草酸的离子反应方程式:_______ 。由此你认为溶液褪色总是先慢后快的原因是_______ ,试求实验1中用KMnO4表示的平均化学反应速率为_______ (结果保留一位小数)。
实验Ⅰ:探究草酸的制备
实验室用硝酸氧化淀粉水解液制草酸:C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O。装置如图所示:

(1)上图实验装置中仪器乙的名称为:
(2)检验淀粉是否完全水解所需要的试剂为:
实验Ⅱ:探究草酸的不稳定性
已知:草酸晶体(H2C2O4·2H2O,M=126g/mol)无色,易溶于水,熔点为101℃,受热易脱水、升华,170℃以上分解产生H2O、CO和CO2。草酸的酸性比碳酸强,其钙盐难溶于水。

(3)请选取以上的装置证明草酸晶体分解的产物(可重复使用,加热装置和连接装置已略去)。仪器装置连接顺序为:C→
(4)若实验结束后测得A管后面的F装置质量增加4.4g,则至少需分解草酸晶体的质量为
实验Ⅲ:探究草酸与酸性高锰酸钾的反应
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下对比实验;
| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(S) | 褪色时间(s) | ||
| c(mol·L-1) | V(mL) | c(mol·L-1) | V(mL) | |||
实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
您最近一年使用:0次
名校
2 . 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料。
已知:①
②

③

(1)氢气的燃烧热为_______ ,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式: _______ 。
(2)现有 由
由 与
与 组成的混合气体,且
组成的混合气体,且 的体积分数为
的体积分数为 ,将此混合气体与足量
,将此混合气体与足量 充分反应。当
充分反应。当
_______ 时,反应②与③放出(或吸收)的总能量为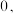 若反应②过程中能量转化过程如图所示,下列有关说法中正确的是
若反应②过程中能量转化过程如图所示,下列有关说法中正确的是_______ 。

A. B.
B.
C. D.
D.
(3)工业上可通过 和
和 化合制得
化合制得 结构式为
结构式为 。又知某些化学键的键能数值如下表:
。又知某些化学键的键能数值如下表:
则
_______ 。
(4)一定条件下铁可以和 发生反应:
发生反应:

 ,该反应为放热反应。一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的
,该反应为放热反应。一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的 气体,反应过程中
气体,反应过程中 气体和
气体和 气体的浓度与时间的关系如图所示。
气体的浓度与时间的关系如图所示。

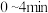 内,
内, 的平均反应速率
的平均反应速率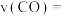
_______  。下列条件的改变能减慢该反应的反应速率的是
。下列条件的改变能减慢该反应的反应速率的是_______ (填字母,下同)。
 降低温度
降低温度
 减少铁粉的质量
减少铁粉的质量
 保持压强不变,充入
保持压强不变,充入 使容器的体积增大
使容器的体积增大
 保持体积不变,充入
保持体积不变,充入 使体系压强增大
使体系压强增大
已知:①

②


③


(1)氢气的燃烧热为
(2)现有
 由
由 与
与 组成的混合气体,且
组成的混合气体,且 的体积分数为
的体积分数为 ,将此混合气体与足量
,将此混合气体与足量 充分反应。当
充分反应。当
 若反应②过程中能量转化过程如图所示,下列有关说法中正确的是
若反应②过程中能量转化过程如图所示,下列有关说法中正确的是
A.
 B.
B.
C.
 D.
D.
(3)工业上可通过
 和
和 化合制得
化合制得 结构式为
结构式为 。又知某些化学键的键能数值如下表:
。又知某些化学键的键能数值如下表:| 化学键 |  |  |  |  |  |  |
键能 | 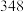 | 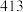 | 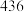 |  |  |  |

(4)一定条件下铁可以和
 发生反应:
发生反应:

 ,该反应为放热反应。一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的
,该反应为放热反应。一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的 气体,反应过程中
气体,反应过程中 气体和
气体和 气体的浓度与时间的关系如图所示。
气体的浓度与时间的关系如图所示。
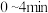 内,
内, 的平均反应速率
的平均反应速率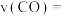
 。下列条件的改变能减慢该反应的反应速率的是
。下列条件的改变能减慢该反应的反应速率的是 降低温度
降低温度 减少铁粉的质量
减少铁粉的质量 保持压强不变,充入
保持压强不变,充入 使容器的体积增大
使容器的体积增大 保持体积不变,充入
保持体积不变,充入 使体系压强增大
使体系压强增大
您最近一年使用:0次
3 . 某温度下,在1L恒容真空密闭容器中充入5.0mol块状X,发生反应:2X(s) Y(g)+2Z(g),测得如表数据,下列说法不正确的是
Y(g)+2Z(g),测得如表数据,下列说法不正确的是
 Y(g)+2Z(g),测得如表数据,下列说法不正确的是
Y(g)+2Z(g),测得如表数据,下列说法不正确的是| 时间段/s | 0~20 | 0~40 | 0~60 |
| 产物Z的平均生成速率/mol•L-1•s-1 | 0.10 | 0.075 | 0.05 |
| A.10秒时,c(Y)小于0.50mol/L |
| B.30秒时,混合气体中Z的体积分数约为66.7% |
| C.40秒时,反应已达平衡状态 |
| D.容器内压强不再变化时,达到化学反应的限度 |
您最近一年使用:0次
4 . T℃时,向一个容积为2L的密闭容器中充入一定量的CO和 ,发生如下反应:
,发生如下反应: ,反应过程中测得的部分数据如表。下列说法不正确的是
,反应过程中测得的部分数据如表。下列说法不正确的是
 ,发生如下反应:
,发生如下反应: ,反应过程中测得的部分数据如表。下列说法不正确的是
,反应过程中测得的部分数据如表。下列说法不正确的是 | 0 | 10 | 20 | 30 |
 | 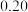 |  |  | |
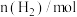 |  |  |
A.若其他条件不变,升高温度,平衡时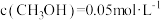 ,则该反应的 ,则该反应的 |
B.在前10min内该反应的平均反应速率 |
C.T℃时,该反应的平衡常数为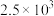 |
D.相同温度下,若起始时向该容器中只充入 ,达到平衡时 ,达到平衡时 的转化率小于20% 的转化率小于20% |
您最近一年使用:0次
名校
解题方法
5 . 向一容积为5L的恒容密闭容器中充入5molA与8molB,在一定条件下反应:2A(g) + 3B(g) xC(g) + yD(g) (x、y为正整数)反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol∙L-1∙min-1,D的平衡浓度为0.3mol./L,又知v(B) : v(C)=3 : 2,下列说法中不正确的是 ( )
xC(g) + yD(g) (x、y为正整数)反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol∙L-1∙min-1,D的平衡浓度为0.3mol./L,又知v(B) : v(C)=3 : 2,下列说法中不正确的是 ( )
 xC(g) + yD(g) (x、y为正整数)反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol∙L-1∙min-1,D的平衡浓度为0.3mol./L,又知v(B) : v(C)=3 : 2,下列说法中不正确的是 ( )
xC(g) + yD(g) (x、y为正整数)反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol∙L-1∙min-1,D的平衡浓度为0.3mol./L,又知v(B) : v(C)=3 : 2,下列说法中不正确的是 ( )| A.x : y=2 : 1 | B.v(A) : v(D)=2 : 1 |
| C.A的平衡浓度为0.4mol/L | D.A与B的平衡浓度之比为3 : 2 |
您最近一年使用:0次
名校
解题方法
6 . 反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),△H=-akJ·mol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法不正确的是
4NO(g)+6H2O(g),△H=-akJ·mol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法不正确的是
 4NO(g)+6H2O(g),△H=-akJ·mol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法不正确的是
4NO(g)+6H2O(g),△H=-akJ·mol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法不正确的是| A.2分钟反应放出的热量值等于0.1akJ |
| B.用氧气表示0~2min的反应速率:v(O2)=0.05mol·L-1·min-1 |
| C.2分钟内NH3的转化率是40% |
| D.2分钟末c(H2O)=0.6mol/L |
您最近一年使用:0次
2021-09-30更新
|
479次组卷
|
7卷引用:四川省南充高级中学2021-2022学年高二上学期第一次月考化学试题
名校
7 . 分别在三个容积均为2.0L的恒容密闭容器中发生反应:A(g)+B(g)⇌D(g)。其中容器甲中反应进行至5min时达到平衡状态,相关实验数据如表所示:
下列说法不正确的是
| 容器 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | 化学平衡常数 | ||
| n(A) | n(B) | n(D) | n(D) | |||
| 甲 | 500 | 4.0 | 4.0 | 0 | 3.2 | K1 |
| 乙 | 500 | 4.0 | a | 0 | 2.0 | K2 |
| 丙 | 600 | 2.0 | 2.0 | 2.0 | 2.8 | K3 |
下列说法不正确的是
| A.0~5min内,甲容器中A的平均反应速率v(A)=0.64mol·L-1·min-1 |
| B.a=2.2 |
| C.若容器甲中起始投料为2.0molA、2.0molB,反应达到平衡时,A的转化率小于80% |
| D.K1=K2>K3 |
您最近一年使用:0次
2020-04-22更新
|
492次组卷
|
7卷引用:四川省南充市阆中市东风中学2021届高三上学期9月月考理综化学试题
四川省南充市阆中市东风中学2021届高三上学期9月月考理综化学试题山东省泰安市2020届高三一轮检测试题化学试题山东省泰安市2020届高三第三次模拟试卷化学试题广东省广州市第一一三中学22020-2021学年高二上学期第一阶段考试化学(选考)试题河北省张家口市宣化一中2020-2021学年高二下学期期初考试化学试题(已下线)押广东卷化学第14题 化学反应速率与化学平衡-备战2022年高考化学临考题号押题(已下线)专题13 化学反应速率与化学平衡-备战2023年高考化学母题题源解密(广东卷)
解题方法
8 . 回答下列问题:
I.已知:①N2(g)+O2(g)=2NO(g) ΔH=+l80.5 kJ·mol-1
②C(S)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
(1)上述反应中属于放热反应的是_______ (填序号,下同),属于吸热反应的是_______ 。
(2)24 g固体碳粉完全燃烧生成CO2放出热量_______ kJ。
(3)已知NO和CO完全反应产生CO2和N2,请写出该反应的热化学方程式_______
Ⅱ.某温度时,在一个2 L的恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示。回答下列问题:
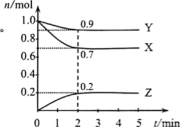
(4)化学方程式为_______ ,从反应开始到2 min,v(X)=_______ 。
(5)t为2 min时的压强是开始时压强的_______ 倍。
(6)下列说法中正确的是_______ (填选项)。
A.2v(X)=v(Z)
B.反应过程中,容器内压强先减小后不变
C.t=2 min时,X,Y的转化率相等
D.反应过程中,容器内混合气体的密度一直保持不变
I.已知:①N2(g)+O2(g)=2NO(g) ΔH=+l80.5 kJ·mol-1
②C(S)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
(1)上述反应中属于放热反应的是
(2)24 g固体碳粉完全燃烧生成CO2放出热量
(3)已知NO和CO完全反应产生CO2和N2,请写出该反应的热化学方程式
Ⅱ.某温度时,在一个2 L的恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示。回答下列问题:

(4)化学方程式为
(5)t为2 min时的压强是开始时压强的
(6)下列说法中正确的是
A.2v(X)=v(Z)
B.反应过程中,容器内压强先减小后不变
C.t=2 min时,X,Y的转化率相等
D.反应过程中,容器内混合气体的密度一直保持不变
您最近一年使用:0次
名校
9 . 将 4 mol A 气体和 2 mol B 气体在 2 L 的定容容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g) △H<0 ,经 2 s(秒)后测得 C 的浓度为 0. 6 mol·L-1 ,现有下列几种说法:①用物质 A 表示的反应的平均速率为 0.3 mol·L-1•s-1;②达到平衡状态时,升高温度,平衡逆向移动,化学平衡常数K减小;③2 s 时物质 A 的转化率为70% ;④达平衡时,增加A物质的量,平衡正向移动,A的转化率降低;⑤当B和C的生成速率相等时,该反应达到平衡状态。其中不正确的是( )
2C(g) △H<0 ,经 2 s(秒)后测得 C 的浓度为 0. 6 mol·L-1 ,现有下列几种说法:①用物质 A 表示的反应的平均速率为 0.3 mol·L-1•s-1;②达到平衡状态时,升高温度,平衡逆向移动,化学平衡常数K减小;③2 s 时物质 A 的转化率为70% ;④达平衡时,增加A物质的量,平衡正向移动,A的转化率降低;⑤当B和C的生成速率相等时,该反应达到平衡状态。其中不正确的是( )
 2C(g) △H<0 ,经 2 s(秒)后测得 C 的浓度为 0. 6 mol·L-1 ,现有下列几种说法:①用物质 A 表示的反应的平均速率为 0.3 mol·L-1•s-1;②达到平衡状态时,升高温度,平衡逆向移动,化学平衡常数K减小;③2 s 时物质 A 的转化率为70% ;④达平衡时,增加A物质的量,平衡正向移动,A的转化率降低;⑤当B和C的生成速率相等时,该反应达到平衡状态。其中不正确的是( )
2C(g) △H<0 ,经 2 s(秒)后测得 C 的浓度为 0. 6 mol·L-1 ,现有下列几种说法:①用物质 A 表示的反应的平均速率为 0.3 mol·L-1•s-1;②达到平衡状态时,升高温度,平衡逆向移动,化学平衡常数K减小;③2 s 时物质 A 的转化率为70% ;④达平衡时,增加A物质的量,平衡正向移动,A的转化率降低;⑤当B和C的生成速率相等时,该反应达到平衡状态。其中不正确的是( )| A.①③ | B.②⑤ | C.③⑤ | D.②③ |
您最近一年使用:0次
名校
10 . 某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )
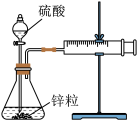

| A.用锌粒来表示10 s内该反应的速率为0.013 g/s |
| B.忽略锥形瓶内溶液体积的变化,用H+来表示10 s内该反应的速率为0.01 mol/(L·s) |
| C.忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内该反应的速率为0.01 mol/(L·s) |
| D.用H2来表示10 s内该反应的速率为0.000 2 mol/s |
您最近一年使用:0次
2018-10-06更新
|
1019次组卷
|
13卷引用:四川省阆中东风中学校2023-2024学年高二上学期第二次段考化学试题
四川省阆中东风中学校2023-2024学年高二上学期第二次段考化学试题江西省南康市南康中学2018-2019学年高二上学期第一次月考化学试题(已下线)2019年9月7日《每日一题》 选修4 周末培优四川省广安市岳池县顾县中学2019—2020学年第一学期高二上学期期中测试化学(选修四)试题安徽省合肥市2019—2020学年高二下学期期中考试化学试题(已下线)第15讲 化学反应速率-2021年高考化学一轮复习名师精讲练鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第3节 化学反应的速率 课时1 化学反应速率高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时1 化学反应速率选择性必修1 专题2 第一单元 课时1 化学反应速率的表示方法(已下线)6.1.1 化学反应速率(第1课时 化学反应速率的概念和简单计算)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)2.1.1化学反应速率的表示方法 课后作业(四) 化学反应速率(已下线)专题03 化学反应速率及影响因素、活化能【考题猜想】(9大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)



