解答题-原理综合题
|
适中(0.65)
|
1 . 我国氢能源汽车已经开始销售,氢能源的热值高、无污染,使其成为理想的能源,工业上量产化制氢原理是:CH4(g)+2H2O(g)  CO2(g)+4H2(g) ΔH=akJ/mol。
CO2(g)+4H2(g) ΔH=akJ/mol。
(1)相关化学键键能数据如下表所示。
则a=___________ 。
(2)关于上述反应中CO2产物的再利用一直是科研工作者研究的重点。工业上利用 CO2和 制备甲醇的原理是:CO2(g) + 3H2(g)
制备甲醇的原理是:CO2(g) + 3H2(g) H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和
H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和 初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。
初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。

①220℃时,经过2min达到M点,则该条件下0~2min内的平均反应速率
___________ ;无分子筛膜时,升高温度,反应速率 将
将___________ (选填“增大”、“减小” 或“不变”)。
②其他条件不变,有分子筛膜时甲醇的平衡产率总是高于没有分子筛膜,其原因可能是___________ 。
(3)工业上利用 CO2和H2制备甲醇的容器中存在的反应有:
反应Ⅰ:CO2(g) + 3H2(g) H2O(g) + CH3OH(g)
H2O(g) + CH3OH(g)
反应Ⅱ:CO2(g) + 4H2(g) 2H2O(g) + CH4(g)
2H2O(g) + CH4(g)
反应Ⅲ:2CO2(g) + 6H2(g) 4H2O(g) + C2H4(g)
4H2O(g) + C2H4(g)
为分析催化剂对反应的选择性,在1L恒容密闭容器中充入2.0 mol CO2和5.3mol H2。若测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示:

①该催化剂在较低温度时主要选择反应___________ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。
②研究发现,若温度过高,三种含碳产物的物质的量均会迅速降低,其主要原因可能是___________ 。
③在一定温度下达到平衡,此时测得容器中部分物质的含量 ,
,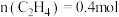 ,
,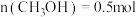 。则该温度下反应Ⅰ的平衡常数K=
。则该温度下反应Ⅰ的平衡常数K=_______  (结果保留两位小数)。
(结果保留两位小数)。
(4)研究人员研究出一种方法,可实现水泥生产时 零排放,其基本原理如图所示。温度小于
零排放,其基本原理如图所示。温度小于 时进行电解反应,碳酸钙先分解为
时进行电解反应,碳酸钙先分解为 和
和 ,电解质为熔融碳酸钠,阳极的电极反应为
,电解质为熔融碳酸钠,阳极的电极反应为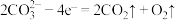 ,则阴极的电极反应为
,则阴极的电极反应为___________ 。
 CO2(g)+4H2(g) ΔH=akJ/mol。
CO2(g)+4H2(g) ΔH=akJ/mol。(1)相关化学键键能数据如下表所示。
| 化学键 | H-H | C=O | H-O | C-H |
 | 435 | 745 | 463 | 415 |
(2)关于上述反应中CO2产物的再利用一直是科研工作者研究的重点。工业上利用 CO2和
 制备甲醇的原理是:CO2(g) + 3H2(g)
制备甲醇的原理是:CO2(g) + 3H2(g) H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和
H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和 初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。
初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。
①220℃时,经过2min达到M点,则该条件下0~2min内的平均反应速率

 将
将②其他条件不变,有分子筛膜时甲醇的平衡产率总是高于没有分子筛膜,其原因可能是
(3)工业上利用 CO2和H2制备甲醇的容器中存在的反应有:
反应Ⅰ:CO2(g) + 3H2(g)
 H2O(g) + CH3OH(g)
H2O(g) + CH3OH(g) 反应Ⅱ:CO2(g) + 4H2(g)
 2H2O(g) + CH4(g)
2H2O(g) + CH4(g)反应Ⅲ:2CO2(g) + 6H2(g)
 4H2O(g) + C2H4(g)
4H2O(g) + C2H4(g) 为分析催化剂对反应的选择性,在1L恒容密闭容器中充入2.0 mol CO2和5.3mol H2。若测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示:

①该催化剂在较低温度时主要选择反应
②研究发现,若温度过高,三种含碳产物的物质的量均会迅速降低,其主要原因可能是
③在一定温度下达到平衡,此时测得容器中部分物质的含量
 ,
,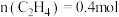 ,
,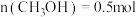 。则该温度下反应Ⅰ的平衡常数K=
。则该温度下反应Ⅰ的平衡常数K= (结果保留两位小数)。
(结果保留两位小数)。(4)研究人员研究出一种方法,可实现水泥生产时
 零排放,其基本原理如图所示。温度小于
零排放,其基本原理如图所示。温度小于 时进行电解反应,碳酸钙先分解为
时进行电解反应,碳酸钙先分解为 和
和 ,电解质为熔融碳酸钠,阳极的电极反应为
,电解质为熔融碳酸钠,阳极的电极反应为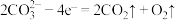 ,则阴极的电极反应为
,则阴极的电极反应为
您最近一年使用:0次
名校
2 . 煤的洁净技术(包括固硫技术和脱硫技术两类)可有效降低燃煤废气中SO2的含量,已成为我国解决环境问题的主导技术之一。
I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。生石灰是常用的固硫剂,固硫过程中涉及的部分反应如下:
①2CaO(s)+2SO2(g)+O2(g)⇌2CaSO4(s) ∆H1=−1004.0kJ/mol
②CaSO4(s)+CO(g)⇌CaO(s)+SO2(g)+CO2(g) ∆H2=+219.0kJ/mol
(1)表示CO燃烧热的热化学方程式是___________ 。
(2)结合上述反应,从物质用量考虑,在煤燃烧过程中要提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),可采用的最适宜方法是___________ 。
(3)某温度下,在一个恒容密闭容器中加入CaSO4(s)和CO(g),若只发生反应②,测得如下数据:
0~20min内v(SO2)=___________ ,此条件下该反应的平衡常数为___________ mol·L−1。
(4)实际生产中常用石灰石代替生石灰,石灰石吸收热量分解为生石灰,即CaCO3(s)⇌CaO(s)+CO2(g) ∆H>0。800℃下,在一个密闭容器中加入一定量的CaCO3(s)进行该反应,CO2气体的浓度变化如下图所示,t1和与t2时分别改变一个条件,则改变的条件依次是________ 和________ 。

II.除去燃煤产生的废气中的SO2的过程如图所示。

(5)过程①是SO2的部分催化氧化反应,若参加反应的SO2和O2的体积比为4∶3,则反应①的化学方程式为___________ 。
(6)已知:NO2(g)+SO2(g)⇌NO(g)+SO3(g) ∆H<0。向密闭容器中充入等体积的NO2和SO2,测得平衡状态时压强对数lgp(NO2)和lgp(SO3)的关系如图所示。

则T1___________ T2(填“>”、“<”或“=”)。
I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。生石灰是常用的固硫剂,固硫过程中涉及的部分反应如下:
①2CaO(s)+2SO2(g)+O2(g)⇌2CaSO4(s) ∆H1=−1004.0kJ/mol
②CaSO4(s)+CO(g)⇌CaO(s)+SO2(g)+CO2(g) ∆H2=+219.0kJ/mol
(1)表示CO燃烧热的热化学方程式是
(2)结合上述反应,从物质用量考虑,在煤燃烧过程中要提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),可采用的最适宜方法是
(3)某温度下,在一个恒容密闭容器中加入CaSO4(s)和CO(g),若只发生反应②,测得如下数据:
| t/min | 0 | 10 | 20 | 30 | 40 |
| c(CO)/(mol·L−1) | 2 | 1.5 | 1.1 | 0.8 | 0.8 |
0~20min内v(SO2)=
(4)实际生产中常用石灰石代替生石灰,石灰石吸收热量分解为生石灰,即CaCO3(s)⇌CaO(s)+CO2(g) ∆H>0。800℃下,在一个密闭容器中加入一定量的CaCO3(s)进行该反应,CO2气体的浓度变化如下图所示,t1和与t2时分别改变一个条件,则改变的条件依次是

II.除去燃煤产生的废气中的SO2的过程如图所示。

(5)过程①是SO2的部分催化氧化反应,若参加反应的SO2和O2的体积比为4∶3,则反应①的化学方程式为
(6)已知:NO2(g)+SO2(g)⇌NO(g)+SO3(g) ∆H<0。向密闭容器中充入等体积的NO2和SO2,测得平衡状态时压强对数lgp(NO2)和lgp(SO3)的关系如图所示。

则T1
您最近一年使用:0次
2022-03-22更新
|
202次组卷
|
2卷引用:四川省南充高级中学2021-2022学年高三上学期第四次月考理综化学试题
名校
解题方法
3 . NO2、NO、CO等是常见大气污染物,研究NO2、NO、CO等污染物的处理对建设美丽中国具有重要的意义。
(1)已知:①NO2(g)+CO(g)⇌CO2(g)+NO(g),断开1mol下列物质的所有化学键时所消耗能量分别为:
② N2(g)+
N2(g)+ O2(g)⇌NO(g)ΔH=+89.75kJ·mol-1
O2(g)⇌NO(g)ΔH=+89.75kJ·mol-1
③2NO(g)+O2(g)⇌2NO2(g)ΔH=-112.3kJ·mol-1
写出NO与CO反应生成无污染气体的热化学方程式:__ 。
(2)污染性气体NO2与CO在一定条件下的反应为2NO2(g)+4CO(g)⇌4CO2(g)+N2(g),某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1atm,5s时反应达到平衡,容器的压强变为原来的 ,则反应开始到平衡时CO的平均反应速率为ν(CO)=
,则反应开始到平衡时CO的平均反应速率为ν(CO)=_ ;若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol·L-1、0.4mol·L-1、0.1mol·L-1、1mol·L-1,要使反应向逆反应方向进行,a的取值范围为__ 。
(3)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)ΔH<0.现在向体积为2L的恒容密闭容器(如图甲所示)中通入1molCO和2molH2:

测定不同时刻、不同温度(T/℃)下容器中CO的物质的量如下表:
请回答:
①T1__ (填“>”或“<”或“=”)T2,理由是__ 。已知T2℃时,第20min时容器内压强不再改变,此时H2的转化率为___ ,该温度下的化学平衡常数为___ 。
②若将1molCO和2molH2通入原体积为2L的恒压密闭容器(如图乙所示)中,达平衡后再向容器中通入1molCH3OH(g),重新达到平衡后,CH3OH(g)在体系中的百分含量___ 。
(填“变大”、“变小”或“不变”)。
(1)已知:①NO2(g)+CO(g)⇌CO2(g)+NO(g),断开1mol下列物质的所有化学键时所消耗能量分别为:
| NO2 | CO | CO2 | NO |
| 812kJ | 1076kJ | 1490kJ | 632kJ |
 N2(g)+
N2(g)+ O2(g)⇌NO(g)ΔH=+89.75kJ·mol-1
O2(g)⇌NO(g)ΔH=+89.75kJ·mol-1③2NO(g)+O2(g)⇌2NO2(g)ΔH=-112.3kJ·mol-1
写出NO与CO反应生成无污染气体的热化学方程式:
(2)污染性气体NO2与CO在一定条件下的反应为2NO2(g)+4CO(g)⇌4CO2(g)+N2(g),某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1atm,5s时反应达到平衡,容器的压强变为原来的
 ,则反应开始到平衡时CO的平均反应速率为ν(CO)=
,则反应开始到平衡时CO的平均反应速率为ν(CO)=(3)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)ΔH<0.现在向体积为2L的恒容密闭容器(如图甲所示)中通入1molCO和2molH2:

测定不同时刻、不同温度(T/℃)下容器中CO的物质的量如下表:
| 温度 | 不同时刻容器中CO的物质的量 | ||||
| 0min | 10min | 20min | 30min | 40min | |
| T1 | 1mol | 0.8mol | 0.62mol | 0.4mol | 0.4mol |
| T2 | 1mol | 0.7mol | 0.5mol | a | a |
①T1
②若将1molCO和2molH2通入原体积为2L的恒压密闭容器(如图乙所示)中,达平衡后再向容器中通入1molCH3OH(g),重新达到平衡后,CH3OH(g)在体系中的百分含量
(填“变大”、“变小”或“不变”)。
您最近一年使用:0次
4 . 在1.0 L恒容密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g) Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是
Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是

 Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是
Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是 
| A.该温度下此反应的平衡常数K=3.2 |
| B.从反应开始到t1时的平均反应速率v(X)=0.2/t1 mol·L-1·min-1 |
| C.欲提高平衡体系中Y的百分含量,可加入一定量的X |
| D.其他条件不变,再充入0.1 mol气体X,平衡正向移动,X的转化率减少 |
您最近一年使用:0次
2019-02-20更新
|
993次组卷
|
8卷引用:四川省阆中中学2017-2018学年高二下学期第一次月考化学试题



