解题方法
1 . 已知:反应aA(g)+bB(g)⇌cC(g),某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
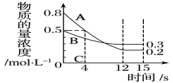
(1)经测定前4s内v(C)=0.05mol·L-1·s-1,则该反应的化学方程式为_______
(2)若上述反应分别在甲、乙、丙三个温度体积相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为:甲:v(A)=0.3mol·L-1·s-1;乙:v(B)=0.12mol·L-1·s-1;丙:v(C)=9.6mol·L-1·min-1。则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______ (用甲、乙、丙表示)。
(3)0~4s内,A的平均反应速率为_______ 。
(4)下列说法可以证明aA(g)+bB(g)⇌cC(g)已达平衡状态的是_______
A.单位时间内生成nmolA的同时消耗nmolB
B.混合气体的密度不再改变
C.反应速率v(A)=v(B)=v(C)
D.C的物质的浓度不再改变

(1)经测定前4s内v(C)=0.05mol·L-1·s-1,则该反应的化学方程式为
(2)若上述反应分别在甲、乙、丙三个温度体积相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为:甲:v(A)=0.3mol·L-1·s-1;乙:v(B)=0.12mol·L-1·s-1;丙:v(C)=9.6mol·L-1·min-1。则甲、乙、丙三个容器中反应速率由快到慢的顺序为
(3)0~4s内,A的平均反应速率为
(4)下列说法可以证明aA(g)+bB(g)⇌cC(g)已达平衡状态的是
A.单位时间内生成nmolA的同时消耗nmolB
B.混合气体的密度不再改变
C.反应速率v(A)=v(B)=v(C)
D.C的物质的浓度不再改变
您最近半年使用:0次
解题方法
2 . (1)在一定条件下,一定容积的密闭容器中进行反应:2SO2+O2 2SO3,能证明反应到达平衡的说法是:
2SO3,能证明反应到达平衡的说法是:___________ 。
A容器中压强不发生改变 B容器内气体密度不发生改变 C容器内气体平均相对分子质量不发生改变 D容器内气体颜色不发生改变 E容器内SO3气体质量不发生改变 F2v正(SO2)=v逆(O2)
(2)请按下表填空:
10min后,浓度c(SO2)=________ c(O2)=________
平均反应速率v(SO2)=________ v(O2)=________
(3)已知在该条件下每生成1molSO3(g)放出热量QkJ。若向容器中充入2molSO2(g)、2molO2(g),充分反应后放出热量为_______ kJ。
 2SO3,能证明反应到达平衡的说法是:
2SO3,能证明反应到达平衡的说法是:A容器中压强不发生改变 B容器内气体密度不发生改变 C容器内气体平均相对分子质量不发生改变 D容器内气体颜色不发生改变 E容器内SO3气体质量不发生改变 F2v正(SO2)=v逆(O2)
(2)请按下表填空:
| SO2 | O2 | SO3 | |
| 反应开始时的浓度/mol·L-1 | 3.0 | 1.5 | 0 |
| 10min后的浓度/mol·L-1 | |||
| 平均反应速率/mol·L-1·min-1 | 0.1 |
10min后,浓度c(SO2)=
平均反应速率v(SO2)=
(3)已知在该条件下每生成1molSO3(g)放出热量QkJ。若向容器中充入2molSO2(g)、2molO2(g),充分反应后放出热量为
您最近半年使用:0次
3 . I:已知:反应aA(g)+bB(g) ⇌cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
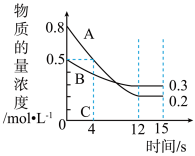
(1)经测定前4 s内v(C)=0.025 mol·L-1·s-1,则该反应的化学方程式为_______________ 。
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 0mol·L-1·s-1; 乙:v(B)=0.10 mol·L-1·s-1; 丙:v(C)=2.4mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______ (用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
(3)哪一时间段反应速率最大______ (填0~1、1~2、2~3、3~4、4~5、5~6 min,下同),原因是_____________ 。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________ (填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g) ⇌2HI(g)已达平衡状态的是________ 。
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)= v(HI)
v(HI)

(1)经测定前4 s内v(C)=0.025 mol·L-1·s-1,则该反应的化学方程式为
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 0mol·L-1·s-1; 乙:v(B)=0.10 mol·L-1·s-1; 丙:v(C)=2.4mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
| 时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
| 氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g) ⇌2HI(g)已达平衡状态的是
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=
 v(HI)
v(HI)
您最近半年使用:0次
名校
4 . 恒温恒容,4A(s)+3B(g) 2C(g)+D(g)经2min,B的浓度减少0.6mol•L-1,下列说法正确的是
2C(g)+D(g)经2min,B的浓度减少0.6mol•L-1,下列说法正确的是
 2C(g)+D(g)经2min,B的浓度减少0.6mol•L-1,下列说法正确的是
2C(g)+D(g)经2min,B的浓度减少0.6mol•L-1,下列说法正确的是| A.用A表示的反应速率是0.4mol•L-1•min-1 |
| B.气体的密度不再变化,则证明反应已经达到平衡状态 |
| C.2min末的反应速率v(B)=0.3mol•L-1•min-1 |
| D.分别用B、C表示反应的速率,其关系是:3v(B)=2v(C) |
您最近半年使用:0次
2023-04-22更新
|
276次组卷
|
2卷引用:四川省巴中市恩阳区2022-2023学年高二上学期1月期末化学试题
5 . Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
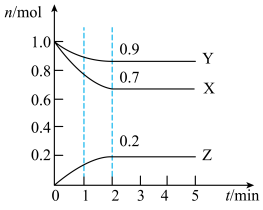
(1)反应开始至2min,以气体Z的浓度变化表示的平均反应速率为______ ;
(2)反应开始至2min,以气体X表示的转化率为______ ;
(3)将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足: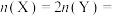
 ,则原混合气体中a:b=
,则原混合气体中a:b=______ 。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比。
(4)一定能证明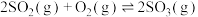 达到平衡状态的是
达到平衡状态的是______ (填序号,下同)。
(5)一定能证明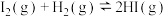 达到平衡状态的是
达到平衡状态的是______ 。

(1)反应开始至2min,以气体Z的浓度变化表示的平均反应速率为
(2)反应开始至2min,以气体X表示的转化率为
(3)将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:
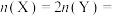
 ,则原混合气体中a:b=
,则原混合气体中a:b=Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比。
(4)一定能证明
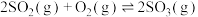 达到平衡状态的是
达到平衡状态的是(5)一定能证明
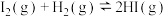 达到平衡状态的是
达到平衡状态的是
您最近半年使用:0次
解题方法
6 . 某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(1)该反应的化学方程式为_______ 。
(2)反应开始至2min,以气体Z表示的平均反应速率为_______ 。
(3)2min反应达到平衡,容器内混合气体的平均相对分子质量比起始时_______ (填“大”、“小”或“相等”下同),混合气体密度比起始时_______ 。
(4)下列叙述能证明该反应已经达到化学平衡状态的是(填序号)_______。

(1)该反应的化学方程式为
(2)反应开始至2min,以气体Z表示的平均反应速率为
(3)2min反应达到平衡,容器内混合气体的平均相对分子质量比起始时
(4)下列叙述能证明该反应已经达到化学平衡状态的是(填序号)_______。
| A.Y的体积分数不再变化 |
| B.容器内气体压强不再变化 |
| C.v(X):v(Y)=3:1 |
| D.单位时间内消耗3nmolX同时生成2nmolZ |
您最近半年使用:0次
7 . 恒温恒容条件下,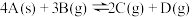 ,经
,经 ,B的浓度减少
,B的浓度减少 ,下列说法正确的是
,下列说法正确的是
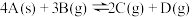 ,经
,经 ,B的浓度减少
,B的浓度减少 ,下列说法正确的是
,下列说法正确的是A.用A表示的反应速率是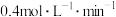 |
| B.气体的平均摩尔质量不再变化,则证明反应已经达到平衡状态 |
C. 末的反应速率 末的反应速率 |
D.分别用B、C表示反应的速率,其关系是: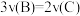 |
您最近半年使用:0次
名校
解题方法
8 . I.是关于化学反应2SO2+O2 2SO3的两个素材情景:
2SO3的两个素材情景:
素材1:某温度和压强下,2 升 密闭容器中,不同时间点测得密闭体系中三种物质的物质的量
素材2:反应在不同条件下进行时SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的物质的量分数,SO2的转化率越大,化学反应的限度越大)
根据以上的两个素材回答问题:
(1)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为_______ mol·L-1·s-1。
(2)根据素材2中分析得到,提高该化学反应限度(即提高反应物SO2转化率)的途径有_______ 。
(3)根据素材1、素材2中分析得到,要实现素材1中SO2的平衡转化率需控制的反应条件是_____ 。
(4) 在恒温恒容 的密闭容器中,发生反应2SO2(g)+O2(g) 2SO3(g),当下列物理量不再发生变化时:
2SO3(g),当下列物理量不再发生变化时:
①混合气体的压强
②混合气体的密度;
③混合气体的总物质的量;
④混合气体的平均相对分子质量;
⑤各反应物或生成物的反应速率之比等于化学计量数之比。
一定能证明2SO2(g)+O2(g) 2SO3(g)达到平衡状态的是
2SO3(g)达到平衡状态的是_________ (填序号)。
II.电池在通讯、交通及日常生活中有着广泛的应用。被称之为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,而在其另一边镀二氧化锰)作为传导体。在纸内的离子“流过”水和氧化锌组成的碱性电解液。电池总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH),则当0.1 mol 负极完全溶解时,转移电子个数为__________ ;该电池正极反应式为_____________ 。
 2SO3的两个素材情景:
2SO3的两个素材情景:素材1:某温度和压强下,
 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
 | 0.1 MPa | 0.5 MPa | 1 MPa | 10 MPa |
400 ℃ | 99.2 | 99.6 | 99.7 | 99.9 |
500 ℃ | 93.5 | 96.9 | 97.8 | 99.3 |
600 ℃ | 73.7 | 85.8 | 90.0 | 96.4 |
(1)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为
(2)根据素材2中分析得到,提高该化学反应限度(即提高反应物SO2转化率)的途径有
(3)根据素材1、素材2中分析得到,要实现素材1中SO2的平衡转化率需控制的反应条件是
(4) 在
 2SO3(g),当下列物理量不再发生变化时:
2SO3(g),当下列物理量不再发生变化时:①混合气体的压强
②混合气体的密度;
③混合气体的总物质的量;
④混合气体的平均相对分子质量;
⑤各反应物或生成物的反应速率之比等于化学计量数之比。
一定能证明2SO2(g)+O2(g)
 2SO3(g)达到平衡状态的是
2SO3(g)达到平衡状态的是II.电池在通讯、交通及日常生活中有着广泛的应用。被称之为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,而在其另一边镀二氧化锰)作为传导体。在纸内的离子“流过”水和氧化锌组成的碱性电解液。电池总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH),则当0.1 mol 负极完全溶解时,转移电子个数为
您最近半年使用:0次
名校
9 . (1)反应A+3B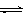 2C+2D在四种不同情况下的反应速率分别为:
2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15mol·L-1·s-1;②v(B)=0.6mol·L-1·s-1;
③v(C)=0.4mol·L-1·s-1;④v(D)=0.45mol·L-1·min-1。
该反应进行的快慢顺序为__ 。
(2)在密闭容器中进行可逆反应,A与B反应生成C,速率分别为:v1、v2、v3(mol·L-1·s-1),且v1、v2、v3之间有如下关系:v2=3v1,v3=2v1,则此反应的化学方程式表示为__ 。
(3)下列各项可以证明2HI(g)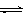 H2(g)+I2(g)已经达到平衡状态的是
H2(g)+I2(g)已经达到平衡状态的是__ 。
①单位时间内生成nmolI2的同时生成nmolHI;
②一个H—H键断裂的同时有两个H—I键断裂;
③百分组成ω(HI)=ω(H2)时;
④反应速率v(H2)=v(I2)=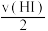 时;
时;
⑤c(H2)∶c(I2)∶c(HI)=1∶1∶2时;
⑥温度和体积一定,容器内压强不再变化时;
⑦温度和压强一定,混合气体的密度不再变化时;
⑧温度和体积一定,混合气体的颜色不再变化时。
(4)已知反应2HI(g)=H2(g)+I2(g)ΔH=11kJ·mol-1。1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为__ kJ。
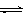 2C+2D在四种不同情况下的反应速率分别为:
2C+2D在四种不同情况下的反应速率分别为:①v(A)=0.15mol·L-1·s-1;②v(B)=0.6mol·L-1·s-1;
③v(C)=0.4mol·L-1·s-1;④v(D)=0.45mol·L-1·min-1。
该反应进行的快慢顺序为
(2)在密闭容器中进行可逆反应,A与B反应生成C,速率分别为:v1、v2、v3(mol·L-1·s-1),且v1、v2、v3之间有如下关系:v2=3v1,v3=2v1,则此反应的化学方程式表示为
(3)下列各项可以证明2HI(g)
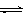 H2(g)+I2(g)已经达到平衡状态的是
H2(g)+I2(g)已经达到平衡状态的是①单位时间内生成nmolI2的同时生成nmolHI;
②一个H—H键断裂的同时有两个H—I键断裂;
③百分组成ω(HI)=ω(H2)时;
④反应速率v(H2)=v(I2)=
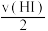 时;
时;⑤c(H2)∶c(I2)∶c(HI)=1∶1∶2时;
⑥温度和体积一定,容器内压强不再变化时;
⑦温度和压强一定,混合气体的密度不再变化时;
⑧温度和体积一定,混合气体的颜色不再变化时。
(4)已知反应2HI(g)=H2(g)+I2(g)ΔH=11kJ·mol-1。1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为
您最近半年使用:0次
2020-09-14更新
|
68次组卷
|
2卷引用:2015-2016学年浙江省湖州中学高一下学期期中考试化学试卷
名校
解题方法
10 . Ⅰ、某温度时,在一个 10L 的恒容容器中,X、Y、Z 均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
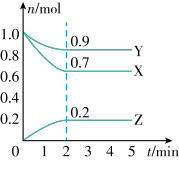
(1)该反应的化学方程式为:________________________ 。
(2)反应开始至 2min,以气体 Z 表示的平均反应速率为:____________________ 。
(3)将 a mol X 与 b mol Y 的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中 a∶b=________ 。
Ⅱ、在恒温恒容的密闭容器中,当下列物理量不再发生变化时:
①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比。
(1)一定能证明2SO2(g)+O2(g) ⇌2SO3(g)达到平衡状态的是__________________ 填序号,下同)。
(2)一定能证明 I2(g)+H2(g)⇌2HI(g)达到平衡状态的是____________________ 。
(3)一定能证明 A(s)+2B(g)⇌C(g)+D(g)达到平衡状态的是_________________ (B、C、D 均无色)。

(1)该反应的化学方程式为:
(2)反应开始至 2min,以气体 Z 表示的平均反应速率为:
(3)将 a mol X 与 b mol Y 的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中 a∶b=
Ⅱ、在恒温恒容的密闭容器中,当下列物理量不再发生变化时:
①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比。
(1)一定能证明2SO2(g)+O2(g) ⇌2SO3(g)达到平衡状态的是
(2)一定能证明 I2(g)+H2(g)⇌2HI(g)达到平衡状态的是
(3)一定能证明 A(s)+2B(g)⇌C(g)+D(g)达到平衡状态的是
您最近半年使用:0次
2020-05-25更新
|
161次组卷
|
2卷引用:辽宁省庄河市高级中学2019-2020学年高一下学期5月网考化学试题



