名校
解题方法
1 . 反应CH4(g)+CO2(g)=CH3COOH(g)在一定条件下可发生,该反应历程示意图如图所示。有人提出利用电化学处理,可提高能量的利用率,下列说法不正确的是
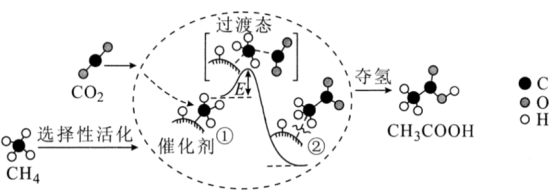

| A.若设计为原电池,则通入甲烷的电极为负极 |
| B.使用催化剂,可降低活化能和焓变,加快反应速率 |
| C.由图象可知①→②放出能量并形成了碳碳单键 |
| D.若设计为原电池,用稀硫酸作电解质溶液,正极反应为:2CO2+8e-+8H+=CH3COOH+2H2O |
您最近一年使用:0次
2021-04-14更新
|
337次组卷
|
4卷引用:宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题
宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题江西省六校2021届高三3月联合考试理综化学试题(已下线)2021年高考化学押题预测卷(广东卷)(01)(已下线)押山东卷第13题 陌生反应机理选择题-备战2021年高考化学临考题号押题(山东卷)
解题方法
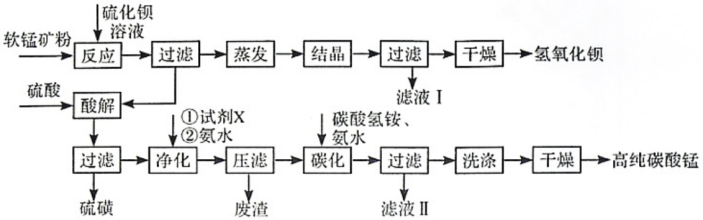
2 . 用软锰矿(主要成分为MnO2,所含杂质为质量分数约8%Fe3O4和约5%Al2O3)和BaS制备高纯MnCO3,同时制得Ba(OH)2,工艺流程如下:
已知:25℃时相关物质的Ksp见下表
回答下列问题:
(1)MnO2与BaS溶液反应转化为MnO的化学方程式为___________ ,能否通过加热的方式加快该反应的速率,___________ (填“能”或“否”)
(2)已知MnO2为两性氧化物,保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是___________ 。
(3)在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为___________ 。
(4)净化时需先加入的试剂X为___________ (填化学式) 。再使用氨水调溶液的pH,则pH的理论最小值为___________ (当溶液中某离子浓度小于1.0×10-5mol•L-1时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为___________ 。

已知:25℃时相关物质的Ksp见下表
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 |
(1)MnO2与BaS溶液反应转化为MnO的化学方程式为
(2)已知MnO2为两性氧化物,保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是
(3)在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为
(4)净化时需先加入的试剂X为
(5)碳化过程中发生反应的离子方程式为
您最近一年使用:0次
2021-03-14更新
|
445次组卷
|
3卷引用:宁夏石嘴山市2021届高三下学期3月高考质量监测(一模) 化学试题
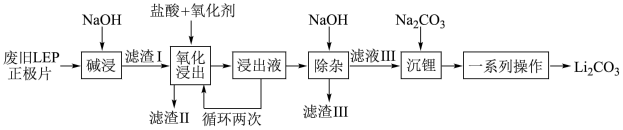
3 . 随着新能源汽车销量的猛增,动力电池退役高峰将至,磷酸铁锂(LFP)是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片( LiFePO4、导电石墨、铝箔)中回收锂的工艺流程如图:
已知:Li2CO3在水中的溶解度随温度升高而降低,但煮沸时发生水解。回答下列问题:
(1)在“碱浸”时,为加快浸出速率,下列措施不可行的是_______ (填标号)。
a.适当提高浸出温度
b.使用电动搅拌器
c.适当提高氢氧化钠的浓度
d.增大废料的颗粒
(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如表,实际生产中氧化剂选用H2O2,不选用 NaClO3的原因是______ 。在“氧化浸出”时,温度不宜超过50℃,其目的是________ 。“氧化浸出”时生成了难溶的FePO4,该反应的离子方程式为_________ 。
(3)“浸出液”循环两次的目的是________ 。
(4)“沉锂”的温度保持在95℃,最适宜的加热方式为________ 。“一系列操作”具体包括______ 、洗涤、干燥。
(5)“滤渣Ⅱ”经纯化可得FePO4,流程中生成的Li2CO3、FePO4在高温条件下与H2C2O4煅烧可得 LiFePO4,实现再生利用,其化学方程式为_________ 。

已知:Li2CO3在水中的溶解度随温度升高而降低,但煮沸时发生水解。回答下列问题:
(1)在“碱浸”时,为加快浸出速率,下列措施不可行的是
a.适当提高浸出温度
b.使用电动搅拌器
c.适当提高氢氧化钠的浓度
d.增大废料的颗粒
(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如表,实际生产中氧化剂选用H2O2,不选用 NaClO3的原因是
| 序号 | 锂含量/% | 氧化剂 | pH | 浸出液体Li浓度/(g·L-1) | 浸出渣中Li含量/% |
| 1 | 3.7 | H2O2 | 3.5 | 9.02 | 0.10 |
| 2 | 3.7 | NaClO3 | 3.5 | 9.05 | 0.08 |
| 3 | 3.7 | O2 | 3.5 | 7.05 | 0.93 |
| 4 | 3.7 | NaClO | 3.5 | 8.24 | 0.43 |
(4)“沉锂”的温度保持在95℃,最适宜的加热方式为
(5)“滤渣Ⅱ”经纯化可得FePO4,流程中生成的Li2CO3、FePO4在高温条件下与H2C2O4煅烧可得 LiFePO4,实现再生利用,其化学方程式为
您最近一年使用:0次
2020-11-02更新
|
507次组卷
|
3卷引用:宁夏银川一中2021届高三第三次月考理综化学试题



