名校
解题方法
1 . 合成氨工艺是人工固氮的重要途径,解决数亿人口生存问题。
(1)已知: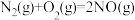
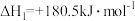




则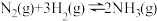 的
的
___________ 。
(2)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步 ;
; (慢反应)
(慢反应)
第二步 ;
; ;
; (快反应)
(快反应)
第三步 (快反应)
(快反应)
①第一步反应的活化能E1与第二步反应的活化能E2相比:E1>E2,请写出判断理由___________ 。
②下列关于该合成氨工艺的理解正确的是___________ (填标号)。
A.合成氨实际工业生产条件是高温、高压、合适的催化剂
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,不会改变平衡转化率
C.基于NH3有较强的分子间作用力,可将其液化,不断将液氨移去,有利于提高正反应速率
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(3)在一定条件下,向某反应容器中投入5molN2、15molH2,在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图所示:

①温度T1、T2、T3中,最大的是___________ ,M点H2的转化率为___________ 。
②1939年捷姆金和佩热夫推出合成氨反应在接近平衡时净速率方程式为: ,k1、k2分别为正反应和逆反应的速率常数;
,k1、k2分别为正反应和逆反应的速率常数;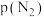 、
、 、
、 代表各组分的分压(分压=总压×物质的量分数);α为常数,工业上以铁为催化剂时,α=0.5。由M点数据计算
代表各组分的分压(分压=总压×物质的量分数);α为常数,工业上以铁为催化剂时,α=0.5。由M点数据计算
___________ MPa-2(保留两位有效数字)。
(4)将N2和H2以一定的流速,分别通过甲、乙两种催化剂进行反应,相同时间内测量逸出气体中N2的含量,从而确定N2的转化率,结果如图所示:
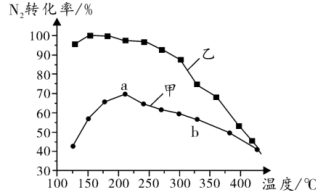
a点___________ (填“是”或“不是”)平衡状态,N2的转化率在a~b段呈现如图变化,可能的原因是___________ 。
(1)已知:
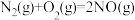
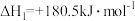




则
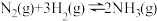 的
的
(2)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步
 ;
; (慢反应)
(慢反应)第二步
 ;
; ;
; (快反应)
(快反应)第三步
 (快反应)
(快反应)①第一步反应的活化能E1与第二步反应的活化能E2相比:E1>E2,请写出判断理由
②下列关于该合成氨工艺的理解正确的是
A.合成氨实际工业生产条件是高温、高压、合适的催化剂
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,不会改变平衡转化率
C.基于NH3有较强的分子间作用力,可将其液化,不断将液氨移去,有利于提高正反应速率
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(3)在一定条件下,向某反应容器中投入5molN2、15molH2,在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图所示:

①温度T1、T2、T3中,最大的是
②1939年捷姆金和佩热夫推出合成氨反应在接近平衡时净速率方程式为:
 ,k1、k2分别为正反应和逆反应的速率常数;
,k1、k2分别为正反应和逆反应的速率常数;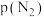 、
、 、
、 代表各组分的分压(分压=总压×物质的量分数);α为常数,工业上以铁为催化剂时,α=0.5。由M点数据计算
代表各组分的分压(分压=总压×物质的量分数);α为常数,工业上以铁为催化剂时,α=0.5。由M点数据计算
(4)将N2和H2以一定的流速,分别通过甲、乙两种催化剂进行反应,相同时间内测量逸出气体中N2的含量,从而确定N2的转化率,结果如图所示:

a点
您最近一年使用:0次
名校
2 . 环境科学研究发现, 也是一种温室效应气体,与
也是一种温室效应气体,与 相比,虽然
相比,虽然 在大气中的含量很低,增温潜势却是二氧化碳的298倍,对全球气候的增温效应在未来将越来越显著,已引起科学家的极大关注。
在大气中的含量很低,增温潜势却是二氧化碳的298倍,对全球气候的增温效应在未来将越来越显著,已引起科学家的极大关注。 的能量变化如上图所示,则无催化剂条件下该反应的逆反应的活化能为
的能量变化如上图所示,则无催化剂条件下该反应的逆反应的活化能为__________ ;在相同温度和压强下,1mol  和1mol CO经过相同反应时间测得如下实验数据:
和1mol CO经过相同反应时间测得如下实验数据:
试分析在相同温度时,催化剂2催化下 的转化率更高的原因是
的转化率更高的原因是___________ 。
(2)在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入0.1mol 、0.4mol CO和相同催化剂。实验测得A、B容器中
、0.4mol CO和相同催化剂。实验测得A、B容器中 的转化率随时间的变化关系如图所示:
的转化率随时间的变化关系如图所示: 的转化率随时间的变化关系是图中的
的转化率随时间的变化关系是图中的___________ 曲线(填“a”或“b”)。
②要缩短b曲线对应容器达到平衡的时间,但不改变 的平衡转化率,在催化剂一定的情况下可采取的措施是
的平衡转化率,在催化剂一定的情况下可采取的措施是___________ (答出一条即可)。
③500℃该反应的化学平衡常数K=___________ (用最简分数表示)。
④实验测定该反应的反应速率 ,
, ,
, 、
、 分别是正、逆反应速率常数,c为物质的量浓度,计算M处的
分别是正、逆反应速率常数,c为物质的量浓度,计算M处的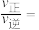
___________ (保留两位小数)。
 也是一种温室效应气体,与
也是一种温室效应气体,与 相比,虽然
相比,虽然 在大气中的含量很低,增温潜势却是二氧化碳的298倍,对全球气候的增温效应在未来将越来越显著,已引起科学家的极大关注。
在大气中的含量很低,增温潜势却是二氧化碳的298倍,对全球气候的增温效应在未来将越来越显著,已引起科学家的极大关注。
 的能量变化如上图所示,则无催化剂条件下该反应的逆反应的活化能为
的能量变化如上图所示,则无催化剂条件下该反应的逆反应的活化能为 和1mol CO经过相同反应时间测得如下实验数据:
和1mol CO经过相同反应时间测得如下实验数据:| 实验 | 温度/℃ | 催化剂 |  的转化率/% 的转化率/% |
| 实验1 | 400 | 催化剂1 | 9.5 |
| 400 | 催化剂2 | 10.6 | |
| 实验2 | 500 | 催化剂1 | 12.3 |
| 500 | 催化剂2 | 13.5 |
 的转化率更高的原因是
的转化率更高的原因是(2)在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入0.1mol
 、0.4mol CO和相同催化剂。实验测得A、B容器中
、0.4mol CO和相同催化剂。实验测得A、B容器中 的转化率随时间的变化关系如图所示:
的转化率随时间的变化关系如图所示:
 的转化率随时间的变化关系是图中的
的转化率随时间的变化关系是图中的②要缩短b曲线对应容器达到平衡的时间,但不改变
 的平衡转化率,在催化剂一定的情况下可采取的措施是
的平衡转化率,在催化剂一定的情况下可采取的措施是③500℃该反应的化学平衡常数K=
④实验测定该反应的反应速率
 ,
, ,
, 、
、 分别是正、逆反应速率常数,c为物质的量浓度,计算M处的
分别是正、逆反应速率常数,c为物质的量浓度,计算M处的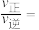
您最近一年使用:0次



