名校
解题方法
1 . 实验一:已知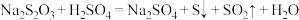 ,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。
,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。
设计如下(所取溶液体积均为10mL)。
(1)其他条件不变时,探究温度对化学反应速率的影响,应选择实验_____ (填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究_____ 对化学反应速率的影响。
实验二:已知 ,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响(实验内容及记录如下表)。
,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响(实验内容及记录如下表)。
(2)表中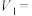
_____ ,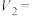
_____ 。
(3)利用实验1中数据计算,若用KMnO4溶液的浓度变化表示的反应速率为:
_____ 。
(4)在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是_____ 的影响。
(5)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入_____(填字母)。
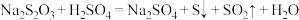 ,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。
,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计如下(所取溶液体积均为10mL)。
| 实验编号 | 实验温度/℃ |  |  |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
实验二:已知
 ,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响(实验内容及记录如下表)。
,乙同学通过室温下溶液颜色褪至无色所需时间,研究外界条件对化学反应速率的影响(实验内容及记录如下表)。| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 3mol/L稀硫酸 | 0.05mol/LKMnO4溶液 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 |  | 2.7 |
| 3 | 1.0 |  | 2.0 | 3.0 | 3.9 |
(3)利用实验1中数据计算,若用KMnO4溶液的浓度变化表示的反应速率为:

(4)在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是
(5)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入_____(填字母)。
| A.硫酸钾 | B.硫酸锰 | C.氯化锰 | D.水 |
您最近一年使用:0次
2023-10-27更新
|
55次组卷
|
3卷引用:四川省仁寿第一中学校(北校区)2023-2024学年高二上学期10月月考化学试题
名校
2 . 下列实验操作、实验现象及实验目的均正确的是
| 选项 | 实验操作 | 实验现象 | 实验目的 |
| A | 向2 mL 0.1 mol·L−1AgNO3溶液中先后加入5滴0.1 mol·L−1NaCl溶液和5滴0.1 mol·L−1 KI溶液 | 先出现白色沉淀,后出现黄色沉淀 | 证明Ksp(AgCl) > Ksp(AgI) |
| B | 向两支装有2 mL 5% H2O2溶液的试管中分别滴入0.1 mol·L−1 FeCl3溶液和0.1 mol·L−1 CuCl2溶液各1 mL(Cl−不影响催化效果) | 滴入FeCl3溶液的试管中产生气泡速率更快 | 证明Fe3+对H2O2分解的催化效果好于Cu2+ |
| C | 向加了酚酞的Na2CO3溶液中加适量蒸馏水 | 溶液红色变深 | Na2CO3溶液的水解平衡正向移动 |
| D | 向铁粉与稀硝酸反应后的溶液中滴入铁氰化钾溶液 | 溶液中出现带有特征蓝色的沉淀 | 溶液中含Fe2+,不含Fe3+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 用下列仪器或装置进行相应实验,能达到实验目的的是
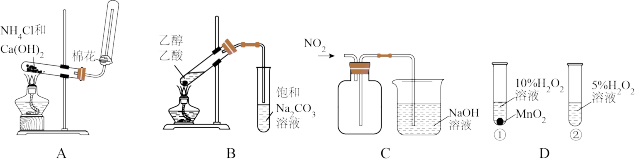

A.实验室制 | B.制备并收集乙酸乙酯 |
C.收集 气体 气体 | D.证明 是 是 分解的催化剂 分解的催化剂 |
您最近一年使用:0次
名校
4 . CO2催化加氢合成二甲醚(CH3OCH3)是一种CO2转化方法,反应原理为:
2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)
(1)加快该反应速率的措施有___________________ (填两条)。
(2)能证明上述反应达到平衡状态是____ (填标号)。
A.v正(CO2)=3v逆(H2) B.CH3OCH3的浓度不再改变
C.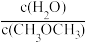 不再变化 D.混合气体的平均相对分子质量不再改变
不再变化 D.混合气体的平均相对分子质量不再改变
(3)某温度下,在体积为2 L的密闭容器中加入2 mol CO2与5 mol H2发生催化反应,经过10 min后CO2的浓度不再变化,测得其体积分数为20%。试计算:
①在0~10 min时段,用CH3OCH3表示的平均反应速率____ 。
②起始状态与平衡状态容器内的压强之比____ 。(无计算过程不给分)
2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)
(1)加快该反应速率的措施有
(2)能证明上述反应达到平衡状态是
A.v正(CO2)=3v逆(H2) B.CH3OCH3的浓度不再改变
C.
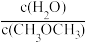 不再变化 D.混合气体的平均相对分子质量不再改变
不再变化 D.混合气体的平均相对分子质量不再改变(3)某温度下,在体积为2 L的密闭容器中加入2 mol CO2与5 mol H2发生催化反应,经过10 min后CO2的浓度不再变化,测得其体积分数为20%。试计算:
①在0~10 min时段,用CH3OCH3表示的平均反应速率
②起始状态与平衡状态容器内的压强之比
您最近一年使用:0次
2021-07-15更新
|
355次组卷
|
2卷引用:四川省绵阳市2020-2021学年高一下学期期末考试化学试题
21-22高一·全国·课时练习
解题方法
5 . 已知FeCl3溶液能对双氧水分解起催化作用,设计实验证明FeCl3溶液能催化双氧水的分解___ 。
您最近一年使用:0次
名校
6 . 利用下列图示装置进行实验,能达到相应目的的是


| A.用甲比较氯、碳、硅的非金属性强弱 |
| B.用乙制备BaSO3 |
| C.用丙证明苯与液溴反应产生了HBr |
| D.用丁研究催化剂对化学反应速率的影响 |
您最近一年使用:0次
2021-07-14更新
|
207次组卷
|
3卷引用:四川省绵阳市2020-2021学年高一下学期期末考试化学试题
名校
7 . 将浓度均为0.01 mol/L的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
已知该“碘钟实验”的总反应为H2O2+2S2O +2H+=S4O
+2H+=S4O +2H2O,反应分A、B两步进行。
+2H2O,反应分A、B两步进行。
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:......
(1)反应B的离子方程式为_______ ,对于总反应,I-的作用相当于_______
(2)为了证明反应A、B的存在,进行实验Ⅰ:
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色;
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
则试剂X应该为_______
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。(溶液浓度均为0.01 mol/L)
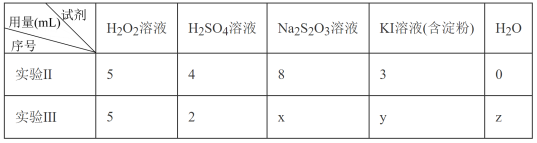
结果为溶液从混合时的无色变为蓝色的时间:实验Ⅱ<实验Ⅲ
① 实验Ⅲ中,x、y、z所对应的数值分别是_______
② 对比实验Ⅱ、实验Ⅲ,可得出的实验结论是_______
已知该“碘钟实验”的总反应为H2O2+2S2O
 +2H+=S4O
+2H+=S4O +2H2O,反应分A、B两步进行。
+2H2O,反应分A、B两步进行。反应A:H2O2+2I-+2H+=I2+2H2O
反应B:......
(1)反应B的离子方程式为
(2)为了证明反应A、B的存在,进行实验Ⅰ:
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色;
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
则试剂X应该为_______
| A.KI | B.H2SO4、 | C.KI、淀粉 | D.Na2S2O3溶液、淀粉 |

结果为溶液从混合时的无色变为蓝色的时间:实验Ⅱ<实验Ⅲ
① 实验Ⅲ中,x、y、z所对应的数值分别是
② 对比实验Ⅱ、实验Ⅲ,可得出的实验结论是
您最近一年使用:0次
2021-08-13更新
|
182次组卷
|
2卷引用:重庆市第七中学校2020-2021学年高一下学期半期考试化学试题
名校
解题方法
8 . 设计实验测定锌与硫酸反应的速率,按下列实验步骤完成实验:

①按图示安装装置,加入锌粒,然后快速加入40mL1mol/L的硫酸溶液,测量收集10mLH2所用的时间。
②按图示再安装一套装置,加入与前一套装置相同的锌粒,然后再快速加入40mL4mol/L的硫酸溶液,测量收集10mLH2所用的时间。
回答下列问题:
(1)实验所用仪器有:锥形瓶、双孔塞、分液漏斗、直角导气管、50mL注射器、铁架台、________ 。
(2)观察到的现象是:____________________________________ ;
收集10mL气体②所用时间比①所用时间________ 。
(3)所能得出的实验结论是:_________________________________ 。
(4)若在①实验中加入适量MnO2,则:________
A.如果①比②速率慢,则证明MnO2无催化作用
B.如果①比②速率快,则不能证明MnO2有无催化作用
C.如果①比②速率慢,则不能证明MnO2有无催化作用
D.如果①比②速率快,则证明MnO2有催化作用

①按图示安装装置,加入锌粒,然后快速加入40mL1mol/L的硫酸溶液,测量收集10mLH2所用的时间。
②按图示再安装一套装置,加入与前一套装置相同的锌粒,然后再快速加入40mL4mol/L的硫酸溶液,测量收集10mLH2所用的时间。
回答下列问题:
(1)实验所用仪器有:锥形瓶、双孔塞、分液漏斗、直角导气管、50mL注射器、铁架台、
(2)观察到的现象是:
收集10mL气体②所用时间比①所用时间
(3)所能得出的实验结论是:
(4)若在①实验中加入适量MnO2,则:
A.如果①比②速率慢,则证明MnO2无催化作用
B.如果①比②速率快,则不能证明MnO2有无催化作用
C.如果①比②速率慢,则不能证明MnO2有无催化作用
D.如果①比②速率快,则证明MnO2有催化作用
您最近一年使用:0次
2020-10-14更新
|
239次组卷
|
2卷引用:黑龙江省哈尔滨市第六中学2020-2021学年高二10月月考化学试题
9 . 证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,用下图所示装置进行实验,实验时均以生成相同状况下25mL气体为准,其他可能影响实验的因素均已忽略,相关数据如表所示:
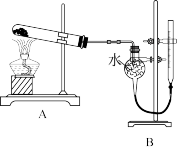
回答下列问题:
(1)上述实验中的“待测数据”是指__________ 。
(2)若要证明实验②中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住装置B中的乳胶管,拔去干燥管上的单孔像皮塞,____________________ 。
(3)若a__________ b(填“>”“=”或“<”),则可证明氧化铜能加快氯酸钾的分解。

| 实验序号 |  质量 质量 | 其他物质质量 | 待测数据 |
| ① | 1.2g | a | |
| ② | 1.2g | CuO 0.5g | b |
| ③ | 1.2g |  0.5g 0.5g | c |
回答下列问题:
(1)上述实验中的“待测数据”是指
(2)若要证明实验②中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住装置B中的乳胶管,拔去干燥管上的单孔像皮塞,
(3)若a
您最近一年使用:0次
解题方法
10 . 硫化氢的转化是资源利用和环境保护的重要研究课题。将 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收S,其转化如图所示(
的混合溶液中回收S,其转化如图所示( 不溶于水)。下列说法
不溶于水)。下列说法不正确 的是
 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收S,其转化如图所示(
的混合溶液中回收S,其转化如图所示( 不溶于水)。下列说法
不溶于水)。下列说法
A.过程①中,生成 的反应为 的反应为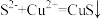 |
| B.过程②中,S是氧化产物 |
| C.转化过程中,存在极性共价键的断裂和生成 |
D.回收S的总反应为 |
您最近一年使用:0次



