名校
1 . 一定条件下的恒容密闭容器中,发生可逆反应: 。下列说法错误的是
。下列说法错误的是
 。下列说法错误的是
。下列说法错误的是| A.SO2不可能100%地转化为SO3 |
| B.当混合气体密度保持不变时,可判定该可逆反应达到平衡状态 |
| C.使用催化剂可增大反应速率,提高生产效率 |
| D.升高温度,该反应正反应速率和逆反应速率均增大 |
您最近一年使用:0次
2 . 其他条件不变时,下列有关影响反应速率的因素,不正确的是
| A.使用适当催化剂能加快化学反应速率 |
| B.增大压强一定能加快化学反应速率 |
| C.升高温度能加快化学反应速率 |
| D.将块状固体反应物研磨成粉末,能加快反应速率 |
您最近一年使用:0次
名校
解题方法
3 . 铁的配合物离子催化某反应的一种反应机理和相对能量的变化情况如图所示
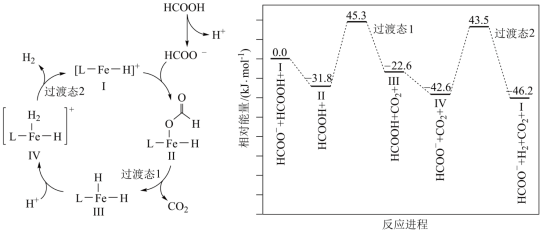
| A.总反应速率由Ⅳ→Ⅰ决定 |
B. 浓度过大会导致反应Ⅰ→Ⅱ速率加快 浓度过大会导致反应Ⅰ→Ⅱ速率加快 |
| C.该过程中铁的配合物离子催化剂不能提高平衡转化率 |
D.总反应为 |
您最近一年使用:0次
2023-07-05更新
|
368次组卷
|
3卷引用:湖南省怀化市2022-2023学年高二下学期期末考试化学试题
解题方法
4 . 某些物质间的转化关系如图所示。下列说法错误的是
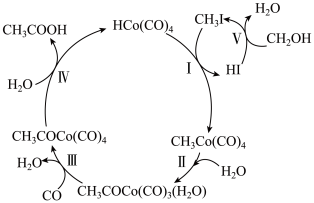

| A.该转化关系的总反应原子利用率为100% |
B.HI、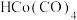 是该转化过程中的催化剂 是该转化过程中的催化剂 |
| C.Ⅳ的反应类型为取代反应 |
| D.转化过程中有非极性键的断裂和生成 |
您最近一年使用:0次
名校
5 . 已知H2O2(aq)分解为H2O(l)和O2(g)的能量变化如图曲线A所示,若在H2O2溶液中加入少量KI,则H2O2的分解过程可表示为:①H2O2+I-=H2O+IO-,②H2O2+IO-=H2O+O2+I-,其能量变化如图曲线B所示。下列有关说法不正确 的是
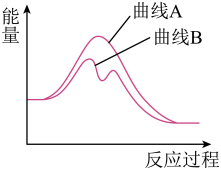

| A.上述反应①为吸热反应,反应②为放热反应 |
| B.2molH2O2(aq)具有的能量大于2molH2O(l)和1molO2(g)具有的总能量 |
| C.I-在H2O2分解过程中起到催化剂作用 |
| D.催化剂不参与化学反应,反应前后性质、质量不变 |
您最近一年使用:0次
2023-05-05更新
|
347次组卷
|
4卷引用:湖南省长沙市长沙县、望城区、浏阳市2022-2023学年高一下学期期末考试化学试题
名校
解题方法
6 . 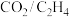 耦合反应制备丙烯酸甲酯的机理如图所示。下列叙述错误的是
耦合反应制备丙烯酸甲酯的机理如图所示。下列叙述错误的是

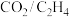 耦合反应制备丙烯酸甲酯的机理如图所示。下列叙述错误的是
耦合反应制备丙烯酸甲酯的机理如图所示。下列叙述错误的是
| A.由步骤①②知:加成反应也可生成酯类物质 |
| B.反应过程中存在C-H键的断裂 |
| C.该反应的原子利用率为100% |
D.若将步骤②中 换为 换为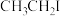 ,则产品将变为丙烯酸乙酯 ,则产品将变为丙烯酸乙酯 |
您最近一年使用:0次
2023-05-04更新
|
439次组卷
|
4卷引用:湖南省长沙市浏阳市2022-2023学年高二下学期期末考试化学试题
湖南省长沙市浏阳市2022-2023学年高二下学期期末考试化学试题福建省福州第一中学2022-2023学年高二下学期期末考试化学试题福建省厦门第一中学2023届高三下学期第三次模拟测试化学试题(已下线)考点01 物质的分类和转化(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
7 . TiO2可以催化分解CO2实现碳元素的循环利用,其催化反应机理如图。下列说法错误的是
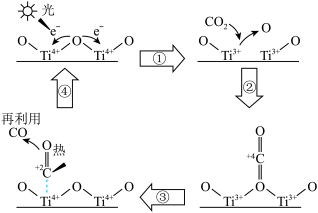

| A.过程①中TiO2发生了还原反应 |
| B.使用TiO2催化剂可以大大降低CO2分解的反应热 |
| C.该反应消耗了光能和热能 |
| D.该反应过程产生的O原子可能结合成O2 |
您最近一年使用:0次
名校
8 . 下列图示与对应的叙述正确的是
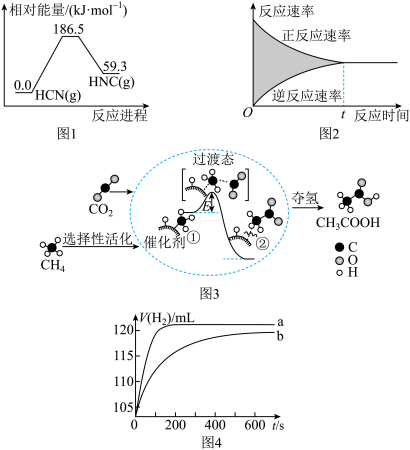

| A.图1所示曲线表示HCN(g)转化为HNC(g)需要吸收59.3kJ的能量 |
| B.图2所示的阴影部分面积可表示正反应速率的改变值 |
| C.图3所示曲线中状态①的物质比状态②的物质稳定 |
| D.图4是其他条件相同时,镁条与不同浓度盐酸反应曲线,其中曲线a表示的盐酸浓度比曲线b大 |
您最近一年使用:0次
2023-04-13更新
|
302次组卷
|
4卷引用:湖南省郴州市2022-2023学年高一下学期期末考试(选择考)化学试题
解题方法
9 . 在恒容密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,其速率-时间图像如下,则t1时刻改变的条件可能是
2SO3(g) ΔH<0,其速率-时间图像如下,则t1时刻改变的条件可能是
 2SO3(g) ΔH<0,其速率-时间图像如下,则t1时刻改变的条件可能是
2SO3(g) ΔH<0,其速率-时间图像如下,则t1时刻改变的条件可能是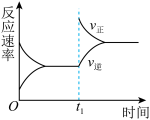
| A.升高温度 | B.加入催化剂 |
| C.充入一定量的氧气 | D.充入一定量的氦气 |
您最近一年使用:0次
2023-02-13更新
|
830次组卷
|
5卷引用:湖南省益阳市2020-2021学年高二上学期期末考试化学试题
湖南省益阳市2020-2021学年高二上学期期末考试化学试题(已下线)专题一 化学反应速率图象(讲)【精品卷】2.1.2 影响化学反应速率的因素课堂例题-人教版2023-2024学年选择性必修1(已下线)题型12 化学平衡图表分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)提升练04 化学平衡图像分析-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
10 . 随着经济的发展,能源与环境问题越来越受到人们的重视和关注,资源利用和环境保护是当前重要研究课题,回答下列问题:
(1)合成气( 、
、 、
、 )在工业上可用来生产甲醇,有关反应的热化学方程式及不同温度下的化学平衡常数如表所示:
)在工业上可用来生产甲醇,有关反应的热化学方程式及不同温度下的化学平衡常数如表所示:
则反应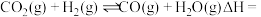
_______  (用含a、b代数式表示),
(用含a、b代数式表示),
_______ 0(填“>”或“<”)。
(2)科学家提出利用 与
与 制备“合成气”(
制备“合成气”( 、
、 ),可能的反应历程如下图所示:
),可能的反应历程如下图所示:
注: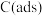 表示吸附性活性炭,E表示相对总能量,
表示吸附性活性炭,E表示相对总能量, 表示过渡态。
表示过渡态。
若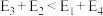 则决定制备“合成气”反应速率的化学方程式为
则决定制备“合成气”反应速率的化学方程式为_______ 。
(3)一定条件下,向密闭容器中通入一定量的 和
和 制备甲醇,投料比
制备甲醇,投料比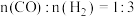 ,反应为
,反应为 ;测得容器内总压强与反应时间的关系如下图所示。
;测得容器内总压强与反应时间的关系如下图所示。
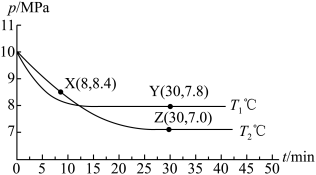
①X点的逆反应速率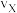 (逆)与Y点的正反应速率
(逆)与Y点的正反应速率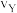 (正)的大小关系:
(正)的大小关系: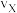 (逆)
(逆)_______ 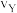 (正)(填“>”、“<”或“=”)。
(正)(填“>”、“<”或“=”)。
②图中Z点的压强平衡常数
_______ 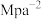 (保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)利用电化学方法通过微生物电催化将 有效地转化为
有效地转化为 ,装置如图所示。
,装置如图所示。
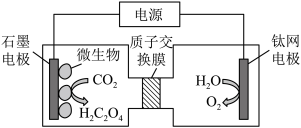
阴极区电极反应式为_______ ;当体系的温度升高到一定程度,电极反应的速率反而迅速下降,其主要原因是_______ 。装置工作时,阴极区除生成 外,还可能生成副产物并降低电解效率。已知:电解效率
外,还可能生成副产物并降低电解效率。已知:电解效率 ,标准状况下,当右池生成氧气体积为
,标准状况下,当右池生成氧气体积为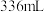 时,测得左池
时,测得左池 的物质的量为
的物质的量为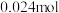 ,则电解效率为
,则电解效率为_______ 。
(1)合成气(
 、
、 、
、 )在工业上可用来生产甲醇,有关反应的热化学方程式及不同温度下的化学平衡常数如表所示:
)在工业上可用来生产甲醇,有关反应的热化学方程式及不同温度下的化学平衡常数如表所示:| 热化学方程式 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
Ⅰ.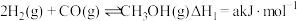 |  | 2.50 | 0.340 | 0.150 |
Ⅱ.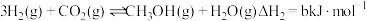 |  | 2.50 | 0.578 | 0.378 |
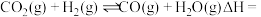
 (用含a、b代数式表示),
(用含a、b代数式表示),
(2)科学家提出利用
 与
与 制备“合成气”(
制备“合成气”( 、
、 ),可能的反应历程如下图所示:
),可能的反应历程如下图所示: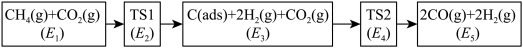
注:
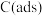 表示吸附性活性炭,E表示相对总能量,
表示吸附性活性炭,E表示相对总能量, 表示过渡态。
表示过渡态。若
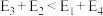 则决定制备“合成气”反应速率的化学方程式为
则决定制备“合成气”反应速率的化学方程式为(3)一定条件下,向密闭容器中通入一定量的
 和
和 制备甲醇,投料比
制备甲醇,投料比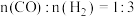 ,反应为
,反应为 ;测得容器内总压强与反应时间的关系如下图所示。
;测得容器内总压强与反应时间的关系如下图所示。
①X点的逆反应速率
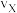 (逆)与Y点的正反应速率
(逆)与Y点的正反应速率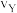 (正)的大小关系:
(正)的大小关系: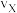 (逆)
(逆)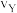 (正)(填“>”、“<”或“=”)。
(正)(填“>”、“<”或“=”)。②图中Z点的压强平衡常数

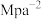 (保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(4)利用电化学方法通过微生物电催化将
 有效地转化为
有效地转化为 ,装置如图所示。
,装置如图所示。
阴极区电极反应式为
 外,还可能生成副产物并降低电解效率。已知:电解效率
外,还可能生成副产物并降低电解效率。已知:电解效率 ,标准状况下,当右池生成氧气体积为
,标准状况下,当右池生成氧气体积为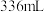 时,测得左池
时,测得左池 的物质的量为
的物质的量为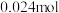 ,则电解效率为
,则电解效率为
您最近一年使用:0次
2023-02-11更新
|
112次组卷
|
2卷引用:湖南省怀化市2022-2023学年高二上学期期末考试化学试题



