名校
1 . 某学习小组利用5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O来探究“外界条件对化学反应速率的影响”。实验时,先分别量取KMnO4酸性溶液、H2C2O4(一种弱酸)溶液,然后倒入大试管中迅速振荡,通过测定褪色所需时间来判断反应的快慢。
(1)下列因素能加快该反应速率的是___________。
(2)为了观察到紫色褪去,如果H2C2O4与KMnO4溶液的体积相同,则它们初始物质的量浓度需要满足的关系为:c(H2C2O4):c(KMnO4)___________ 。
(3)甲同学设计了如下实验
①探究温度对化学反应速率影响的组合实验编号是___________ 。
②已知b实验生成CO2体积随时间的变化曲线如图,请在图中画出a实验生成CO2体积随时间的变化曲线。___________

③实验b测得混合后溶液褪色的时间为30s,忽略混合前后体积的微小变化,则这段时间平均反应速率v(H2C2O4)=___________ (保留3位有效数字)。
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
①乙同学据此提出以下假设:
假设1:___________ 。
假设2:生成Mn2+对反应有催化作用
假设3:生成CO2对反应有催化作用
假设4:反应生成的K+或 该反应有催化作用
该反应有催化作用
丙同学认为假设4不合理,其理由是___________ 。
②丁同学用如下实验证明假设2成立:在A和B二试管中分别加入4mL0.2mol·L-1草酸溶液,再在A试管中加入lmL0.1mol·L-1MnSO4溶液、B试管中加入___________ mL蒸馏水,然后在两支试管中同时分别加入1mL0.1mol·L-1KMnO4酸性溶液。预期的实验现象是___________ 。在B试管中加入蒸馏水的目的是___________ 。同学们认为不宜用MnCl2溶液代替MnSO4溶液对该反应进行催化探究,其原因是(用离子方程式表示)___________ 。
(1)下列因素能加快该反应速率的是___________。
| A.加入少量K2SO4固体 | B.加入少量NaCl固体 |
| C.增大压强 | D.加入少量Na2C2O4固体 |
(2)为了观察到紫色褪去,如果H2C2O4与KMnO4溶液的体积相同,则它们初始物质的量浓度需要满足的关系为:c(H2C2O4):c(KMnO4)
(3)甲同学设计了如下实验
| 实验 编号 | H2C2O4溶液 | KMnO4溶液 | 温度/℃ | 褪色时间/s | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | |||
| a | 0.10 | 2.0 | 0.010 | 4.0 | 25 | t1 |
| b | 0.20 | 2.0 | 0.010 | 4.0 | 25 | t2 |
| c | 0.20 | 2.0 | 0.010 | 4.0 | 50 | t3 |
②已知b实验生成CO2体积随时间的变化曲线如图,请在图中画出a实验生成CO2体积随时间的变化曲线。

③实验b测得混合后溶液褪色的时间为30s,忽略混合前后体积的微小变化,则这段时间平均反应速率v(H2C2O4)=
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
①乙同学据此提出以下假设:
假设1:
假设2:生成Mn2+对反应有催化作用
假设3:生成CO2对反应有催化作用
假设4:反应生成的K+或
 该反应有催化作用
该反应有催化作用丙同学认为假设4不合理,其理由是
②丁同学用如下实验证明假设2成立:在A和B二试管中分别加入4mL0.2mol·L-1草酸溶液,再在A试管中加入lmL0.1mol·L-1MnSO4溶液、B试管中加入
您最近一年使用:0次
解题方法
2 . 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
(1)补全方程式:_______ 。
5 H2C2O4+2 +_______=2Mn2++_______+8H2O
+_______=2Mn2++_______+8H2O
(2)实验过程使用了“控制变量法”,则V1=_______ ,V2=_______ ;根据上表中的实验数据,可以得到的结论是_______ 。
(3)该小组同学查阅已有的资料后,提出假设:生成物中的MnSO4为该反应的催化剂,请你帮助该小组同学完成实验方案验证假设。
①再向试管中加入的少量固体的化学式为_______ 。
②若该小组同学提出的假设成立,应观察到的现象是_______ 。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 2.0mol∙L-1 H2C2O4溶液 | H2O | 0.2mol∙L-1 KMnO4 | 3mol∙L-1稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | V1 | 4.0 |
| 2 | 2.0 | V2 | 3.0 | 2.0 | 5.2 |
| 3 | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
5 H2C2O4+2
 +_______=2Mn2++_______+8H2O
+_______=2Mn2++_______+8H2O(2)实验过程使用了“控制变量法”,则V1=
(3)该小组同学查阅已有的资料后,提出假设:生成物中的MnSO4为该反应的催化剂,请你帮助该小组同学完成实验方案验证假设。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 2.0mol∙L-1 H2C2O4溶液 | H2O | 0.2mol∙L-1 KMnO4溶液 | 3mol∙L-1稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | _______ | t |
②若该小组同学提出的假设成立,应观察到的现象是
您最近一年使用:0次
3 . 某化学兴趣小组,利用NaHSO3溶液和酸性KMnO4溶液(使用稀H2SO4酸化)反应探究外界因素对化学反应速率的影响。
Ⅰ.原理分析:
(1)反应过程中 被氧化为
被氧化为 ,
, 被还原为Mn2+,请写出实验过程中的离子方程式
被还原为Mn2+,请写出实验过程中的离子方程式_______________ 。
(2)实验过程中,NaHSO3的用量要保证足量,通过比较________ (填“实验现象”)所需时间的长短来判断反应的快慢。
Ⅱ.实验过程
该化学兴趣小组设计如下实验方案:
(3)对比实验①②,使用探究________ 对化学反应速率的影响;若实验②③是用来探究温度对化学反应速率的影响,则V1=________ mL。
(4)若t1=25s,则用HSO 表示实验①的化学反应速率v(
表示实验①的化学反应速率v( )=
)= ________ 。
Ⅲ.实验分析和探究
该化学兴趣小组通过反复实验发现,该反应的化学反应速率总是先增大后减小,该化学兴趣小组猜想可能有两个原因,并作出了猜想:
猜想1:该反应放热,使溶液温度升高,化学反应速率加快
猜想2:新生成的微粒Mn2+对该反应有催化的作用
该化学兴趣小组,通过监测实验①反应过程的温度变化情况,数据显示反应过程中混合溶液的温度基本保持不变,排除猜想1的可能性。并设计第④组实验验证猜想2。设计如下:
(5)为了实验结论的可靠性,试剂X应该选择________。
(6)实验后,若t4_____ t1(填“大于”、“小于”或 “等于”),说明猜想2成立。
Ⅰ.原理分析:
(1)反应过程中
 被氧化为
被氧化为 ,
, 被还原为Mn2+,请写出实验过程中的离子方程式
被还原为Mn2+,请写出实验过程中的离子方程式(2)实验过程中,NaHSO3的用量要保证足量,通过比较
Ⅱ.实验过程
该化学兴趣小组设计如下实验方案:
| 编号 | 实验温度/℃ | 所用试剂的体积/mL | 达到(2)中现象所需时间/min | ||
| 0.6mol/L NaHSO3溶液 | 0.2mol/L酸性KMnO4溶液 | 水 | |||
| ① | 25 | 20 | 20 | 10 | t1 |
| ② | 25 | 25 | 20 | 5 | t2 |
| ③ | 50 | V1 | 20 | 5 | t3 |
(3)对比实验①②,使用探究
(4)若t1=25s,则用HSO
 表示实验①的化学反应速率v(
表示实验①的化学反应速率v( )=
)= Ⅲ.实验分析和探究
该化学兴趣小组通过反复实验发现,该反应的化学反应速率总是先增大后减小,该化学兴趣小组猜想可能有两个原因,并作出了猜想:
猜想1:该反应放热,使溶液温度升高,化学反应速率加快
猜想2:新生成的微粒Mn2+对该反应有催化的作用
该化学兴趣小组,通过监测实验①反应过程的温度变化情况,数据显示反应过程中混合溶液的温度基本保持不变,排除猜想1的可能性。并设计第④组实验验证猜想2。设计如下:
| 编号 | 实验温度/℃ | 所用试剂的体积/mL | 达到(2)中现象所需时间/min | ||
| 0.5mol/L NaHSO3溶液 | 0.2mol/L 酸性KMnO4溶液 | 试剂X | |||
| ④ | 25 | 20 | 20 | 10 | t4 |
(5)为了实验结论的可靠性,试剂X应该选择________。
| A.MnCl2溶液 | B.MnSO4溶液 |
| C.Mn(NO3)2溶液 | D.Mn(HSO3)2溶液 |
(6)实验后,若t4
您最近一年使用:0次
解题方法
4 . 实验小组探究Cu和 溶液的反应原理。
溶液的反应原理。
(1)配制溶液
用 标准试剂配制
标准试剂配制 溶液,下列仪器中无需使用的有
溶液,下列仪器中无需使用的有_______ (填名称)。
(2)测定 溶液的pH
溶液的pH
用_______ (填仪器名称)测得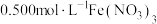 溶液的pH为1.10。
溶液的pH为1.10。
(3)提出假设
假设ⅰ:_______ ,反应的离子方程式为:
假设ⅱ: 将Cu氧化,反应的离子方程式为:
将Cu氧化,反应的离子方程式为:
(4)实验探究
实验Ⅰ:向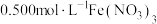 溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加
溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加_______ (填化学式)溶液,观察到_______ 的实验现象,证明了反应中有 生成。
生成。
实验Ⅱ:向pH=1.10的_______ (填化学式)溶液中加入过量铜粉并充分振荡,无明显现象。
探究结论:综合“实验Ⅰ”和“实验Ⅱ”可知,假设_______ (填“ⅰ”或“ⅱ”)成立。
(5)查阅资料知,铜粉与 溶液可能涉及的反应有;
溶液可能涉及的反应有;
反应①: ;
;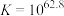 ;速率很慢。
;速率很慢。
反应②: ;
;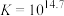 ,速率较快。
,速率较快。
反应③: ;
;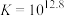 ;速率很快。
;速率很快。
反应④: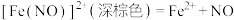
(a)对反应①来说, 起到的作用为
起到的作用为_______ ;为验证这一作用,设计的实验方案为_______ 。
(b)“实验Ⅰ”反应中无论Cu过量多少,始终都能检测到 的存在,原因是
的存在,原因是_______ 。
 溶液的反应原理。
溶液的反应原理。(1)配制溶液
用
 标准试剂配制
标准试剂配制 溶液,下列仪器中无需使用的有
溶液,下列仪器中无需使用的有
(2)测定
 溶液的pH
溶液的pH用
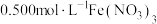 溶液的pH为1.10。
溶液的pH为1.10。(3)提出假设
假设ⅰ:

假设ⅱ:
 将Cu氧化,反应的离子方程式为:
将Cu氧化,反应的离子方程式为:
(4)实验探究
实验Ⅰ:向
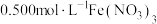 溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加
溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加 生成。
生成。实验Ⅱ:向pH=1.10的
探究结论:综合“实验Ⅰ”和“实验Ⅱ”可知,假设
(5)查阅资料知,铜粉与
 溶液可能涉及的反应有;
溶液可能涉及的反应有;反应①:
 ;
;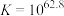 ;速率很慢。
;速率很慢。反应②:
 ;
;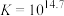 ,速率较快。
,速率较快。反应③:
 ;
;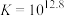 ;速率很快。
;速率很快。反应④:
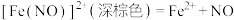
(a)对反应①来说,
 起到的作用为
起到的作用为(b)“实验Ⅰ”反应中无论Cu过量多少,始终都能检测到
 的存在,原因是
的存在,原因是
您最近一年使用:0次
5 .  可作为水溶液中
可作为水溶液中 歧化反应
歧化反应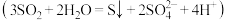 的催化剂。某实验小组为探究浓度、催化剂和溶液酸性对
的催化剂。某实验小组为探究浓度、催化剂和溶液酸性对 歧化反应速率的影响,分别在盛有反应物的试管中加入2mL相应试剂,密闭放置观察现象。
歧化反应速率的影响,分别在盛有反应物的试管中加入2mL相应试剂,密闭放置观察现象。
回答下列问题:
(1)实验①、②说明 是水溶液中
是水溶液中 歧化反应的催化剂,则a应是
歧化反应的催化剂,则a应是___________ (填化学式)。
(2)实验②、③的目的是___________ 。
(3)实验①、⑤说明___________ ,实验②是实验④的对比实验,则
___________ ,可得出的结论是___________ 。
(4) 可作为水溶液中
可作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.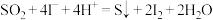
ii.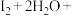 ___________
___________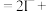 ___________+
___________+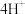 。
。___________
 可作为水溶液中
可作为水溶液中 歧化反应
歧化反应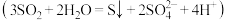 的催化剂。某实验小组为探究浓度、催化剂和溶液酸性对
的催化剂。某实验小组为探究浓度、催化剂和溶液酸性对 歧化反应速率的影响,分别在盛有反应物的试管中加入2mL相应试剂,密闭放置观察现象。
歧化反应速率的影响,分别在盛有反应物的试管中加入2mL相应试剂,密闭放置观察现象。| 实验编号 | 反应物 | 试剂组成 | 实验现象 |
| ① | 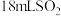 饱和溶液 饱和溶液 | a | 无明显现象 |
| ② | 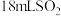 饱和溶液 饱和溶液 | 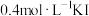 | 一段时间出现浑浊 |
| ③ | 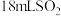 稀溶液 稀溶液 | 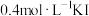 | 出现浑浊较②慢 |
| ④ | 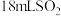 饱和溶液 饱和溶液 | 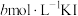 、 、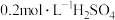 | 出现浑浊较②快 |
| ⑤ | 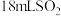 饱和溶液 饱和溶液 | 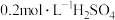 | 无明显现象 |
(1)实验①、②说明
 是水溶液中
是水溶液中 歧化反应的催化剂,则a应是
歧化反应的催化剂,则a应是(2)实验②、③的目的是
(3)实验①、⑤说明

(4)
 可作为水溶液中
可作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
歧化反应的催化剂,可能的催化过程如下。将ii补充完整。i.
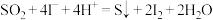
ii.
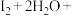 ___________
___________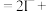 ___________+
___________+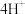 。
。
您最近一年使用:0次
名校
解题方法
6 . 用硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO 转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表。
表中a、b的值分别为:a=___________ 、b=___________
(2)该反应的离子方程式为___________ 。
(3)若t1<t2,则根据实验①和②得到的结论是___________ 。
(4)某小组同学按实验①进行实验,测得溶液褪色时间t1=2.5min,求该条件下的化学反应速率v(H2C2O4)=___________ ,其反应速率变化如图,其中x1~x2时间内速率变快的主要原因可能是:产物Mn2+是反应的催化剂、___________ 。

(5)请你设计实验④验证MnSO4对该反应起催化作用,完成下表中内容。
 转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表。
| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/LKMnO4溶的体积/mL | 蒸馏水体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
(2)该反应的离子方程式为
(3)若t1<t2,则根据实验①和②得到的结论是
(4)某小组同学按实验①进行实验,测得溶液褪色时间t1=2.5min,求该条件下的化学反应速率v(H2C2O4)=

(5)请你设计实验④验证MnSO4对该反应起催化作用,完成下表中内容。
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
您最近一年使用:0次
名校
7 . H2O2是一种绿色试剂,在化学工业中用作生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂。某化学小组欲探究双氧水的性质做了如下实验:MnO2是中学实验中的常用试剂。常用来作为H2O2分解实验的催化剂。
甲同学设计如下实验探究影响双氧水分解反应速率的外界因素。
(1)写出相关反应方程式___________ 。
(2)若 且实验②反应后MnO2的质量和化学性质不变,则实验结论是
且实验②反应后MnO2的质量和化学性质不变,则实验结论是_________________ 。
(3)设计实验①和③的目的是___________________ 。
甲同学设计如下实验探究影响双氧水分解反应速率的外界因素。
| 实验 | 30%的双氧水/ | 温度/℃ | MnO2/g | 收集等体积的O2所用时间/s |
| ① | 20ml | 25 | 0 | a |
| ② | 20ml | 25 | 1 | b |
| ③ | 20ml | 50 | 0 | c |
(2)若
 且实验②反应后MnO2的质量和化学性质不变,则实验结论是
且实验②反应后MnO2的质量和化学性质不变,则实验结论是(3)设计实验①和③的目的是
您最近一年使用:0次
名校
解题方法
8 . 某实验小组探究外界条件对化学反应速率的影响,进行了以下实验。
Ⅰ.探究温度、浓度对硫代硫酸钠与稀硫酸反应速率的影响
(1)写出Na2S2O3与H2SO4反应的离子方程式________ ;
(2)该小组同学设计了如下表所示系列实验:
实验①和②探究温度对该反应速率的影响,则实验②中,t1=___________ (填“20℃”或“60℃”)、V2=___________ mL。若V5=6.0,实验①和③的实验目的是_______ 。
Ⅱ.探究催化剂对H2O2分解速率的影响
(3)按下图进行定量实验研究。挤压注射器使FeCl3溶液全部加入试管中,记录数据;用CuCl2溶液代替FeCl3溶液进行平行实验,比较催化剂对反应速率的影响。该实验需测定的实验数据是________ 。

(4)用上图中的装置,探究MnO2催化H2O2分解的最佳条件。此时注射器中应加入的试剂是___________ 。挤压注射器使液体全部加入试管中开始至不再有气体产生,记录反应时间。反应物用量和反应时间如下表:
分析表中数据,从实验效果和“绿色化学”的角度考虑,H2O2的浓度一定时,加入___________ g的MnO2为较佳选择。
Ⅰ.探究温度、浓度对硫代硫酸钠与稀硫酸反应速率的影响
(1)写出Na2S2O3与H2SO4反应的离子方程式
(2)该小组同学设计了如下表所示系列实验:
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | H2SO4稀溶液 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | t1 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | t2 | V4 | 0.10 | V5 | 0.50 | V6 |
Ⅱ.探究催化剂对H2O2分解速率的影响
(3)按下图进行定量实验研究。挤压注射器使FeCl3溶液全部加入试管中,记录数据;用CuCl2溶液代替FeCl3溶液进行平行实验,比较催化剂对反应速率的影响。该实验需测定的实验数据是

(4)用上图中的装置,探究MnO2催化H2O2分解的最佳条件。此时注射器中应加入的试剂是
| H2O2 时间 | 0.1g | 0.3g | 0.8g |
| 10mL1.5% | 223s | 67s | 56s |
| 10mL3.0% | 308s | 109s | 98s |
| 10mL4.5% | 395s | 149s | 116s |
您最近一年使用:0次
名校
9 . Ⅰ.作为绿色氧化剂和消毒剂,H2O2在工业生产及日常生活中应用广泛。已知:2H2O2(aq)=2H2O(l)+O2(g)。回答下列问题:
(1)实验表明,在54℃下恒温储存两周,H2O2的浓度仍然保持为原来的99%,这说明H2O2分解反应的活化能比较___________ (填“高”或“低”)。
Ⅱ.某探究小组通过测定H2O2分解过程中生成氧气的量来研究影响H2O2分解反应速率的因素,已知实验温度为343K和283K,每次实验使用3 mL 30% H2O2溶液。
(2)请完成以下实验设计表:
(3)实验后整理数据,得出H2O2的浓度随时间变化的关系如下图所示。

①曲线c表示实验___________ (填“01”“02”或“03”)中H2O2的浓度变化。
②由该实验得出的结论是:___________ 。
Ⅲ.H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学设计了如图甲的实验装置。

(4)有同学提出将0.1mol·L-1 FeCl3改为___________ mol·L-1 Fe2(SO4)3更为合理,其理由是___________ 。
(1)实验表明,在54℃下恒温储存两周,H2O2的浓度仍然保持为原来的99%,这说明H2O2分解反应的活化能比较
Ⅱ.某探究小组通过测定H2O2分解过程中生成氧气的量来研究影响H2O2分解反应速率的因素,已知实验温度为343K和283K,每次实验使用3 mL 30% H2O2溶液。
(2)请完成以下实验设计表:
| 编号 | 实验目的 | 温度/K | 催化剂(MnO2)的质量/g |
| 01 | 为以下实验作参照 | 343 | 0 |
| 02 | 探究 | 283 | 0 |
| 03 | 探究 | 343 | 3 |

①曲线c表示实验
②由该实验得出的结论是:
Ⅲ.H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学设计了如图甲的实验装置。

(4)有同学提出将0.1mol·L-1 FeCl3改为
您最近一年使用:0次
名校
解题方法
10 . Ⅰ.为比较 和
和 对
对 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
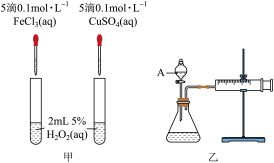
(1)定性分析:如图甲可通过观察_______ 的快慢,定性比较得出结论。有同学提出将 改为
改为_______  ,更为合理,其理由是
,更为合理,其理由是_______ 。
(2)定量分析。如图乙所示,实验时均以生成 气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是
气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是_______ 。
(3)查阅资料得知:将作为催化剂的 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从
均参加了反应,试从催化剂的角度 分析,这两个氧化还原反应的离子方程式分别是: 和
和_______ 。
Ⅱ.乙同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
(4)该实验①、②可探究_______ 对反应速率的影响;该实验①、③可探究硫酸浓度对反应速率的影响,因此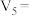
_______ 。
 和
和 对
对 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察
 改为
改为 ,更为合理,其理由是
,更为合理,其理由是(2)定量分析。如图乙所示,实验时均以生成
 气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是
气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是(3)查阅资料得知:将作为催化剂的
 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从
均参加了反应,试从 和
和Ⅱ.乙同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
| 实验序号 | 反应温度/ |  浓度 浓度 | 稀硫酸 |  | ||
 |  |  |  |  | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 |  | 0.10 |  | 0.50 |  |
| ③ | 20 |  | 0.10 | 4.0 | 0.50 | 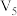 |
(4)该实验①、②可探究
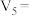
您最近一年使用:0次



