 转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表。
| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/LKMnO4溶的体积/mL | 蒸馏水体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
(2)该反应的离子方程式为
(3)若t1<t2,则根据实验①和②得到的结论是
(4)某小组同学按实验①进行实验,测得溶液褪色时间t1=2.5min,求该条件下的化学反应速率v(H2C2O4)=

(5)请你设计实验④验证MnSO4对该反应起催化作用,完成下表中内容。
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
相似题推荐
 )是生产医药、农药、染料的重要原料。硫酰氯与硫酸的部分性质如下表:
)是生产医药、农药、染料的重要原料。硫酰氯与硫酸的部分性质如下表:| 物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
 | -54.1 | 69.1 | ①易水解,产生大量白雾,生成两种强酸 ②易分解: 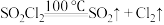 |
 | 10.4 | 338 | 强吸水性、稳定不易分解 |
 ΔH<0,其实验装置如图所示(夹持仪器已省略):
ΔH<0,其实验装置如图所示(夹持仪器已省略):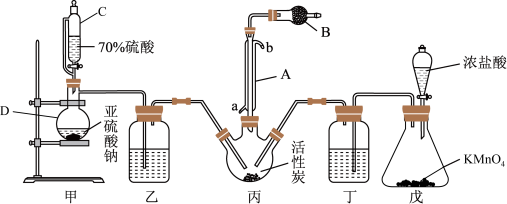
(1)仪器B的名称
(2)装置戊中发生的反应的离子方程式为
(3)若缺少装置乙和丁,对产品硫酰氯会有何影响,请用化学方程式表示
(4)装置甲发生反应的化学方程式为
(5)实验开始时,戊中开始加入pg
 固体,假设
固体,假设 在过量浓盐酸的作用下完全反应,若实验结束后得到硫酰氯qmol,请计算硫酰氯的产率
在过量浓盐酸的作用下完全反应,若实验结束后得到硫酰氯qmol,请计算硫酰氯的产率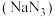 是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:
是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:Ⅰ.实验室制备

水合肼
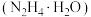 与亚硝酸甲酯
与亚硝酸甲酯 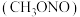 在氢氧化钠存在下制备
在氢氧化钠存在下制备  ,其反应装置如图所示:
,其反应装置如图所示:
 无色无味,微溶于醇,溶于水。
无色无味,微溶于醇,溶于水。(1)
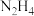 的电子式为
的电子式为 晶体中阴离子与阳离子个数之比为
晶体中阴离子与阳离子个数之比为(2)装置中多孔球泡的作用是
(3)锥形瓶中水合与亚硝酸甲酯在
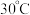 时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:
时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:Ⅱ.回收甲醇
将制备反应后所得混合溶液加入烧瓶中,按照图所示装置进行减压蒸馏。
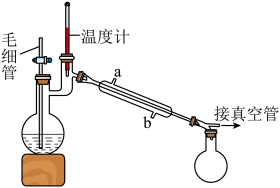
①
| 物质 |  | 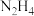 |  |
沸点  | 64.7 | 113.5 | 300 |
 在
在 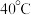 时分解。
时分解。(4)实验时冷凝管中冷却水要
 进
进  出”或 “
出”或 “ 进
进  出”)。
出”)。(5)甲醇回收时需用减压蒸馏的原因是
Ⅲ.产品提取及纯度测定
将蒸馏后所得母液降温结晶,过滤得
 湿品;再用去离子水重结晶得
湿品;再用去离子水重结晶得  产品并用碘量法测定产品纯度。取产品
产品并用碘量法测定产品纯度。取产品  加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入
加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入  溶液,溶液呈紫红色;再加入足量
溶液,溶液呈紫红色;再加入足量 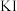 溶液消耗过量的
溶液消耗过量的 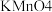 溶液;其后用
溶液;其后用 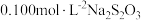 ,标准溶液滴定所产生的
,标准溶液滴定所产生的 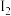 ,消耗
,消耗  溶液
溶液 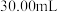 。
。(6)实验所得产品的纯度为
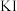 溶液有部分被空气中的氧气氧化,则测得产品的纯度
溶液有部分被空气中的氧气氧化,则测得产品的纯度已知:①产品中杂质不参与反应。
②测定过程中发生的反应:
 ;
;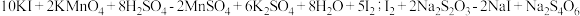 。
。
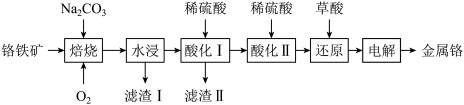
已知:①NaFeO2极易水解;
②Cr(VI)在中性或碱性溶液中以
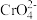 形式存在,在酸性条件下以
形式存在,在酸性条件下以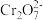 形式存在;
形式存在;③常温时,Al(OH)3+OH-

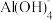 [的平衡常数:K=100.63,Al(OH)3的溶度积常数:Ksp[A1(OH)3]=10-33;
[的平衡常数:K=100.63,Al(OH)3的溶度积常数:Ksp[A1(OH)3]=10-33;回答下列问题:。
(1)Fe(CrO2)2中铬元素的化合价为
(2)“焙烧”时,气体和矿料逆流加入的原因是
(3)“水浸”时,生成Fe(OH)3的离子方程式为
(4)常温下,“酸化I”时,铝元素完全转化为沉淀的pH范围为
(5)“酸化Ⅱ”的目的是
(6)“还原”时,反应的离子方程式为
(7)“电解”时,金属铬在
【推荐1】(Ⅰ)某化学兴趣小组要完成中和热的测定.回答下列问题:
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L﹣1盐酸、0.55mol•L﹣1NaOH溶液,实验尚缺少的玻璃用品是
(2)已知:反应后溶液的比热容c为4.18J·℃﹣1•g﹣1,0.5mol•L﹣1盐酸和0.55mol·L﹣1NaOH溶液的密度均为1g·cm﹣3.实验时记录的实验数据如下:
实验 次数 | 反应物及用量 | 溶 液 温 度 | ||
t1 | t2 | |||
1 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.3℃ |
2 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.5℃ |
①盐酸和氢氧化钠反应的中和热△H1=
②已知:CH3COOH(aq)⇌CH3COO-(aq)+H+(aq) △H2>0 ,
CH3COOH(aq)+OH-(aq)= CH3COO-(aq)+H20(l) △H3 则△H3
(Ⅱ)某实验小组利用硫酸酸化的KMnO4与H2C2O4反应来探究“外界条件对化学反应速率的影响”。该小组实验方案如下(实验测定KMnO4溶液完全褪色时间)。回答下列问题:
实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||||
① | 0.20 | 2.0 | 0.010 | 4.0 | 2.0 | 25 | t1 |
② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 50 | t3 |
(3)上述反应的离子方程式为
(4)t1
(5)实验②和实验③两组实验的目的是
(6)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。
猜想②:
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰
(1)H2O2的Ka1=2.24×10-12,H2O2的酸性
 的浓度越大,H2O2的分解速率越快。常温下,一定浓度的H2O2,pH增大,H2O2分解速率增大的原因是
的浓度越大,H2O2的分解速率越快。常温下,一定浓度的H2O2,pH增大,H2O2分解速率增大的原因是(2)早期制备方法:Ba(NO3)2
 BaO
BaO BaO2
BaO2
 滤液
滤液 H2O2
H2O2①II为可逆反应,促进该反应正向进行的措施是
②III中生成H2O2,反应的化学方程式是
(3)电化学制备方法:已知反应2H2O2=2H2O+O2↑能自发进行,反向不能自发进行,通过电解可以实现由H2O和O2为原料制备H2O2,如图为制备装置示意图。

①a极的电极反应式是
②下列说法正确的是
A.该装置可以实现电能转化为化学能
B.通电后,电极b附近溶液pH增大
C.该方法相较于早期制备方法具有原料廉价,对环境友好等优点
(4)H2O2含量的测定:已知反应2
 +5H2O2+6H+=2Mn2++5O2↑+8H2O;取10.00mL电解池左池中的电解液A,配制成250mL溶液B,取25.00mLB溶液于锥形瓶中;往其中滴入0.10mol·L-1的酸性KMnO4溶液,当锥形瓶中出现
+5H2O2+6H+=2Mn2++5O2↑+8H2O;取10.00mL电解池左池中的电解液A,配制成250mL溶液B,取25.00mLB溶液于锥形瓶中;往其中滴入0.10mol·L-1的酸性KMnO4溶液,当锥形瓶中出现(1)氨水可以脱除烟气中的SO2.已知SO2的国家排放标准为80mg·m−3。氨水脱除烟气中的SO2是在吸收塔中进行的,控制其他实验条件相同,仅改变吸收塔的温度,实验结果如图所示,为了尽可能获得NH4HSO3,则吸收塔合适的温度约为31℃的原因是

(2)钠钙双碱法可高效脱除烟气中的SO2,脱硫的流程如图所示。

①“吸收”时气液逆流在吸收塔中接触,吸收时不宜直接使用石灰乳的原因是
②水溶液中H2SO3、
 、
、 随pH的分布如图所示,“再生液”用NaOH溶液调pH至7~9得到溶液X,溶液X吸收SO2时主要反应的离子方程式为
随pH的分布如图所示,“再生液”用NaOH溶液调pH至7~9得到溶液X,溶液X吸收SO2时主要反应的离子方程式为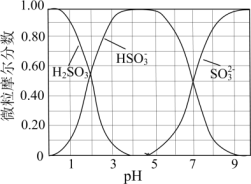
③已知Na2SO3的溶解度随着pH增大而减小。溶液X的pH对脱硫效率的影响如图所示。当pH由6升高到7时,脱硫效率迅速增大的原因为

(1)已知相关反应的热力学数据如下。
| 反应 |  | 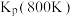 |
 |  | |
 | 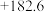 | |
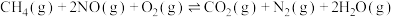 | 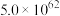 | |
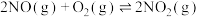 | 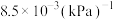 |
 脱硝反应
脱硝反应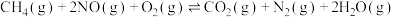 的
的
 。
。 时,为了提高该反应中NO的平衡转化率,理论上可采取的措施是
时,为了提高该反应中NO的平衡转化率,理论上可采取的措施是A.恒容时增大
 的压强 B.减小反应容器的容积
的压强 B.减小反应容器的容积C.移去部分
 D.选择合适的催化剂
D.选择合适的催化剂②
 另一脱硝反应
另一脱硝反应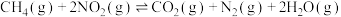 的
的
 。
。(2)模拟工业尾气脱硝:一定条件下,将
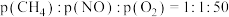 的气体与Ar混合,匀速通过催化脱硝反应器,测得NO去除率和
的气体与Ar混合,匀速通过催化脱硝反应器,测得NO去除率和 转化率随反应温度的变化如图。
转化率随反应温度的变化如图。
当温度低于
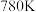 时,NO的去除率随温度升高而升高,可能原因是
时,NO的去除率随温度升高而升高,可能原因是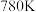 时,NO的去除率随温度升高而降低,结合(1)的信息分析其可能原因是
时,NO的去除率随温度升高而降低,结合(1)的信息分析其可能原因是(3)中国科学家利用Cu催化剂实现电化学脱硝。通过理论计算推测电解池阴极上NO可能的转化机理及转化步骤的活化能分别如下(*表示催化剂表面吸附位,如
 表示吸附于催化剂表面的NOH)。
表示吸附于催化剂表面的NOH)。I.

Ⅱ.
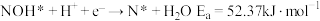
Ⅲ.

Ⅳ.

V.
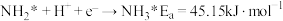
上述反应机理中,Ⅱ~V中速率最慢的步骤是
 电子流过,其中生成
电子流过,其中生成 的选择性为95%,电解池阴极生成的
的选择性为95%,电解池阴极生成的 的物质的量为
的物质的量为(1)尿素/H2O2溶液脱硫脱硝。尿素[CO(NH2)2]是一种强还原剂。60 ℃时在一定浓度的尿素/H2O2溶液中通入含有SO2和NO的烟气,烟气中有毒气体被一定程度吸收。尿素/H2O2溶液对SO2具有很高的去除效率,写出尿素和H2O2溶液吸收SO2,生成硫酸铵和CO2的化学方程式:
(2)除去烟气中的NOx,利用氢气选择性催化还原(H2SCR)是目前消除NO的理想方法。H2SCR在PtHY催化剂表面的反应机理如图所示:
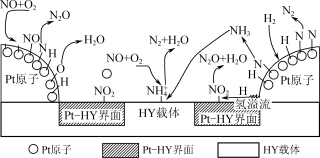
 N2+2H2O,则其副反应的化学方程式为
N2+2H2O,则其副反应的化学方程式为②已知在HY载体表面发生反应的NO、O2的物质的量之比为4∶1,则反应中每生成28 g N2,转移的电子的物质的量为
(3)V2O5/炭基材料(活性炭、活性焦、活炭纤维)也可以脱硫脱硝。V2O5/炭基材料脱硫原理是SO2在炭表面被吸附,吸附态SO2在炭表面被催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫时,通过红外光谱发现,脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,该脱硫反应过程可描述为
②V2O5/炭基材料脱硫时,控制一定气体流速和温度,考察了烟气中O2的存在对V2O5/炭基材料催化剂脱硫脱硝活性的影响,结果如图所示,当O2浓度过高时,去除率下降,其可能原因是

(1)CO2催化加氢制有机物是实现“碳中和”的重要途径。高效催化剂对CO2加氢制甲醇的反应速率影响很大。下图是CO2加氢制甲醇在不同催化条件下两种反应路径的势能图。

①CO2加氢制甲醇的热化学方程式为
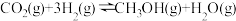 ΔH=
ΔH=②由图中信息可知,
③下列方法中能提高CO2平衡转化率的是
a.升高温度 b.恒压充入氦气 c.恒容充入H2 d.减小反应容器体积 e.选用合适的催化剂
(2)CO2催化加氢制甲醇过程中存在竞争反应:
 。在压强为p的恒温恒压密闭容器中,加入1molCO2和3molH2反应并达到平衡状态,CO2平衡转化率为40%,甲醇的选择性为50%(甲醇的选择性
。在压强为p的恒温恒压密闭容器中,加入1molCO2和3molH2反应并达到平衡状态,CO2平衡转化率为40%,甲醇的选择性为50%(甲醇的选择性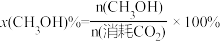 ),计算
),计算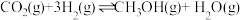 在该温度下的平衡常数Kp=
在该温度下的平衡常数Kp=(3)CO2催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图中直线a所示,已知Arrhenius经验公式为
 (a为活化能,k为速率常数,R、C为常数)。
(a为活化能,k为速率常数,R、C为常数)。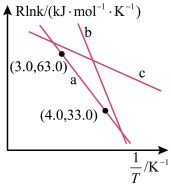
①该反应的活化能Ea=
②直线
 的关系。
的关系。
 平衡体系的影响。
平衡体系的影响。实验Ⅰ:探究KCl对
 和
和 平衡体系的影响
平衡体系的影响将等体积、低浓度的
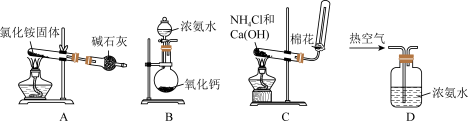
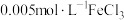 溶液(已用稀盐酸酸化)和
溶液(已用稀盐酸酸化)和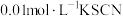 溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
②
 在水溶液中由于水解而显黄色;
在水溶液中由于水解而显黄色; 溶液中存在
溶液中存在 (黄色)。
(黄色)。(1)稀盐酸酸化
 溶液的目的是
溶液的目的是 溶液制备
溶液制备 和
和 平衡体系,是为了避免
平衡体系,是为了避免(2)从实验结果来看,KCl溶液确实对
 和
和 平衡体系有影响,且随着KCl浓度增大,
平衡体系有影响,且随着KCl浓度增大, 平衡向
平衡向同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使
 和
和 平衡状态因盐效应而发生变化。
平衡状态因盐效应而发生变化。原因2:溶液中存在副反应
 ,离子浓度发生变化,导致
,离子浓度发生变化,导致 和
和 平衡状态发生变化。
平衡状态发生变化。(3)基于以上分析,该组同学取等体积的溶液a,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
| 序号 | 加入少量盐 | 溶液颜色 |
| 1 | 无 | 红色 |
| 2 | KCl | 变浅 |
| 3 |  | 略变浅 |
| 4 | NaCl | 变浅程度较大 |
 和
和 平衡体系的是
平衡体系的是a.1和2 b.1和3 c.1和4
②选择实验
 的盐效应弱于
的盐效应弱于 的盐效应。
的盐效应。(4)取等体积的溶液a继续进行实验,结果如下表。
| 序号 | 加入溶液 | 溶液颜色 |
| 5 | 1mL浓盐酸 | 明显变浅,溶液偏黄 |
| 6 | 1mL去离子水 | 略变浅 |
 和
和 平衡体系,结合实验现象及化学用语分析副反应对
平衡体系,结合实验现象及化学用语分析副反应对 和
和 平衡体系有影响的原因:
平衡体系有影响的原因: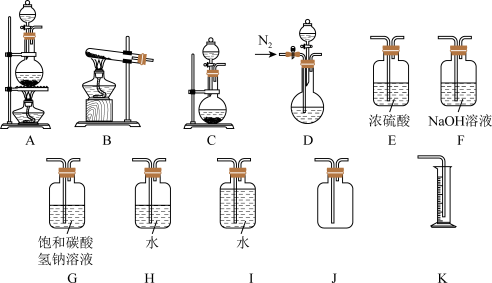
(1)利用Cu和浓硝酸反应制备NO2,用过氧化氢溶液和MnO2制取O2,根据反应原理应选用
(2)欲用石灰石和浓盐酸反应制取纯净干燥的CO2气体,将你所选的仪器按气体由左向右方向连接,连接顺序为:
(3)某小组为了探究Ag与浓硝酸反应过程中可能产生NO,设计了一连接顺序为D→H→I→K的实验装置。
①反应开始前通入N2的目的是
②反应结束,若H瓶中溶液体积为100mL,从中取出25.00mL溶液以酚酞作指示剂,用0.1000mol·L—1NaOH溶液进行滴定,两次滴定用去NaOH溶液的体积分别为16.98mL和17.02mL,则该瓶中硝酸的物质的量浓度为
(4)某同学设计下列四种制备NH3的方法,不合理的是
 是工业制备的一种重要原料,很多物质的制备都需要用到氯气,比如工业上用
是工业制备的一种重要原料,很多物质的制备都需要用到氯气,比如工业上用 制备
制备 ,反应原理为:
,反应原理为: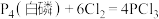 ,
,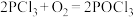 。已知:
。已知: 、
、 的部分性质如下:
的部分性质如下:| 熔点/℃ | 沸点/℃ | 相对分子质量 | 其它 | |
 | -112 | 75.5 | 137.5 | 遇水生成 和HCl 和HCl |
 | 2 | 105.3 | 153.5 | 遇水生成 和HCl 和HCl |
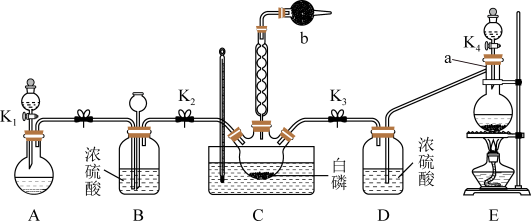
 空间构型为
空间构型为(2)装置E中用软锰矿制备气体的离子方程式为
(3)装置C中反应温度控制在60~65℃,原因是
(4)通过测定三氯氧磷粗产品中氯元素含量,可进一步计算产品三氯氧磷的纯度,实验步骤如下:
①取a g产品置于盛50.00mL蒸馏水的水解瓶中,摇动至完全水解,将水解液配成100.00mL溶液,预处理排除含磷粒子的影响。
②取10.00mL溶液于锥形瓶中,向其中加入
 mol/L的
mol/L的 溶液
溶液 mL,使
mL,使 完全沉淀,然后选择
完全沉淀,然后选择 作指示剂,用
作指示剂,用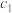 mo/L
mo/L 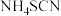 溶液滴定过量
溶液滴定过量 至终点(
至终点(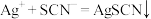 ),记下所用体积为
),记下所用体积为 mL。滴定终点的现象:
mL。滴定终点的现象:(5)产品中氯元素的质量分数为
(6)资料表明,
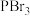 与
与 性质相近,乙醇在过量无水
性质相近,乙醇在过量无水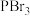 的作用下制备溴乙烷的反应机理如下图所示,请写出该条件下制备溴乙烷总反应方程式
的作用下制备溴乙烷的反应机理如下图所示,请写出该条件下制备溴乙烷总反应方程式



